扩展功能
文章信息
- 丁显飞, 周学良, 豆萌萌, 李砺锋, 郭丽娜, 王峰, 樊青霞
- DING Xianfei, ZHOU Xueliang, DOU Mengmeng, LI Lifeng, GUO Lina, WANG Feng, FAN Qingxia
- 吉林大学学报(医学版), 2016, 42(04): 783-788
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 783-788
- 10.13481/j.1671-587x.20160428
-
文章历史
- 收稿日期: 2016-01-12
2. 郑州大学第一附属医院中西医科, 河南 郑州 450052;
3. 辽宁医学院护理学院, 辽宁 锦州 121000
2. Department of Integrated Traditional Chinese and Western Medicine, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
3. College of Nursing, Liaoning Medical University, Jinzhou 121000, China
乳腺癌已经成为全球女性癌症死亡最常见的原因之一,其死亡人数占女性癌症患者总死亡人数的14%[1]。目前,乳腺癌在手术治疗、放疗、化疗和内分泌治疗等方面已经取得了明显的疗效,但其5年生存率依然较低。针对与乳腺癌发生和进展有关的信号通路进行靶向药物的开发及临床应用已经成为乳腺癌治疗领域研究的新热点,以人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)为靶点的乳腺癌治疗药物赫赛汀[2]等,已经显示出了初期的良好治疗效应,但由于药物耐受性[3]和基因突变限制了其在临床中的应用,所以寻找新的靶点用于改善乳腺癌患者的生存预后有重要意义。研究[4, 5, 6, 7, 8, 9]显示:哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路在肿瘤细胞生长、增殖、转移、代谢及新生血管生成等方面起着极其关键的作用,在尿路上皮癌、乳腺癌、肝细胞癌和肺癌的发生发展过程中,均存在mTOR通路的异常激活,而且mTOR通路在乳腺癌分子通路中有极高的突变率,其在乳腺癌的疾病进展中起着至关重要的作用。
目前,mTOR抑制剂依维莫司已经用于晚期肾细胞癌和胰腺神经内分泌瘤患者的治疗,但是mTOR通路与乳腺癌预后之间的关系仍存有争议。本研究通过系统评价mTOR的表达与乳腺癌患者预后的关系,为依维莫司等mTOR抑制剂应用于乳腺癌的治疗提供循证医学的依据。
1 资料与方法 1.1 文献纳入标准①明确确诊的原发性乳腺癌;②采用免疫组织化学法检测mTOR的表达;③研究目的是mTOR的表达与预后指标中无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)之间的关系;④提供了有关生存研究的风险比(hazard ratio,HR)以及95% CI或者生存曲线( Kaplan-Meier 曲线)。
1.2 文献排除标准①动物性研究;②细胞系研究;③综述性文献;④未提供关于生存预后数据的文献。
1.3 检索策略计算机检索PubMed、EMBase、 Cochrane Library、ISI Web of Science和中国知网等数据库;检索采用主题词与自由词相结合的方式,检索时间为建库至2015年12月24日,英文检索词包括:“breast cancer” 或“breast carcinoma”或“breast neoplasm”或 “breast tumor”、“mammalian target of rapamycin”或“mTOR” 、“prognosis”或“survival”;中文检索词包括:“乳腺癌”、“mTOR”或“雷帕霉素哺乳动物靶蛋白”、“生存”或者“预后”;并对纳入文献的参考文献以及相关研究的综述进一步手工检索。
1.4 文献筛选按照预先设计的信息提取表,由2名研究者独立检索文献,然后对题目及摘要符合纳入/排除标准的文献进行评价,若文献题目及摘要难以判断则查阅全文进行核实,意见不一致时由第三方决定是否采用。
1.5 资料提取资料提取也由2名研究者独 立完成,任何分歧问题都通过小组讨论解决。提取信息主要包括:①文献的题目 、作者、发表日期及来源等;②患者的mTOR表达水平、年龄、病理类型、分期和国籍等;③预后指标;④方法学质量评价指标。
1.6 统计学分析采用STATA12.0软件对收集的数据进行Meta分析。DFS、OS均以HR为效应量,各效应量以95% CI 表示,如果DFS和OS二项指标的HR > 1及95% CI 不与1重叠,则提示mTOR高表达是乳腺癌预后的危险因素,即mTOR表达量越高,患者预后越差;若HR < 1,则反之。大部分研究提供了直接的HR和95% CI,对于一些无直接提供数据的研究[10, 11],使用Engauge Digitizer 4.1软件通过Kaplan-Meier生存曲线推算其HR及95% CI[12, 13, 14]。异质性检验采用χ2 检验和I2验检,若P< 0.1或I2 > 50%,说明存在异质性。若无异质性,则采用固定效应模型进行Meta分析;若存在异质性,则采用随机效应模型进行Meta 分析。
2 结 果 2.1 纳入研究的基本特征经检索初步筛选文献619篇,去除重复文献后共341篇,阅读文献题目及摘要,排除系统回顾、明显不相关文献、综述和动物实验后共68篇,仔细阅读全文,排除未进行随访及计算HR的文献,最终共有7篇[10, 11, 15, 16, 17, 18, 19]文献纳入本次Meta分析中,共计1758例患者。在汇总分析中,若文献同时提供了多变量分析和单变量分析的结果,则采用多变量分析的HR,因为多变量分析考虑到混杂因素,较单变量分析精确。所有纳入文献均为免疫组织化学(immunohistochemistry,IHC)研究,研究均采用石蜡包埋标本;2篇文献采用兔单克隆抗体(Ser2448),1篇文献采用兔多克隆抗体(Ser2448),其余研究采用抗体各异。纳入文献的基本特征见表1。
| Author | Country | Year | No.of patients (mTOR high/low) | Age(year) | Pathological type (IDC/ILC/Other ) | Stage (Ⅰ/Ⅱ/Ⅲ/Ⅳ) |
| Panagiotis B,et al[10] | Greece | 2010 | 192(131/61) | 56 (25-87) | 155/30/7 | 48/132/12/0 |
| Shir-Hwa U,et al[11] | China | 2012 | 172(124/48) | ≤ 45(65),>45(107) | 0/157/15 | Ⅰ-Ⅱ( 125) |
| Jungsuk A,et al[15] | Korea | 2010 | 530(207/136) | 46.0( 26-85) | 497/33/0 | 158/264/93/15 |
| Shikha B,et al[16] | US | 2006 | 138(33/105) | NA | 138/0/0 | NA |
| MA BL,et al[17] | China | 2015 | 285(206/79) | 28-73 | 244/11/30 | Ⅰ(65),Ⅱ(220) |
| LIU XY,et al[18] | China | 2013 | 60(NA) | 47.9-71.5 | 58/2/0 | 10/29/21/0 |
| YU LN,et al[19] | China | 2015 | 110(68/42) | 49-70 | 98/12/0 | 20/58/32/0 |
| Author | Median follow-up period(month) | HR(95%CI)of DFS | HR(95%CI)of OS | LHC positive cut off value | Location of cell | |
| Panagiotis B,et al[10] | NA | NA | 2.35(0.96-5.76) | NA | Cytoplasm | |
| Shir-Hwa U,et al[11] | 68.84 | NA | 2.89(1.29-6.47) | 1%-10%MSP,5%-50%WP | Cytoplasm,Nuclear | |
| Jungsuk A,et al[15] | 58.50 | 0.794(0.515-1.225) | NA | ≥10%SP,>50%WP | Cytoplasm,Nuclear | |
| Shikha B,et al[16] | 60.00 | 3.10(1.27-7.56) | NA | NA | Cytoplasm,Nuclear | |
| MA BL,et al[17] | 71.80 | 1.91(0.78-4.68) | NA | >80% | Cytoplasm | |
| LIU YX,et al[18] | 53.40 | 3.212(1.291-7.992) | NA | NA | Cytoplasm,Nuclear | |
| YU LN,et al[19] | NA | 3.21(1.29-7.99) | NA | ≥10% | Cytoplasm | |
| NA: Information not available;IDC: Invasive ductal carcinoma;ILC:Invasive lobular carcinoma;SP: Strongly positive;MSP: Moderately strong positive;WP:Weakly positive. | ||||||
采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)对纳入的7篇队列研究进行质量评价[20],包括三大块共8个条目,具体包括研究人群选择、可比性和结果评价。NOS对文献质量的评价采用了星级系统的半量化原则,满分为8颗星,5颗星以上属于高质量文献。见表2。
| Author | Selection | Comparability | ||||
| Representativeness of mTOR positive arm | Selection of comparative mTOR negative arm (s) | Ascertainment of mTOR positive regimen | Demonstration that outcome of interest was not present at start of study | Comparability between patients in different mTOR positive and negative arms-main factor: IHC positive cut off value | ||
| Panagiotis B,et al[10] | * | * | * | * | - | |
| Shir-Hwa U,et al[11] | * | * | * | * | * | |
| Jungsuk A,et al[15] | * | * | * | * | * | |
| Shikha B,et al[16] | * | * | * | * | - | |
| MA BL,et al[17] | * | * | * | * | * | |
| LIU YX,et al [18] | * | * | * | * | - | |
| YU LN ,et al[19] | * | * | - | * | - | |
| Author | Assessment of outcome | Total quality score | ||||
| Assessment of outcome with independency | Adequacy of follow up length (to assess outcome) | Lost to follow up acceptable (less than 10% and reported) | ||||
| Panagiotis B,et al[10] | * | - | - | 5 | ||
| Shir-Hwa U,et al[11] | * | * | - | 7 | ||
| Jungsuk A,et al[15] | * | * | - | 7 | ||
| Shikha B,et al[16] | * | * | - | 6 | ||
| MA BL,et al[17] | * | * | - | 7 | ||
| LIU YX,et al [18] | * | - | - | 5 | ||
| YU LN ,et al[19] | * | * | - | 5 | ||
| “-”:No data. | ||||||
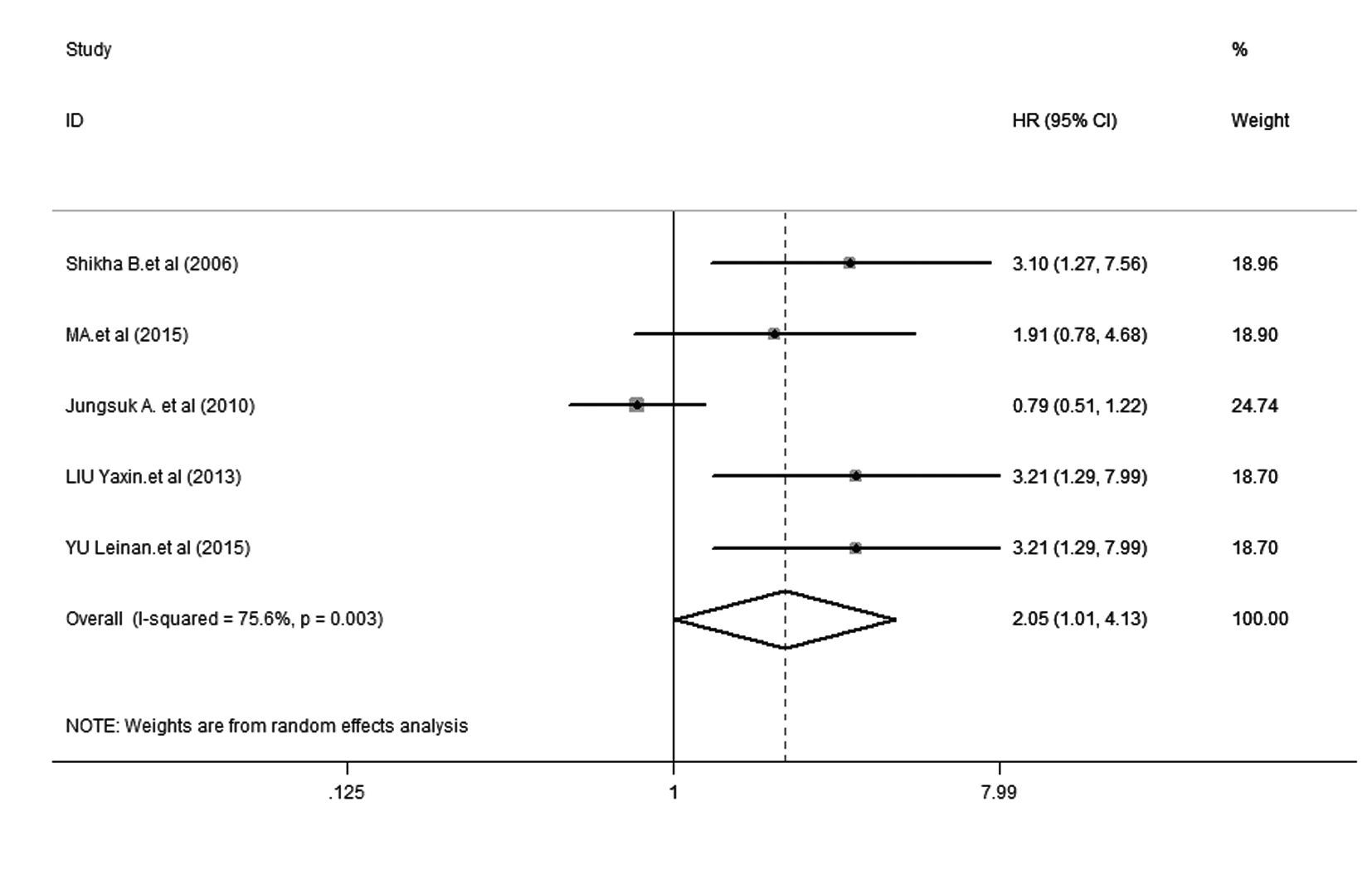
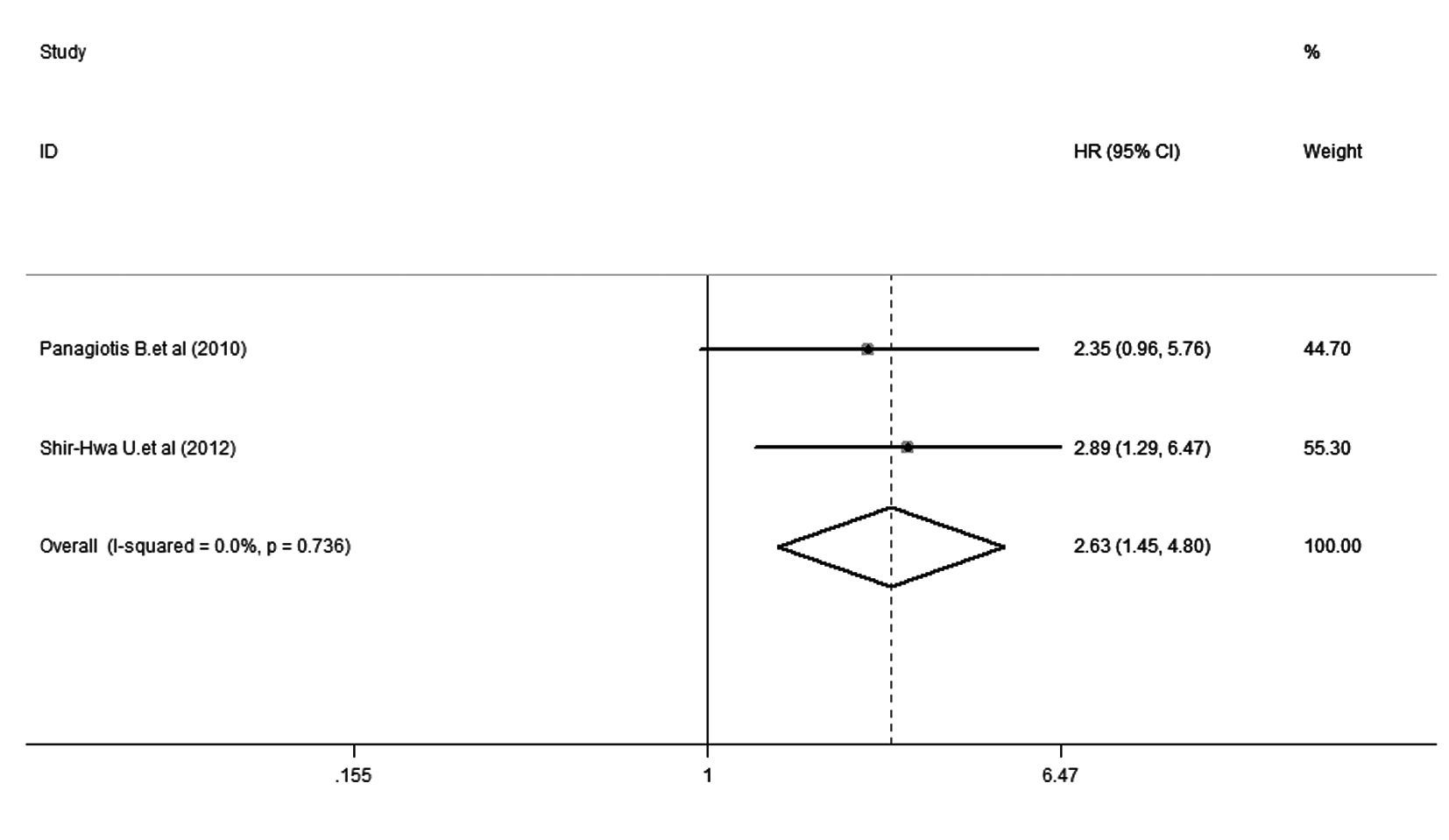
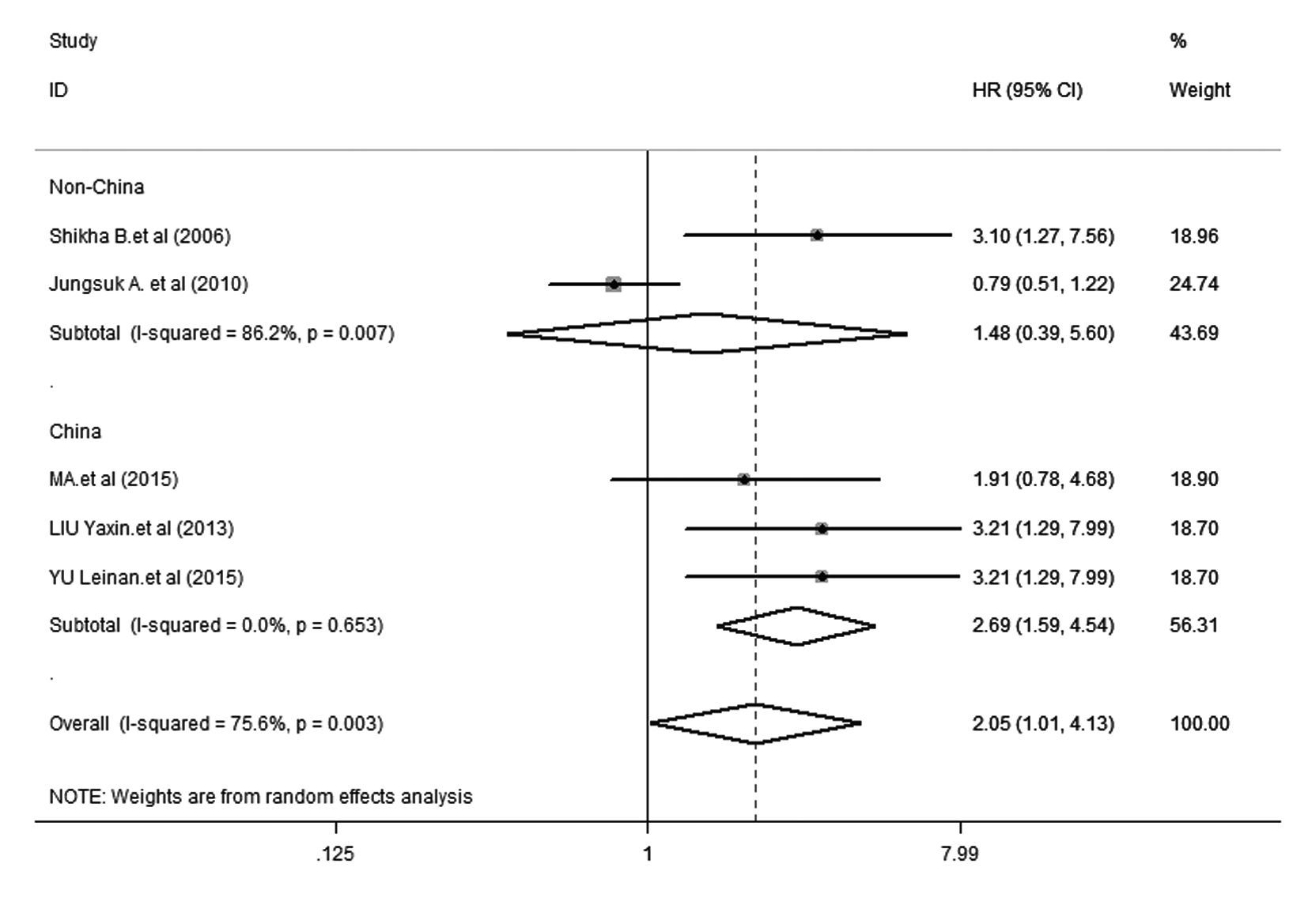
① DFS:5项研究[15, 16, 17, 18, 19]报道了DFS,各研究间存在明显异质性(P=0.003,I2= 75.6%),因此采用随机效应模型进行分析。森林图(图1)显示:HR = 2.05,95% CI:1.01~4.13,提示mTOR阳性表达乳腺癌患者发生肿瘤复发转移的风险是mTOR阴性表达乳腺癌患者的2.05倍。② OS:3项研究报道了OS[10, 11],各研究间无明显异质性(P = 0.195,I2 = 38.9%),因此采用固定效应模型进行分析。森林图(图2)显示:HR = 2.64,95% CI:1.45~4.79,提示mTOR阳性表达乳腺癌患者发生肿瘤死亡的风险是mTOR阴性表达者的2.64倍。③亚组分析:亚组分析在DFS[15, 16, 17, 18, 19]中进行,其结果见图3。以中国、非中国为地理因素进行亚组分析,中国亚组中,I2=0.0%,P= 0.653,HR = 2.690,95% CI: 1.594~4.539,表明mTOR的阳性表达与乳腺癌患者预后的相关性在中国人群中有很好的代表性;非中国亚组中,I2= 86.2%,P = 0.007,HR = 1.030,95% CI:0.697~1.521,提示DFS的异质性主要来源于该亚组。④ 敏感性分析:对DFS[15, 16, 17, 18, 19]进行敏感性分析 ,剔除5篇文献中的任何一篇,结果与未剔除前的结果无 明显差别,表明该研究稳定性好,分析结果的可靠性大。
|
| 图1 mTOR阳性表达乳腺癌患者DFS的森林图 Fig.1 Forest plot of DFS in breast cancer patients with positive expression of mTOR |
|
| 图2 mTOR阳性表达乳腺癌患者OS的森林图 Fig.2 Forest plot of OS in breast cancer patients with positive expression of mTOR |
|
| 图3 mTOR阳性表达乳腺癌患者地域亚组(非中国和中国)的森林图 Fig.3 Forest plot of region (non-China and China) in breast cancer patients with positive expression of mTOR |
本研究对纳入的7篇文献进行Meta分析,mTOR阳性表达乳腺癌患者发生复发转移和死亡的风险分别是mTOR阴性表达者的2.05和2.64倍,说明mTOR阳性表达明显增加了乳腺癌患者的复发转移及死亡风险。本研究依据地理区域对乳腺癌患者进行无病生存期的亚组分析,结果显示:mTOR阳性表达明显增加了中国人群乳腺癌患者复发的风险(HR = 2.69,95% CI:1.59~4.54)。
研究者[21]认为:在早期非小细胞肺癌中,mTOR阳性表达的乳腺癌患者5年生存率低于mTOR表达阴性的乳腺癌患者。Leal等[22]发现:mTOR阳性表达的乳腺癌患者较mTOR阴性表达乳腺癌患者预后更差。关于胃癌的一项研究[23]表明:mTOR阳性表达的胃癌患者较mTOR阴性表达的患者预后明显不佳。mTOR信号转导通路在肝细胞癌的发生发展过程中也起重要作用[24]。以上研究表明:mTOR阳性表达能明显影响肿瘤患者的生存预后。
此外,mTOR抑制剂如雷帕霉素、依维莫司[25]和西罗莫司等已经应用于乳腺癌的临床试验中。2项BOLERO-2试验[26, 27]显示:依维莫司联合依西美坦(对比安慰剂联合依西美坦)能够明显延长绝经后激素受体阳性、非甾体类芳香化酶抑制剂治疗后出现复发或进展的乳腺癌患者的中位无进展生存期。研究[28, 29]显示:依维莫司联合曲妥珠单抗和长春瑞滨(对比安慰剂联合曲妥珠单抗和长春瑞滨)能够明显延长曲妥珠单抗耐药、HER-2阳性并且曾接受过紫杉醇治疗后的乳腺癌患者的中位无进展生存期。总之,mTOR抑制剂可以改善乳腺癌患者的生存预后。
本次Meta分析有下列优势:亚组分析结果表明mTOR阳性表达明显增加了中国人群乳腺癌患者复发的风险,为mTOR抑制剂依维莫司应用于中国乳腺癌人群提供了循证医学证据;DFS的敏感性分析显示,剔除5篇文献中的任何一篇,结果没有明显的改变,说明该Meta分析的结果可靠;最后纳入的7篇文献NOS评分较高,共计1758个病例,病例来源地多样,代表性较好,而且其纳入、筛除标准执行严格,所以本研究分析结果尚稳定可靠。
同时,本研究也存在一定的缺陷:本研究纳入的文献数量较少;部分纳入的原始文献中未给出直接可利用的数据,从Kaplan-Meier 曲线中提取的数据难免会有一定误差;限于原始文献没有完整提供关于组织类型、分期、年龄和化疗方案等方面的数据,故未能进行全面的亚组分析。
综上所述,mTOR阳性表达明显增加了乳腺癌患者复发转移及死亡的风险。本研究结果为依维莫司等mTOR抑制剂应用于乳腺癌的靶向治疗提供了理论依据。
| [1] | Parkin DM, Pisani P, Ferlay J, et al. Global cancer statistics[J]. CA Cancer J Clin, 1999, 49(1): 33-64. |
| [2] | Sadeghi S, Olevsky O, Hurvitz SA. Profiling and targeting HER2-positive breast cancer using trastuzumab emtansine[J]. Pharmgenomics Pers Med, 2014, 7: 329-338. |
| [3] | Vogel CL, Cobleigh MA, Tripathy D, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer[J]. J Clin Oncol, 2002, 20(3): 719-726. |
| [4] | Shimobayashi M, Hall MN. Making new contacts: the mTOR network in metabolism and signalling crosstalk[J]. Nat Rev Mol Cell Biol, 2014, 15(3): 155-162. |
| [5] | Bambury RM, Rosenberg JE. Actionable mutations in muscle-invasive bladder cancer[J]. Curr Opin Urol, 2013, 23(5): 472-478. |
| [6] | Ng VC, Johnson JJ, Cuellar S. Targeting the mammalian target of rapamycin pathway with everolimus: implications for the management of metastatic breast cancer[J]. J Oncol Pharm Pract, 2015, 21(6): 433-442. |
| [7] | Loong HH, Yeo W. Microtubule-targeting agents in oncology and therapeutic potential in hepatocellular carcinoma[J]. Onco Targets Ther, 2014, 7: 575-585. |
| [8] | Rolfo C, Giovannetti E, Hong DS, et al. Novel therapeutic strategies for patients with NSCLC that do not respond to treatment with EGFR inhibitors[J]. Cancer Treat Rev, 2014, 40(8): 990-1004. |
| [9] | Lauring J, Park BH, Wolff AC. The phosphoinositide-3-kinase-Akt-mTOR pathway as a therapeutic target in breast cancer[J]. J Natl Compr Canc Netw, 2013, 11(6): 670-678. |
| [10] | Bakarakos P, Theohari I, Nomikos A, et al. Immunohistochemical study of PTEN and phosphorylated mTOR proteins in familial and sporadic invasive breast carcinomas[J]. Histopathology, 2010, 56(7): 876-882. |
| [11] | Ueng SH, Chen SC, Chang YS, et al. Phosphorylated mTOR expression correlates with poor outcome in early-stage triple negative breast carcinomas[J]. Int J Clin Exp Pathol, 2012, 5(8): 806-813. |
| [12] | Parmar MKB, Torri V, Stewart L. Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints[J]. Statist Med, 1998, 17(24): 2815-2834. |
| [13] | Mei XD, Su H, Song J, et al. Prognostic significance of β-catenin expression in patients with non-small cell lung cancer: a Meta-analysis[J]. Biosci Trends, 2013, 7(1): 42-49. |
| [14] | Qiu ZX, Zhang K, Qiu XS, et al. The prognostic value of phosphorylated AKT expression in non-small cell lung cancer: a meta-analysis[J]. PLoS One, 2013, 8(12): e81451. |
| [15] | An J, Jeong H, Lee Y, et al. Phosphorylated Akt and phosphorylated mTOR expression in breast invasive carcinomas: Analysis of 530 cases[J]. Breast Cancer, 2010, 13(4): 337. |
| [16] | Bose S, Chandran S, Mirocha JM, et al. The Akt pathway in human breast cancer: A tissue-array-based analysis[J]. Mod Pathol, 2006, 19(2): 238-245. |
| [17] | Ma BL, Shan MH, Sun G, et al. Immunohistochemical analysis of phosphorylated mammalian target of rapamycin and its downstream signaling components in invasive breast cancer[J]. Mol Med Rep, 2015, 12(4): 5246-5254. |
| [18] | 刘雅昕, 李惠平, 赵红梅, 等. mTOR表达与雌激素受体阳性乳腺癌辅助内分泌治疗预后的关系[J]. 癌症进展, 2013,11 (3): 254-258,269. |
| [19] | 虞蕾楠, 姚广裕, 胡晓磊, 等. 雌激素受体阳性乳腺癌中mTOR蛋白的表达及与内分泌辅助治疗预后的关系[J]. 现代生物医学进展, 2015, 15(8): 1418-1420. |
| [20] | Cota GF, de Sousa MR, Fereguetti TO, et al. Efficacy of anti-leishmania therapy in visceral leishmaniasis among HIV infected patients: a systematic review with indirect comparison[J]. PLoS Negl Trop Dis, 2013, 7(5): e2195. |
| [21] | Cai W, Shi Y, Zhao Q. Relationship between expression of mTOR and prognosis of early stage non-small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(2): 120-122. |
| [22] | Leal P, Garcia P, Sandoval A, et al. Immunohistochemical expression of phospho-mTOR is associated with poor prognosis in patients with gallbladder adenocarcinoma[J]. Arch Pathol Lab Med, 2013, 137(4): 552-557. |
| [23] | Xiao L, Wang YC, Li WS, et al. The role of mTOR and phospho-p70S6K in pathogenesis and progression of gastric carcinomas: an immunohistochemical study on tissue microarray[J]. J Exp Clin Cancer Res, 2009, 28: 152. |
| [24] | 俞 媛,陈晓蓉.PI3K/Akt/mTOR信号转导道路在肝细胞癌发生发展中的作用[J].临床肝胆病杂志,2014,30(9):954-957. |
| [25] | 叶 荆, 王 蓓, 陈建彬, 等. PI3K/Akt/mTOR通路抑制剂依维莫司治疗晚期乳腺癌的研究进展[J]. 肿瘤, 2015,35 (2): 221-224. |
| [26] | Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer[J]. N Engl J Med, 2012, 366(6): 520-529. |
| [27] | Ito Y, Masuda N, Iwata H, et al. Everolimus plus exemestane in postmenopausal patients with estrogen-receptor-positive advanced breast cancer - Japanese subgroup analysis of BOLERO -2 [J]. Gan To Kagaku Ryoho, 2015, 42(1): 67-75. |
| [28] | André F, O'Regan R, Ozguroglu M, et al. Everolimus for women with trastuzumab-resistant, HER2-positive, advanced breast cancer (BOLERO-3): a randomised, double-blind, placebo-controlled phase 3 trial[J]. Lancet Oncol, 2014,15(6): 580-591. |
| [29] | 张 莹,李春艳,崔泽实,等.TSG101与HIF-1α在乳腺癌组织中的表达及意义[J]. 中国实用内科杂志,2014,34(增1):96-98. |
 2016, Vol. 42
2016, Vol. 42


