扩展功能
文章信息
- 祖冬妮, 赵明沂, 杜巍, 赵惟超, 贾书冰, 杨静玉, 项荣武
- ZU Dongni, ZHAO Mingyi, DU Wei, ZHAO Weichao, JIA Shubing, YANG Jingyu, XIANG Rongwu
- 吉林大学学报(医学版), 2016, 42(04): 768-776
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 768-776
- 10.13481/j.1671-587x.20160426
-
文章历史
- 收稿日期: 2015-10-22
急性失代偿性心力衰竭(acute decompensated heart failure,ADHF)作为最常见的心血管系统疾病危重症之一,越来越成为临床关注的焦点。在美国,每年有超过100万的患者因ADHF住院[1]。ADHF通常是在原有慢性心力衰竭(chronic heart failure,CHF)基础上,心功能短时间内急剧恶化失代偿所致[2]。作为心脏分泌的神经激素,脑利钠肽(brain natriuretic peptide,BNP)不仅可以预测心力衰竭的严重程度,在体液平衡、调节血压与心血管功能等方面均具有重要意义。重组人脑利钠肽(recombinant human brain natriuretic peptide,rhBNP)通过模拟人体内源性BNP,扩张血管降低心脏前后负荷、利尿排钠、抑制肾素-血管紧张素-醛固酮系统和内皮素的分泌[3]。但是,在各项临床研究和实际使用过程中,其安全性却备受争议。Sackner-Bemstem等[4]和Abraham等[5]认为:rhBNP能增加ADHF患者的短期死亡风险。Colucci等[6]的对比研究显示:与安慰剂组比较,rhBNP可增加ADHF患者的短期死亡率,其症状性低血压发生率与对照组比较差异无统计学意义。O’ Connor等[7]研究显示:与安慰剂组比较,rhBNP组短期死亡率比较差异无统计学意义,其症状性低血压发生风险明显升高。本研究采用Meta分析的方法,纳入符合标准的随机对照试验(RCT),对rhBNP治疗ADHF的安全性进行统计分析,以期获得更系统和客观的综合评价。
1 资料与方法 1.1 纳入标准①研究类型:文献资料为前瞻性的RCT,无论是否采用分配隐藏或盲法;试验组与对照组患者在年龄、性别、疾病分期等方面具有良好的匹配。②研究对象:ADHF患者。③干预措施:以rhBNP为干预手段,治疗组为rhBNP联合常规疗法,对照组为常规治疗基础上应用安慰剂或联合应用传统治疗性药物(包括硝酸酯类药物、硝普钠和多巴酚丁胺等)。④结局指标包含以下任意一项:1个月或1个月以内死亡率、3个月死亡率、6个月死亡率、不良反应发生率和低血压发生率。
1.2 检索策略通过计算机检索PubMed、The Cochrane Library(2015年第1期)、EMBase、中国知网、维普数据库和万方数据库,检索时间段为建库至2015年8月,并手工追溯所有纳入文献的参考文献。英文检索策略为: Nesiritide 和 decompensated heart failure(DHF),同时进行MeSH词和自由词检索。中文检索策略为:脑利钠肽或奈西立肽或新活素和失代偿性心力衰竭。
1.3 资料提取和质量评价由2名评价员独立进行资料提取和纳入文献质量评价,如有分歧,则经2人或第三方讨论解决。资料提取基本情况包括研究基本特征、干预措施、给药方案、样本量和纳入患者基本特征等,数据提取采用意向性分析的方法,中途退出试验的患者均被假设为发生死亡、再住院等不良事件。纳入研究的方法学质量评价采用改良的Jadad评分量表[8]。内容包括:随机序列的产生、随机化隐藏、是否实施盲法以及撤出或退出情况的描述。评分1~3分视为低质量,评分4~7分视为高质量。
1.4 统计学分析采用RevMan 5.1和Stata12.0软件进行统计学分析。相对危险度(RR)及其95%CI作为效应量。采用χ2检验对纳入研究进行异质性检验,P≤0.1时各研究间存在异质性,P>0.1时各研究间不存在统计学异质性。采用I2对异质性进行定量分析,当I2=0时,研究间的变异仅由抽样误差引起;当I2<25%时,存在轻度异质性;当 25%≤I2<50%时,存在中度异质性;当I2≥50%时,存在高度异质性[9]。如各研究结果间不存在统计学异质性,采用固定效应模型进行Meta分析[10];反之,各研究结果间存在异质性(P<0.1),在分析其来源并仍无法排除后,则采用随机效应模型。若异质性过大或来源不明,则行描述性分析[11]。采用漏斗图及Egger法检验发表偏倚, P>0.05则提示存在发表偏倚,反之则不存在发表偏倚。必要时对纳入研究行敏感性分析。
2 结 果 2.1 文献检索结果初检获得相关文献1 071篇,经过逐层筛选,最终纳入35个RCT,共计12 143例患者,其中试验组(rhBNP组)6 494例,对照组5 649例。rhBNP组与对照组患者性别、年龄和疾病分期等方面比较差异无统计学意义(P>0.05),具有可比性。纳入研究的基本特征及质量评价见表1。
| Study | Year | Patient (nesiritide/ rhBNP) | Intervention (dose) (μg·kg-1·min-1) | Control | Follow-up (t/d) | Age (rhBNP/Control) | Male(η/%) (rhBNP/ Control) | Qualiy score |
| MillRM, et al[12] | 1999 | 103(74/29) | 0.015-0.06 | A | 30 | 57±13/54±8 | 84/72 | 7 |
| ColucciWS, et al[6] | 2000 | 305(203/102) | 0.015-0.03 | A | 21 | 64±13/63±14 | 66/72 | 6 |
| BurgerAJ, et al[13] | 2001 | 261(203/58) | 0.015-0.03 | B | 21 | 64±13/65±14 | 66/76 | 4 |
| BurgerAJ, et al[14] | 2002 | 255(169/86) | 0.015-0.03 | B | 14 | 60±13/62±14 | 69/63 | 2 |
| VMACJB, et al[15] | 2002 | 489(273/216) | 0.01 | C | 180 | 62±13/60±14 | 73/60 | 6 |
| SilverMA, et al[16] | 2002 | 261(203/58) | 0.015-0.03 | B | 180 | 64±13/64±14 | 66/76 | 2 |
| YancyCW, et al[17] | 2004 | 210(141/69) | 0.005-0.01 | A | 112 | 67±13/67±12 | 67/74 | 2 |
| PeacockWF, et al[18] | 2005 | 250(127/123) | 0.01 | A | 30 | 66±16/65±15 | 52/60 | 6 |
| WittelesRM, et al[19] | 2007 | 75(39/36) | 0.01 | A | 30 | 74.9/75.5 | 67/61 | 7 |
| MillerAH, et al[20] | 2008 | 101(53/48) | 0.01 | A | 30 | 55.8±12.2/55.6±14.2 | 66/66 | 7 |
| YancyCW, et al[21] | 2008 | 911(605/306) | 0.01 | A | 168 | 64.9±12.9/65±12.8 | 70.4/72.2 | 6 |
| ZhaoQ, et al[22] | 2010 | 60(30/30) | 0.0075 | C | 90 | 67±8 | 51.9/50.0 | 3 |
| ChowSL, et al[23] | 2011 | 89(45/44) | 0.01 | C | 90 | NA | NA | 2 |
| StarlingRC, et al[24] | 2011 | 7007(3 498/3 509) | 0.01 | A | 180 | 67/67 | 66.6/65.1 | 5 |
| O’ConnorC, et al[7] | 2011 | 7007(3496/3511) | 0.01 | A | 30 | 68.6±14.1/66.8±17.2 | 56/52 | 5 |
| ChenHH, et al[25] | 2013 | 360(119/241) | 0.005 | A/D | 180 | 70 | 73 | 6 |
| PanHY, et al[26] | 2014 | 105(52/53) | 0.007 5-0.01 | B | NA | 65.9±12.5/65.2±13.5 | 66.7/64.2 | 3 |
| WangR, et al[27] | 2014 | 67(37/30) | 0.007 5 | A | 30 | 63.77±10.94/67.78±7.64 | 53.3/45.9 | 1 |
| CaoYM, et al[28] | 2013 | 48(24/24) | 0.007 5-0.015 | A | NA | 62±11/61±9 | 67/79 | 2 |
| QinXY, et al[29] | 2010 | 60(30/30) | 0.007 5 | C | 180 | 80.07±6.77/79.53±4.70 | 56.7/66.7 | 2 |
| ZhangW, et al[30] | 2015 | 88(44/44) | 0.007 5-0.01 | B | 30 | 59.3±3.1 | 55.68 | 2 |
| YuanF, et al[31] | 2007 | 40(20/20) | 0.007 5 | C | NA | 59.10±10.38/57.75±11.42 | 60/65 | 1 |
| Xie HZ, et al[32] | 2006 | 209(105/104) | 0.007 5 | C | 10-20 | 60.7/63.8 | 73/76 | 3 |
| BoXQ, et al[33] | 2012 | 63(32/31) | 0.007 5-0.01 | B | 30 | 66.7±10.1/67.6±11.2 | 62.5/64.5 | 2 |
| MaLJ, et al[34] | 2011 | 64(32/32) | 0.01 | A | NA | 69.9±7.7 | 65.63 | 1 |
| NiuS, et al[35] | 2013 | 122(61/61) | 0.01 | A | 7 | 67.21±6.05 | 65.57 | 2 |
| CaoB, et al[36] | 2008 | 60(35/25) | 0.007 5 | C | 5 | 38-76 | 60/68 | 2 |
| WangRM, et al[37] | 2010 | 60(30/30) | 0.007 5 | A | 14 | 68±7/69±8 | 66.7/70.0 | 2 |
| LuoR, et al[38] | 2013 | 77(36/41) | 0.007 5-0.01 | C | NA | 57.3±5.6/56.0±4.3 | 63.8/56.1 | 1 |
| PiaoZH, et al[39] | 2007 | 42(21/21) | 0.007 5 | C | 7 | 61.2±10.3/62.6±9.8 | 61.9/47.6 | 2 |
| YuWH, et al[40] | 2009 | 28(15/13) | 0.007 5 | C | NA | 62.3±6.5 | 71.4 | 2 |
| Wu XY, et al[41] | 2011 | 82(42/40) | 0.01 | C | 5 | ≥65 | NA | 1 |
| WuXY, et al[42] | 2011 | 112(58/54) | 0.01 | A | NA | 63±12/61±10 | 65.5/61.1 | 2 |
| LiWA, et al[43] | 2010 | 39(20/19) | 0.007 5 | C | NA | 78.00±6.59 | 80.0/78.9 | 2 |
| YuanF, et al[44] | 2011 | 40(20/20) | 0.01 | A | 90 | 55±3/56±8 | 55/60 | 1 |
| NA:Not applicable; A:Placebo;B:Dobutamine;C:Nitrates/sodium nitroprusside;D:Dopamine. | ||||||||
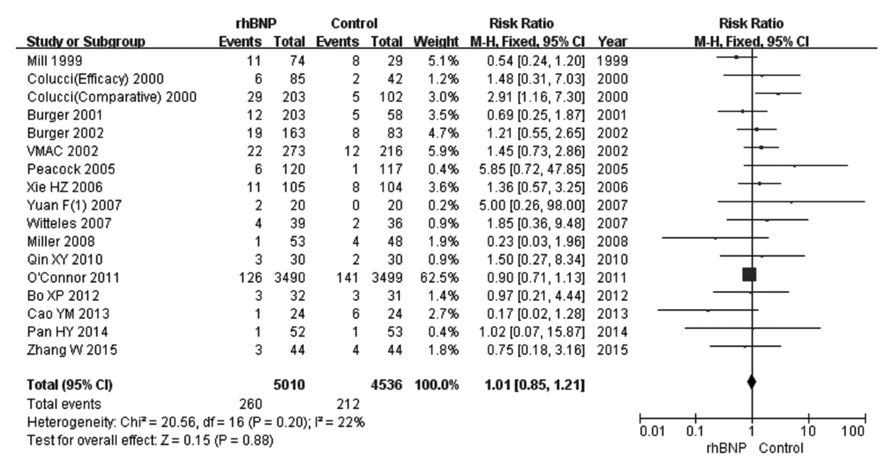
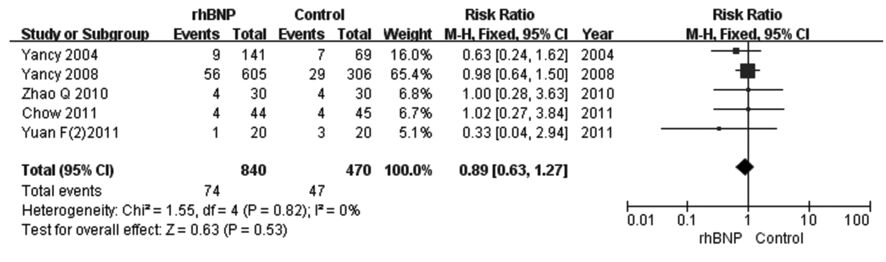
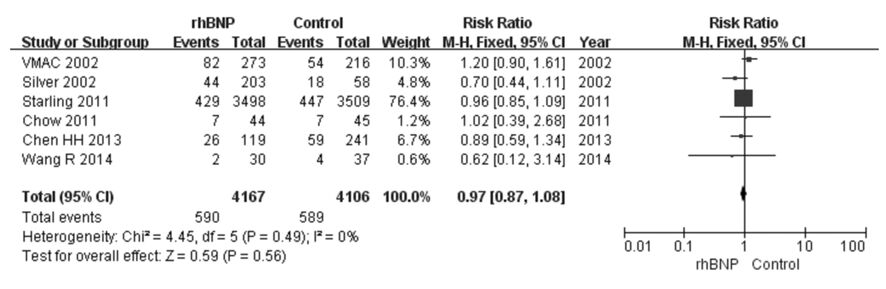
①1个月内死亡率:17个RCT[6, 7, 12, 13, 14, 15, 18, 19, 20, 26, 28, 29, 30, 31, 32, 33]比较了rhBNP和常规治疗或联合应用传统治疗性药物治疗ADHF1个月以内的死亡率,共9 546例患者,rhBNP组5 010例,对照组4 536例。在治疗ADHF过程中,rhBNP组患者1个月内死亡率与对照组比较差异无统计学意义(RR=1.01,95%CI:0.85~1.21,P=0.88)(图1)。②3个月死亡率:5个RCT[17, 21, 22, 23, 44]比较了rhBNP和常规治疗或联合应用传统治疗性药物治疗ADHF3个月的死亡率,共1 310例患者,rhBNP组840例,对照组470例。在治疗ADHF过程中,rhBNP组患者3个月死亡率与对照组比较差异无统计学意义(RR=0.89,95%CI:0.63~1.27,P=0.53)(图2)。③6个月死亡率:6个RCT[14, 16, 23, 24, 25, 27]比较了rhBNP和常规治疗或联合应用传统治疗性药物治疗ADHF患者6个月的死亡率,共8 273例患者,rhBNP组4 167例,对照组4 106例。在治疗ADHF过程中,rhBNP组患者6个月死亡率与对照组比较差异无统计学意义(RR=0.97,95%CI:0.87~1.08,P=0.59)(图3)。
|
| 图1 rhBNP治疗ADHF患者 1个月内死亡率的Meta分析 Fig.1 Meta-analysis on 1-month mortality of ADHF patients after treated with rhBNP |
|
| 图2 rhBNP治疗ADHF患者3个月死亡率的Meta分析 Fig.2 Meta-analysis on 3-month mortality of ADHF patients after treated with rhBNP |
|
| 图3 rhBNP治疗ADHF患者6个月死亡率的Meta分析 Fig.3 Meta-analysis on 6-month mortality of ADHF patients after treated with rhBNP |
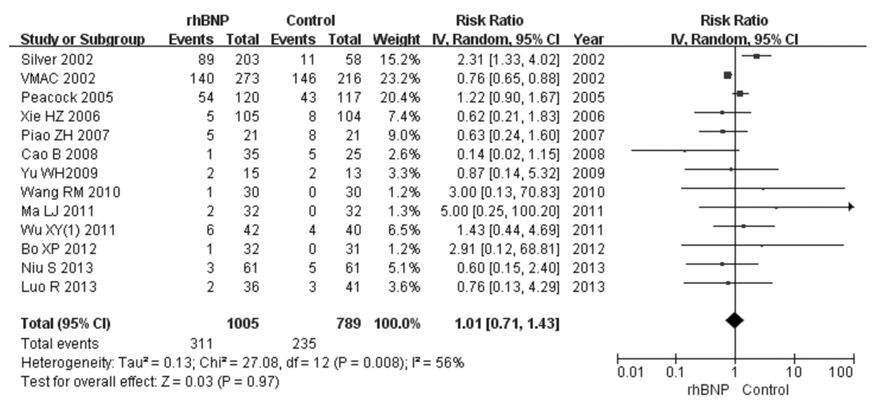
13个RCT[15, 16, 18, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41]比较了rhBNP和常规治疗或联合应用传统治疗性药物治疗ADHF的不良反应发生率,共1 794例患者,rhBNP组1 005例,对照组789例。经检验,各研究结果间存在统计学异质性(P=0.008,I2=56%),推测异质性主要与各研究基线存在差异有关,但纳入研究均符合本研究纳排标准,故采用随机效应模型进行Meta分析,结果显示:在治疗ADHF过程中,rhBNP组患者不良反应发生率与对照组比较差异无统计学意义(RR=1.01,95%CI:0.71~1.43,P=0.97)。见图4。
|
| 图4 rhBNP治疗ADHF患者不良反应发生率的Meta分析 Fig.4 Meta-analysis on incidence of side effects of ADHF patients after treated with rhBNP |
在rhBNP治疗ADHF不良反应发生率的研究中,分别针对rhBNP组rhBNP给药维持速度(分为0.015~0.03μg·kg-1·min-1和0.007 5~0.01μg·kg-1·min-12组)、对照组药物、纳入研究国籍(以国内和国外区分)、样本量(以100例为分界点)等因素行亚组分析。在所有影响不良反应发生率的因素中,只有rhBNP给药维持速度和对照组药物组间比较差异有统计学意义(rhBNP维持剂量P=0.002,对照组药物P<0.001),即rhBNP给药维持速度和对照组药物分别是此项分析异质性的影响因素之一。见表2。
| Subgroup | Number | RR(95%CI) | I2(η/%) | P |
| rhBNP(dose) | ||||
| 0.015-0.030μg·kg-1·min-1 0.0075-0.0100μg·kg-1·min-1 | 1 12 | 2.31(1.33-4.02) 0.88(0.67-1.15) | Not applicable 24 | 0.002 |
| Control group | ||||
| A | 4 | 1.21(0.90-1.63) | 0 | |
| B | 2 | 2.33(1.35-4.02) | 0 | <0.001 |
| C | 7 | 0.75(0.65-0.87) | 0 | |
| Nation | ||||
| Internal External | 10 3 | 0.77(0.48-1.24) 1.22(0.70-2.13) | 0 90 | 0.22 |
| Sample | ||||
| ≥100 | 5 | 1.06(0.67-1.68) | 81 | |
| <100 | 8 | 0.86(0.48-1.52) | 0 | 0.58 |
| Total | 13 | 1.01(0.71-1.43) | 56 | |
| A:Placebo;B:Dobutamine;C:Nitrates/sodium nitroprusside;D:Dopamine. | ||||
10个RCT[7, 12, 15, 16, 19, 22, 23, 39, 42, 43]比较了rhBNP与常规治疗或联合应用传统治疗性药物治疗ADHF低血压发生率,共8 277例患者,rhBNP组4 261例,对照组4 016例。经检验,各研究结果间存在中度统计学异质性(P=0.05,I2=46%),推测异质性主要与各研究基线存在差异有关,但纳入研究均符合本研究纳排标准,故采用随机效应模型进行Meta分析,结果显示:在治疗ADHF过程中,rhBNP组增加了42%的低血压发生风险(RR=1.42,95%CI:0.99~2.03,P=0.06)。见图5。
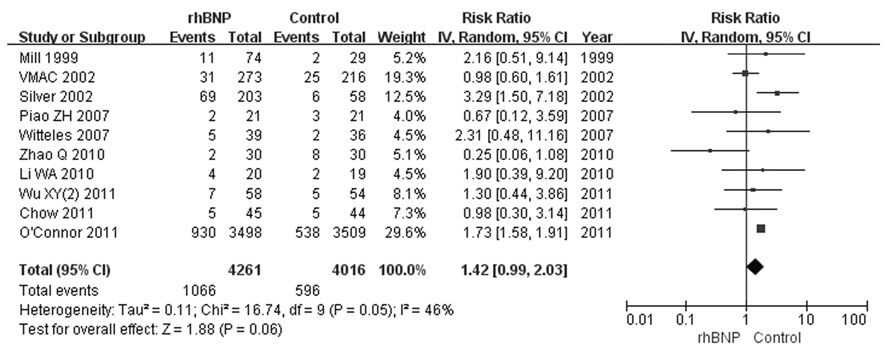
|
| 图5 rhBNP治疗ADHF患者低血压发生率的Meta分析 Fig.5 Meta-analysis on incidence of hypotension of ADHF patients after treated with rhBNP |
对低血压发生率研究中的4个因素(rhBNP组rhBNP给药维持速度、对照组药物、纳入研究国籍和样本量)进行亚组分析。在所有影响低血压发生率的因素中,rhBNP给药维持速度与对照组药物组间比较差异有统计学意义(rhBNP维持剂量P=0.03,对照组药物P=0.002),表明rhBNP给药维持速度和对照组药物均可能是异质性的来源。见表3。
| Subgroup | Number | RR(95%CI) | I2(η/%) | P |
| rhBNP(dose) | ||||
| 0.015-0.030μg·kg-1·min-1 0.0075-0.0100μg·kg-1·min-1 | 8 2 | 2.99(1.50-5.94) 1.20(0.79-1.82) | 0 49 | 0.03 |
| Control group | ||||
| A | 3 | 1.74(1.58-1.91) | 0 | |
| B | 1 | 3.29(1.50-7.18) | Not applicable | 0.002 |
| C | 6 | 0.94(0.64-1.38) | 0 | |
| Nation | ||||
| Internal External | 4 6 | 0.84(0.35-1.97) 1.62(1.14-2.30) | 31 43 | 0.16 |
| Sample | ||||
| ≥100 | 5 | 1.63(1.13-2.36) | 50 | |
| <100 | 5 | 0.92(0.43-1.96) | 46 | 0.18 |
| Total | 10 | 1.42(0.99-2.03) | 46 | |
| A:Placebo;B:Dobutamine;C:Nitrates/sodium nitroprusside;D:Dopamine. | ||||
对上述研究绘制漏斗图行发表偏倚分析,以效应量logRR为横坐标,se(logRR)为纵坐标。漏斗图均基本对称,但个别研究处于漏斗图外侧。针对以上研究进行Egger检验,1个月内死亡率、不良反应发生率和低血压发生率均无发表偏倚(P值分别为0.417、0.422和0.277)。见图6。
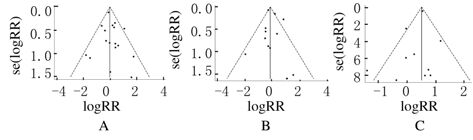
|
| 图6 rhBNP治疗ADHF 患者1个月内死亡率(A)、不良反应发生率(B)和低血压发生率(C)发表偏倚分析 Fig.6 Analysis on publication bias of 1-month mortality(A),incidence of side effects(B),and incidence of hypotension(C) of ADHF patients after treated with rhBNP |
采取将纳入研究逐一剔除后合并分析的方法对上述结果行敏感性分析,结果均稳健可靠。
3 讨 论目前,ADHF的主要治疗药物包括正性肌力药物、利尿剂和血管扩张剂等,虽然上述药物可改变患者的血流动力学,缓解呼吸困难、乏力等临床症状,但并不能抑制ADHF时过度激活的神经内分泌作用,且可能会进一步激活神经内分泌系统[43]。rhBNP因其化学结构及生物学作用与心室肌内源性BNP相同,可迅速、有效地改善ADHF患者的血流动力学,且并不激活甚至降低作用于心脏的神经内分泌毒性作用[44]。基于上述机制,rhBNP理论上可降低患者的死亡率和再住院率等[44],但在应用过程中,其安全性却受到了一定的质疑,因此寻找有效手段评判该药的安全性十分必要。
本研究结果显示:在治疗ADHF过程中,rhBNP组患者与常规治疗或联合传统药物比较,其死亡率、不良反应发生率差异均无统计学意义,但低血压发生风险明显升高。针对不良反应及低血压发生率行亚组分析发现:rhBNP给药维持速度和对照组药物的选择对结果均有一定的影响,rhBNP治疗ADHF过程中低血压的发生呈剂量依赖性,即剂量越高,低血压发生风险相应增高。
综上所述,本研究结果具有一定的临床指导意义。在部分地区,心衰患者每周都会接受rhBNP的治疗,导致治疗费用增加,但是rhBNP虽可以改善患者呼吸困难、乏力等临床症状,但并不能降低患者的死亡率,使用过程中,应明确患者病情,用于ADHF患者而非所有心衰患者。因rhBNP引起的低血压具有剂量依赖性,在临床应用过程中,临床医师应充分评估患者病情,结合患者血压状况,给予合适的剂量及滴注速度,以避免低血压的发生。虽然rhBNP会产生部分不良反应,但其大部分不良反应通过减量或停药能在短时间内减轻或消失,因而对患者密切关注是规避rhBNP不良反应、充分利用其治疗优势的有效措施。
本系统评价还存在以下缺陷:①纳入患者有部分心功能分级为NYHAⅠ级,可能会影响研究结果。②部分纳入文献并未具体描述随机化方法,同时对于盲法、分配隐藏等均未提及,可能导致选择性偏倚。③本研究主要纳入已发表文献,可能存在未能纳入的灰色文献。④各研究治疗和随访时间均有所差异,对研究结果可能会造成一定的影响。因此,有必要对rhBNP治疗ADHF的安全性进行进一步研究。
| [1] | Berry J,Borden W,Bravata D, et al. heart disease and stroke statistics-2012 Update[J].Circulation,2012,125:e2-e220. |
| [2] | 急性心力衰竭诊断和治疗指南专家组. 急性心力衰竭诊断和治疗指南[J]. 中国心血管病研究杂志,2011,9(2):81-97. |
| [3] | 张善春,刘兆昶. 重组人脑利钠肽治疗心力衰竭 [J]. 中国心血管杂志,2006,11(6):477-478,封三. |
| [4] | Sackner-Bernstein JD,Kowalski M,Fox M, et al. Short-term risk of death after treatment with nesiritide for decompensated heart failure: a pooled analysis of randomized controlled trials[J]. JAMA,2005,293(15):1900-1905. |
| [5] | Abraham WT,Trupp RJ,Jarjoura D. Nesiritide in acute decompensated heart failure:a pooled analysis of randomized controlled clinical trials[J]. Clin Cardiol, 2010,33(8):484-489. |
| [6] | Colucci WS,Elkayam U,Horton DP, et al. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated congestive heart failure.Nesiritide Study Group[J]. N Engl J Med,2000,343(4):246-253. |
| [7] | O'Connor CM,Starling RC,Hernandez AF, et al. Effect of nesiritide in patients with acute decompensated heart failure[J]. N Engl J Med,2011,365(1):32-43. |
| [8] | Jadad AR,Moore RA,Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J]. Control Clin Trials,1996,17(1):1-12. |
| [9] | Higgins JP,Thompson SG,Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ,2003,327(7414):557. |
| [10] | Mantel N,Haenszel W. Statistical aspects of the analysis of data from retrospective studies[J]. J Natl Cancer Inst,1959,22(4):719-748. |
| [11] | Dersimonian R,Laird N. Meta-analysis in clinical trials[J]. Control Clin Trials,1986,7(3):177-188. |
| [12] | Mills RM,Lejemtel TH,Horton DP, et al. Sustained hemodynamic effects of an infusion of nesiritide (human b-type natriuretic peptide) in heart failure: a randomized, double-blind, placebo-controlled clinical trial.Natrecor Study Group[J]. J Am Coll Cardiol,1999,34(1):155-162. |
| [13] | Burger AJ,Elkayam U,Neibaur MT, et al. Comparison of the occurrence of ventricular arrhythmias in patients with acutely decompensated congestive heart failure receiving dobutamine versus nesiritide therapy[J]. Am J Cardiol,2001,88(1):35-39. |
| [14] | Burger AJ,Horton DP,Lejemtel T, et al. Effect of nesiritide (B-type natriuretic peptide) and dobutamine on ventricular arrhythmias in the treatment of patients with acutely decompensated congestive heart failure: the PRECEDENT study[J]. Am Heart J,2002,144(6):1102-1108. |
| [15] | Young JB,Abraham W,Stevenson L, et al. Intravenous nesiritide vs nitroglycerin for treatment of decompensated congestive heart failure:a randomized controlled trial[J]. JAMA,2002,287(12):1531-1540. |
| [16] | Silver MA,Horton DP,Ghali JK, et al. Effect of nesiritide versus dobutamine on short-term outcomes in the treatment of patients with acutely decompensated heart failure[J]. J Am Coll Cardiol,2002,39(5):798-803. |
| [17] | Yancy CW,Saltzberg MT,Berkowitz RL, et al. Safety and feasibility of using serial infusions of nesiritide for heart failure in an outpatient setting (from the FUSION I trial)[J]. Am J Cardiol,2004,94(5):595-601. |
| [18] | Peacock WF,Holland R,Gyarmathy R, et al. Observation unit treatment of heart failure with nesiritide: results from the proaction trial[J]. J Emerg Med,2005,29(3):243-252. |
| [19] | Witteles RM,Kao D,Christopherson D, et al. Impact of nesiritide on renal function in patients with acute decompensated heart failure and pre-existing renal dysfunction: a randomized, double-blind, placebo-controlled clinical trial[J]. J Am Coll Cardiol,2007,50(19):1835-1840. |
| [20] | Miller AH,Nazeer S,Pepe P, et al. Acutely decompensated heart failure in a county emergency department: a double-blind randomized controlled comparison of nesiritide versus placebo treatment[J]. Ann Emerg Med,2008,51(5):571-578. |
| [21] | Yancy CW,Krum H,Massie BM, et al. Safety and efficacy of outpatient nesiritide in patients with advanced heart failure results of the Second Follow-up Serial Infusions of Nesiritide (FUSION Ⅱ) trial[J]. Circ Heart Fail,2008,1(1):9-16. |
| [22] | Zhao Q,Wu TG,Lin Y, et al. Low-dose nesiritide improves renal function in heart failure patients following acute myocardial infarction[J]. Heart Vessels,2010,25(2):97-103. |
| [23] | Chow SL,O'Barr SA,Peng J, et al. Renal function and neurohormonal changes following intravenous infusions of nitroglycerin versus nesiritide in patients with acute decompensated heart failure[J]. J Card Fail,2011,17(3):181-187. |
| [24] | Starling RC,Hernandez AF,Armstrong PW, et al. Clinical outcomes at 180 days in the ASCEND-HF Trial: Double-blind, placebo-controlled, multicenter acute study of clinical effectiveness of nesiritide in subjects with decompensated heart failure[J]. J Card Fail,2011,17(11):971. |
| [25] | Chen HH,Anstrom KJ,Givertz MM, et al. Low-dose dopamine or low-dose nesiritide in acute heart failure with renal dysfunction: the ROSE acute heart failure randomized trial[J]. JAMA,2013,310(23):2533-2543. |
| [26] | Pan HY,Zhu JH,Gu Y, et al. Comparative effects of recombinant human brain natriuretic peptide and dobutamine on acute decompensated heart failure patients with different blood BNP levels[J]. BMC Cardiovasc Disord,2014,14:31. |
| [27] | 王 融,王学磊. 脑钠肽对急性失代偿性心力衰竭的影响[J]. 中国循证心血管医学杂志,2014,6(5):603-605. |
| [28] | 曹彦敏, 张洁芳,孙家安. 国产重组人脑利钠肽治疗急性失代偿性心力衰竭患者的疗效观察[J]. 中国医药指南,2013,11(22):492-493. |
| [29] | 秦晓云,金美玲,孙立民,等. 重组人脑利钠肽治疗急性失代偿性心力衰竭的疗效观察[J]. 实用心脑肺血管病杂志,2010,18(6):723-725. |
| [30] | 张 伟. 重组人脑利钠肽治疗急性心梗后失代偿性心力衰竭的临床分析[J]. 心血管病防治知识:学术版,2015(3):93-94. |
| [31] | 袁 方,潘 欣,倪幼方,等. 重组人脑利钠肽改善急性失代偿性心力衰竭患者早期心功能[J]. 上海交通大学学报:医学版,2007,27(7):853-855,858. |
| [32] | 谢洪智,朱文玲. 重组人脑利钠肽和硝酸甘油治疗急性失代偿性心力衰竭疗效和安全性的随机、开放、平行对照的多中心临床研究[J]. 中华心血管病杂志,2006,34(3):222-226. |
| [33] | 薄小萍,李明秋,陈茂华,等. 重组人脑利钠肽治疗急性心梗后失代偿性心力衰竭的疗效观察[J]. 东南大学学报:医学版,2012,31(1):93-96. |
| [34] | 马丽娟,高明宇,秦 弘,等. 新活素对急性失代偿性心力衰竭患者心功能、高敏C反应蛋白及QT间期离散度的影响[J]. 山东医药,2011,51(39):68-69. |
| [35] | 牛 圣. 新活素在急性失代偿性心力衰竭治疗中的应用效果[J]. 中国医疗前沿,2013(16):12-12. |
| [36] | 曹 斌,王 震. 新活素治疗急性失代偿性心力衰竭临床疗效观察[J]. 中国临床医生杂志,2008,36(11):37-38. |
| [37] | 王瑞敏,黄 琼,袁义强,等. 静脉注射基因重组人脑利钠肽治疗失代偿性心力衰竭疗效观察[J]. 中国实用医刊,2010,37(17):8-9,11. |
| [38] | 罗 仁,茶春喜. 重组人脑利钠肽治疗急性失代偿性心力衰竭的疗效分析[J]. 新疆医学,2013,43(2):49-52. |
| [39] | 朴哲浩. 重组人脑利钠肽治疗急性失代偿性心力衰竭疗效评价[D].延吉:延边大学,2007. |
| [40] | 于文汇. 重组人脑利钠肽治疗急性失代偿性心力衰竭临床研究[J]. 中国现代医生,2009,47(15):92-93. |
| [41] | 吴小滢,周玉杰,李艳芳,等. 重组人脑利钠肽治疗老年急性失代偿性心力衰竭患者的疗效及安全性观察[J]. 中国医刊,2011,46(7):36-38. |
| [42] | 吴小滢,周玉杰. 重组人脑利钠肽联合常规抗心力衰竭药物治疗急性失代偿性心力衰竭的临床观察[J]. 中国医药,2011,6(7):778-780. |
| [43] | 李文安. 重组人脑利钠肽和硝酸异山梨酯治疗急性失代偿性心力衰竭的有效性和安全性比较[D]. 长沙:中南大学,2010. |
| [44] | 袁 方,刘 华,张 敏,等. 重组人B型利钠肽静脉注射对急性失代偿性心力衰竭合并急性肾损伤患者心、肾功能的影响[J]. 上海医学,2011,34(12):938-941. |
 2016, Vol. 42
2016, Vol. 42


