扩展功能
文章信息
- 沈楠, 陈钱, 齐玲, 陈雪, 黄成然, 唐海如, 安英, 林峰, 王艳春
- SHEN Nan, CHEN Qian, QI Ling, CHEN Xue, HUANG Chengran, TANG Hairu, AN Ying, LIN Feng, WAN Yanchun
- 吉林大学学报(医学版), 2016, 42(04): 737-741
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 737-741
- 10.13481/j.1671-587x.20160420
-
文章历史
- 收稿日期: 2015-10-15
2. 吉林医药学院基础医学院病理学教研室, 吉林 吉林 132013
2. Department of Pathology, School of Basic Medical Sciences, Jilin Medical University, Jilin 132013, China
萱草花,又名黄花菜、金针菜,为百合科萱草属植物,其营养丰富,作为蔬菜和药物使用已有上千年的历史。《本草纲目》中记载:萱草花具有安神醒脑、增智宽胸和美颜养血等多种功效[1]。黄酮类化合物是萱草花的主要活性成分之一[2]。有研究[3, 4, 5]表明:萱草花提取物具有抗结核、抗菌、抗抑郁、镇静安神和抗肿瘤等作用。其中萱草花中的秋水仙碱对细胞有丝分裂有明显的抑制作用[6],萱草花中的大黄素对肺癌A549细胞DNA合成有明显抑制作用[7]。近几年对萱草花抗肿瘤作用的研究较少,尤其是萱草花总黄酮(hemerocallis citrine baroni flavonids,HCBF)的抗肿瘤作用尚未见相关报道。本实验从萱草花中提取总黄酮,制备HCBF含药血清,旨在探讨HCBF含药血清对人肝癌HepG2细胞增殖和凋亡的影响,并探讨其抗肿瘤机制,为开发萱草花的药用价值、探索抗肝癌药物提供理论依据。
1 材料与方法 1.1 细胞、动物、主要试剂和仪器人肝癌HepG2细胞株由吉林医药学院科研实验中心提供,HCBF由本课题组提取分离,总黄酮含量为26.5%[8]。SPF级Wistar雄性大鼠20只,体质量(230±20) g,由吉林医药学院动物实验室提供。高糖DMEM培养基、青链霉素和胎牛血清(美国Gibco公司),四甲基噻唑蓝(MTT)和二甲基亚砜(DMSO)(美国Sigma公司),0.25%胰蛋白酶(美国Amresco公司),Caspase-3、bcl-2和Bax抗体(北京中杉公司),流式细胞凋亡试剂盒(美国eBiocience公司)。MODEL 550型酶标仪(美国Bio-BAD公司),EPICS-XL流式细胞仪(美国Beckmen Coulter公司)。
1.2 HCBF含药血清的制备[9]健康大鼠20只,随机分为4组,即空白对照组(0.9%生理盐水)及低(900 mg·kg-1)、中(1800 mg·kg-1)和高(2700 mg·kg-1)剂量HCBF组,均灌胃给药,每天2次,连续4d。于第4天灌胃 2h 后,腹主动脉取血,3000r·min-1离心15 min,分离血清,0.22 μm 微孔滤膜过滤除菌后分装,置于-20℃冰箱保存备用。
1.3 细胞培养HepG2细胞在含10%新生小牛血清的完全培养液中培养,置于37℃、5%CO2培养箱中,细胞呈贴壁状态生长,在倒置显微镜下观察细胞生长状况并拍照,适量时进行细胞传代。
1.4 MTT法检测HepG2细胞生长抑制率取对数生长期的HepG2细胞,调整细胞密度为5×104 mL-1,按每孔100 μL接种于96孔培养板中,每组5个复孔。次日待细胞贴壁后,将各孔培养液吸出,分别加入5%不含药空白血清及低、中和高剂量 HCBF含药血清100μL ,在 37℃、5% CO2及饱和湿度条件下培养 48h,在倒置显微镜下观察细胞生长状态并拍照。每孔加入20 μL MTT 孵育4h,每孔加150 μL DMSO,低速振荡10 min,酶标仪490nm波长测得吸光度(A)值并记录结果。细胞生长抑制率=(1-含药组A值/空白对照组A值)×100%。
1.5 流式细胞术检测HepG2细胞凋亡率低、中和高剂量HCBF含药血清作用于HepG2细胞后,取5×105个细胞,用PBS洗涤2次,取195 μL结合缓冲液重悬细胞,加入5 μLFTIC-标记Annexin-Ⅴ,室温下避光反应30 min;结合缓冲液洗涤细胞2次,结合缓冲液40 μL重悬细胞,加入PI溶液5 μL,5 min后用流式细胞仪检测各组细胞凋亡率。
1.6 酶联免疫吸附法检测HepG2细胞中Bax、bcl-2和Caspase-3蛋白表达水平低、中和高剂量HCBF含药血清作用于HepG2细胞后,收集各组细胞培养上清液,将上清液与包被液按1∶1比例加入到96孔板中,对照组为100%包被液,每孔200 μL。封闭液封闭1.5h,PBST洗涤后加入一抗 Caspase-3、Bcl-2和Bax抗体(稀释倍数1∶1000) 孵育过夜,PBST洗涤后加入二抗室温孵育1.5 h,显色、终止,酶标仪492nm波长处测得A值并记录结果,以其代表蛋白表达水平。
1.7 统计学分析采用SPSS 17.0软件包进行统计学分析。各组细胞生长抑制率、细胞凋亡率和HepG2细胞中蛋白表达水平均以 ±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
低、中和高剂量HCBF组HepG2细胞的生长抑制率明显升高,并呈明显的剂量依赖效应。与空白对照组比较,中和高剂量HCBF组细胞生长抑制率差异有统计学意义(P<0.05或P<0.01)。见表1。
(n=5, ±s,η/%) ±s,η/%) | |
| Group | Inhibitory rate of growth |
| Blank control | 0.00±1.85 |
| HCBF(mg·kg-1) | |
| 900 | 2.56±1.78 |
| 1 800 | 8.83±4.25* |
| 2 700 | 35.89±6.22** |
| *P<0.05,** P<0.01 vs blank controlgroup. | |
倒置显微镜下观察:空白对照组HepG2细胞形态呈梭形或多角形,贴壁生长,轮廓清晰,生长状态良好;低、中和高剂量HCBF组HepG2细胞的体积缩小,连接消失,形状不规则,与周围细胞脱离,细胞核呈浓缩和破碎状态。见图1(插页四)。
2.3 各组HepG2细胞凋亡率低、中和高剂量HCBF组细胞凋亡率随着含药血清剂量的升高而呈剂量依赖性升高。与空白对照组比较,中和高剂量HCBF组细胞凋亡率(19.24%±3.61%和19.57%±3.73%)明显升高,差异有统计学意义(P<0.05或P<0.01)。见图2和表2。
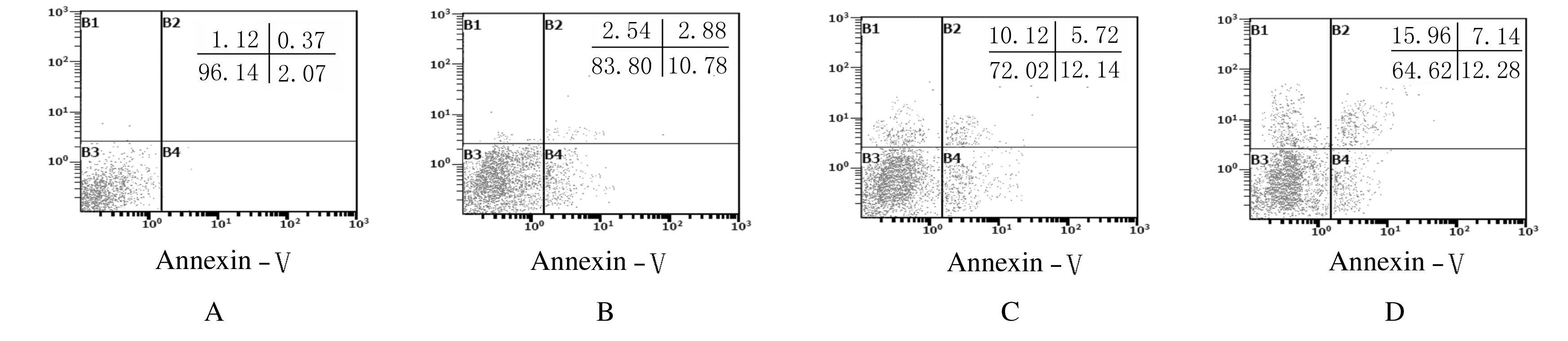
|
| A:Blank control group;B-D:900,1 800,and 2 700 mg·kg-1 HCBF groups. 图2 流式细胞术检测各组HepG2细胞凋亡情况 Fig.2 Apoptosis of HepG2 cells in various groups detected by flow cytometry |
(n=5, ±s,η/%) ±s,η/%) | |
| Group | Apoptotic rate |
| Blank control | 2.80±1.96 |
| HCBF(mg·kg-1) | |
| 900 | 12.68±2.52 |
| 1 800 | 19.24±3.61* |
| 2 700 | 19.57±3.73** |
| *P<0.05,** P<0.01 vs blank control group. | |
HCBF含药血清作用于肝癌HepG2细胞,随着药物剂量的升高,Bax蛋白表达水平逐渐升高,与空白对照组比较,中和高剂量HCBF组差异有统计学意义(P<0.05或P<0.01); bcl-2蛋白表达水平逐渐降低,与空白对照组比较,中和高剂量HCBF组差异有统计学意义(P<0.05或P<0.01); Caspase-3蛋白表达水平逐渐升高,与空白对照组比较,高剂量HCBF组差异有统计学意义(P<0.05)。见图3。

|
| A:Blank control group; B-D:900,1800,and 2700 mg·kg-1 HCBF groups.*P<0.05,**P<0.01 vs blank control group. 图3 各组HepG2细胞中Bax、bcl-2和Caspase-3蛋白表达水平 Fig.3 Expression levels of Bax,bcl-2,and Caspase-3 proteins in HepG2 cells in various groups |
原发性肝癌(肝癌)是我国高发的恶性肿瘤,约占每年全球新发病例的50%,发病率与死亡率居恶性肿瘤第2位[10]。手术切除及肝脏移植是肝癌治疗的唯一选择。随着对肿瘤机制的深入研究,从天然植物中寻找具有抗肿瘤活性的药物已成为抗肿瘤药物研究的主要途径之一。迄今为止,仅有索拉非尼这一靶向药物被证实在肝癌治疗中有效[11],因而开发新型抗肝癌药物具有重要的意义。大量研究[12, 13, 14]显示:黄酮类化合物通过抗氧化、抗自由基,诱导肿瘤细胞凋亡,阻滞细胞分裂周期,抑制肿瘤血管新生等多种途径促进其凋亡 。
萱草花是广泛存在于自然界中的百合科萱草属植物,从中提取的HCBF具有抗氧化、抗炎、抗病毒、保肝和抗心脑血管疾病等多种药效。本研究结果显示:HCBF含药血清可以明显地抑制肝癌HepG2细胞的生长,并呈现明显的剂量依赖性,倒置显微镜下观察证明了这种趋势。目前HCBF抗肿瘤的作用机制尚不清楚,本研究结果与前期报道的HCFB抑制肺癌细胞DNA生物合成、抑制肿瘤生长相似[6],可能是由于HCBF中含有秋水仙碱,直接作用于成纤维细胞的微管系统,抑制了成纤维细胞的有丝分裂[15]。本研究结果初步说明了HCBF含药血清具有抗肝癌细胞生长的作用,由于HCBF对正常细胞的也具有细胞毒性,具体机制有待进一步研究。
细胞凋亡的发生发展受到精确调控,各种胞外凋亡信号在特定的信号通路调控下传至胞内,激活靶位引发细胞凋亡。细胞凋亡分为Caspase依赖型和Caspase非依赖型2种。Caspase依赖型通过线粒体途径和死亡受体途径启动凋亡;线粒体凋亡通路由bcl-2家族构成,在凋亡发生因素中,凋亡蛋白bcl-2、Bax的表达量决定了细胞是否发生凋亡[16]。本研究通过Annexin Ⅴ/PI双染进一步检测各组细胞的凋亡率,结果显示:HCBF含药血清可以诱导HepG2细胞发生凋亡,细胞凋亡率也随着药物浓度的增高而增加。本实验结果同时显示:促凋亡蛋白Bax表达水平升高,而抗凋亡蛋白bcl-2表达水平降低。Caspase-3是凋亡途径下游主要的效应因子,是细胞凋亡的具体执行者,当细胞凋亡发生时,Caspase-3表达量升高[17]。本实验结果显示:HCBF含药血清使Caspase-3表达水平升高,说明HCBF含药血清抑制肝癌HepG2细胞的生长是由于上调了Bax表达和下调了bcl-2的表达,使促凋亡因素占优势,进而使Caspase-3蛋白活化,这是其诱导肝癌HepG2细胞凋亡的机制之一。
综上所述,本实验初步探讨了HCBF含药血清调节bax/bcl-2表达水平,促进Caspase-3表达这一机制对肝癌HepG2细胞的生长抑制作用,说明其促凋亡作用与细胞线粒体途经有关,但HCBF在细胞凋亡过程中还存在抗氧化[18, 19, 20]、抑制细胞DNA合成等途径[6]。HCBF诱导肝癌HepG2细胞凋亡的具体机制还需要进一步的体外及体内实验证明。
| [1] | 王云锋,赵丽晶,徐 博,等.萱草花的营养成分和生物活性研究进展[J].吉林医药学院学报,2012,33(1):46-49. |
| [2] | Benavente-García O,Castillo J. Update on uses and properties of citrus flavonoids:new findings in anticancer,cardiovascular,and anti-inflammatory activity[J]. J Agric Food Chem,2008,56(15):6185-6205. |
| [3] | 李治伟,张 斌,宋海鹏,等. 萱草花对四氯化碳急性肝损伤的保护作用研究[J]. 安徽农业科学,2012,40(36):17536-17537. |
| [4] | Taguchi K,Yamasaki K,Maesaki H,et al. An evaluation of novel biological activity in a crude extract from Hemerocallisfulva L. var. sempervirens M. Hotta[J]. Nat Prod Res,2014,28(23):2211-2213. |
| [5] | 郭冷秋,张 颖,张 博,等. 萱草根及萱草花的化学成分和药理作用研究进展[J].中华中医药学刊,2013,31(1):74-76. |
| [6] | 何红平,纪舒昱,朱洪友,等.秋水仙碱的氨(胺)解反应及其衍生物体外抗癌活性研究[J].化学研究与应用,2000,12(5):528-530. |
| [7] | Cichewicz,RH,Lim KC,McKerrow JH,et al. Kwanzoquinones A-G and other constituents of Hemerocallis fulva 'Kwanzo' roots and their activity against the human pathogenic trematode Schistosomamansoni [J]. Cheminform,2002,58(42):8597-8606. |
| [8] | 沈 楠,黄晓东,李治伟,等. 萱草花总黄酮改善CCl4致大鼠肝纤维化的作用[J]. 药学学报,2015,50(5):547-551. |
| [9] | 魏雅芹,汤道权,高媛媛,等. 银杏叶提取物血清药理学方法的建立及验证[J].中药药理与临床,2009,25(3):74-79. |
| [10] | Morales-Romero J,Vargas G,García-Román R. Occult HBV infection:a faceless enemy in liver cancer development[J].Viruses,2014,6(4):1590-1611. |
| [11] | Reig M,Torres F,Rodriguez-Lope C,et al. Early dermatologic adverse events predict better outcome in HCC patients treated with sorafenib[J]. J Hepatol,2014,61(2):318-324. |
| [12] | 杨 楠,贾晓斌,张振海,等. 黄酮类化合物抗肿瘤活性及机制研究进展[J].中国中药杂志,2015,40(3):373-381. |
| [13] | 周 晨,谢宛玉. 黄酮类化合物诱导肿瘤细胞凋亡分子机制研究进展[J]. 中国医药导报,2010,7(10):18-19. |
| [14] | Park C,Lee WS,Go SI,et al.Morin,a flavonoid from moraceae,induces apoptosis by induction of BAD protein in human leukemic cells[J].Int J Mol Sci, 2015,16(1):645-659. |
| [15] | 何成雄.萱草花提取液及表皮生长因子对人真皮成纤维细胞增殖的作用[J].中华皮肤科杂志,1994,27(4):218-220. |
| [16] | 齐 玲,徐俊杰,纪朋艳,等. 西兰花多肽抑制胶质瘤细胞生长的机制研究[J].中国药学杂志,2014,49(12)1027-1031. |
| [17] | 齐 玲,金 宏,赵东海,等.五味子木脂素诱导胶质瘤神经球细胞凋亡的机制研究[J]. 中国药学杂志, 2014,49(2):113-116. |
| [18] | 沈 楠,黄晓东,王艳春,等. 萱草花总黄酮改善肝细胞HL-7702氧化损伤的研究[J]. 中草药,2015,46(21):3208-3213. |
| [19] | 张翔飞.黄芪总苷对二乙基亚硝胺诱导的大鼠肝癌生长的影响[J].郑州大学学报:医学版,2014,49(5):719-722. |
| [20] | 杨振宇,杜锡林,杨 涛,等.多结节肝细胞癌的基础研究及治疗策略[J].临床肝胆病杂志,2016,32(6):1212-1215. |
 2016, Vol. 42
2016, Vol. 42


