扩展功能
文章信息
- 张敏, 崔运芹, 宋焕芳, 吕建祎, 徐笑红, 高基民
- ZHANG Min, CUI Yunqin, SONG Huanfang, LYU Jianyi, XU Xiaohong, GAO Jimin
- 吉林大学学报(医学版), 2016, 42(04): 731-736
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 731-736
- 10.13481/j.1671-587x.20160419
-
文章历史
- 收稿日期: 2015-11-11
2. 温州医科大学检验医学院/生命科学学院 浙江省模式生物技术与应用重点实验室, 浙江 温州 325035
2. Zhejiang Provincial Key Laboratory for Technology & Application of Model Organisms, School of Laboratory Medicine and Life Sciences, Wenzhou Medical University, Wenzhou 325035, China
肺癌是发生于支气管黏膜上皮组织的恶性肿瘤,亦被称为支气管癌,包括小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-smallcell lung cancer,NSCLC)[1]。流行病学研究已经确认吸烟是肺癌发病的首要高危因素,80%~90%的肺癌与吸烟相关。迄今为止,已经证实了香烟中有超过60种的致癌物质,其中苯并芘是香烟中最为明确且典型的重要致肺癌化合物。最新研究[2]表明:苯并芘在肺慢性炎症致肺癌发生发展的过程中发挥重要作用,并且可能与沉默信息调节因子1(silent information regulator 1,SIRT1)的表达及活性调控有关联,但其具体作用机制尚未明确。SIRT1作为烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的组蛋白脱乙酰化酶,能够通过调控多种蛋白质发生去乙酰化作用,参与到基因表达调控以及机体免疫炎症反应等多种生物学功能的调控过程中。近年来研究[3, 4, 5, 6, 7]显示:SIRT1能够通过调控炎性因子的表达,参与机体炎性免疫系统调控肿瘤发生发展的过程。
表皮生长因子受体(epidermal growth factor receptor,EGFR)及其相关的酪氨酸激酶构成的信号通路在促炎因子分泌、细胞增殖和分化等过程中发挥重要作用。美国国立综合癌症网络(NCCN)[8, 9]建议:根据EGFR的突变情况决定临床诊断和治疗NSCLC的策略。
本研究旨在利用人支气管上皮BEAS-2B细胞和相关肺部组织临床标本,研究EGFR在苯并芘诱导SIRT1活化中的作用,为探讨EGFR/SIRT1信号转导通路在肺癌发生发展过程中的作用及其相应分子机制提供理论依据。
1 材料与方法 1.1 实验菌株人支气管上皮BEAS-2B细胞由美国纽约大学黄传书教授馈赠。
1.2 主要试剂苯并芘和酪氨酸蛋白激酶抑制剂Genistein(美国Sigma-Aldrich公司),人表皮细胞生长因子(hEGF)(美国Pepro Tech公司),DMEM培养基和胎牛血清(美国Gibco公司),TRIzol和LipofectamineTM 2000(美国Invitrogen公司),PrimeScript®RT Reagent Kit和DL1000 DNA Marker(大连宝生物工程有限公司),2×Taq PCR MasterMix(北京天根生化科技有限公司),Dual-Luciferase Report Assay System(美国Promega公司),一抗β-actin和二抗HRP辣根过氧化物酶标记(上海碧云天生物技术有限公司),一抗EGFR(美国Abcam公司),其他试剂均为国产分析纯。全自动酶标仪(美国Thermo公司),Quantily One v4.62 软件(美国Bio-Rad公司)。
1.3 细胞培养BEAS-2B细胞用含有10%胎牛血清、1% L-谷氨酰胺和1%双抗的DMEM培养基,置于5% CO2、37℃的细胞培养箱中培养。BEAS-2B细胞每周2次利用胰酶消化后,转入一个新的25 cm2细胞培养瓶中继续培养。
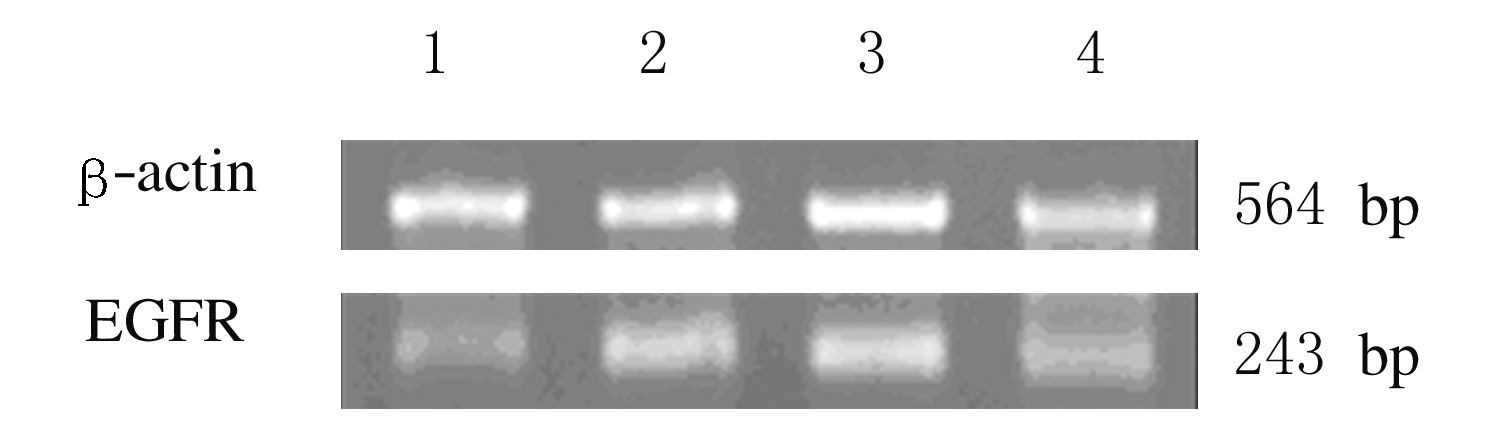
1.4 逆转录聚合酶链式反应(RT-PCR)检测BEAS-2B细胞中EGFR mRNA表达水平采用8 μmol·L-1 苯并芘刺激BEAS-2B细胞不同时间(6、12和24h),采用TRIzol试剂提取细胞总RNA,Nanodrop 2000分光光度计检测其纯度和浓度。按照PrimeScript®RT Reagent Kit实验步骤合成总cDNA,并通过半定量RT-PCR检测细胞中EGFR mRNA表达水平,以β-actin作为内参。人EGFR的引物为5'-CTGACTCCGTCCAGTA-TTGAT-3'和5'-CAAGGACCACCTCACAGTTAT-3',内参β-actin引物为5'-CTGGGACGACATGGAGAAAA-3'和5'-AAGGAAGGCTGGAAGAGTGC-3',由北京华大基因研究中心合成。PCR产物采用2%琼脂糖凝胶进行电泳,采用凝胶成像分析系统检测PCR扩增结果。采用Quantity One v4.62软件对EGFR和β-actin电泳条带进行灰度值分析,以其比值表示EGFR mRNA表达水平。
1.5 蛋白免疫印迹法检测BEAS-2B细胞中EGFR蛋白表达水平将BEAS-2B细胞(2×105)接种于6孔板中,在含10%胎牛血清的DMEM培养基中培养,当细胞生长覆盖至培养皿底壁面积的50%~60%时,按照实验设计利用8 μmol·L-1苯并芘刺激细胞不同时间(6、12、24和48h),收集细胞。细胞蛋白提取物利用SDS-PAGE凝胶分离、转膜,并分别用相应的一抗进行孵育,加入HRP辣根过氧化物酶标记的二抗,ECL化学发光试剂孵育后, 使用凝胶成像分析系统进行检测。采用Quantity One v4.62软件对EGFR和β-actin电泳条带进行灰度值分析,以其比值表示EGFR蛋白表达水平。
1.6 荧光素酶报告分析技术检测SIRT1荧光素酶活性将SIRT1启动子荧光素酶报告载体(4 μg)按照LipofectamineTM 2000实验步骤瞬时转染入BEAS-2B细胞中,24 h后接种于96孔板中(每孔8×103个),当细胞生长覆盖至培养皿底壁面积的60%~70%时,按照实验设计处理细胞24 h:培养基中加入200 μg·L-1 hEGF(hEGF组)和(或)8 μmol·L-1苯并芘(苯并芘组),10、30、60和100 μmol·L-1Genistein和(或)8 μmol·L-1苯并芘。开始荧光素酶检测前,将培养的细胞平衡至室温。然后向每孔中加入与孔内原始培养基体积相同的Dual-Luciferase® Luciferase Reagent,充分混匀。等待至少10 min后,让细胞充分裂解,利用全自动酶标仪进行萤火虫荧光(Firefly Luc)检测。再向每孔中加入与孔内起始培养基体积相同的Dual-Glo®Stop&Glo® Reagent,充分混匀。等待至少10 min后,进行海肾荧光(Renilla Luc)测量。海肾荧光的平板测量顺序要与萤火虫荧光相同,计算Firefly Luc/Renilla Luc的比值,以其比值表示SIRT1荧光素酶活性,以空载体转染细胞作为对照组。
1.7 免疫组织化学法检测人肺组织中EGFR蛋白表达水平从温州医科大学附属第一医院收集相关肺组织标本,包括36例肺癌组织标本及相应正常肺组织标本,依次通过石蜡包埋切片、脱蜡、复水、抗原修复、一抗/二抗孵育、DAB显色等步骤,采用免疫组织化学染色法检测EGFR蛋白表达水平。采用Image-Pro Plus version 6.0软件进行吸光度(A)值测定,计算肺癌组织与正常肺组织A值的比值,以此表示EGFR蛋白表达水平。
1.8 人肺组织HE染色石蜡包埋切片依次通过脱蜡、复水、染色、脱水、透明和封片等步骤,光镜下观察肺癌组织和癌旁正常肺组织形态表现。
1.9 统计学分析采用SPSS 13.0软件进行统计学分析。
BEAS-2B细胞中EGFR mRNA和蛋白表达水平、STRT1荧光素酶活性及肺组织中EGFR蛋白表达水平以 ±s 表示,2组间比较采用t检验。显著性水平设定为α=0.05。
±s 表示,2组间比较采用t检验。显著性水平设定为α=0.05。
利用MOTIF SearchTM分析软件(http://www.genome.jp/tools/motif/)对SIRT1启动子序列(-3000~200bp)的结合位点进行预测,预测到SIRT1启动子序列上含有3个转录DNA结合位点,即表皮细胞生长因子(epidermal growth factor,EGF)、血管性血友病因子(von Willebrand factor type,vWF)和铁氧还蛋白(2Fe-2S)。见表1。
| Site | Position | Posite number |
| EGF | 3015..3026 3026..3037 | PS00022 |
| vWF | 3089..3100 3116..3127 3067..3127 3083..3139 3088..3139 | PS01208 |
| 2Fe-2S | 3122..3130 3188..3196 | PS00197 |
RT-PCR法:与对照组(1.00±0.13)比较,作用6、12和24 h苯并芘组BEAS-2B细胞中EGFR mRNA表达水平(1.97±0.15、2.17±0.12和1.70 ±0.10)明显升高(P<0.05),且在12h达到峰值(图1)。蛋白质免疫印迹法:与对照组(1.00±0.19)比较,作用6、12、24 和48 h后苯并芘组BEAS-2B细胞中 EGFR蛋白表达水平(2.71±0.20、2.17±0.12 、2.20±0.21和1.53±0.15)明显升高(P<0.05)(图2 )。
|
| Lane1:Control group;Lane 2-4:B[a]P group (6,12,and 24 h after exposure). 图1 不同时间苯并芘组BEAS-2B细胞中EGFR mRNA表达电泳图 Fig.1 Electrophoregram of expressions of EGFR mRNA in BEAS-2B cells in B[a]P groups at different time |

|
| Lane 1:Control group;Lane 2-5:B[a]P group (6,12,24,and 48 h after exposure). 图2 不同时间苯并芘组BEAS-2B细胞中EGFR蛋白表达电泳图 Fig.2 Electrophoregram of expressions of EGFR protein in BEAS-2B cells in B[a]P groups at different time |
与对照组(1.00±0.04)比较,hEGF组和苯并芘组BEAS-2B细胞中SIRT1荧光素酶活性 (1.98±0.15 和3.03±0.32)明显增加(P<0.05或P<0.01),hEGF联合苯并芘组BEAS-2B细胞中SIRT1荧光素酶活性(3.83±0.12)增加更为明显(P<0.001)。
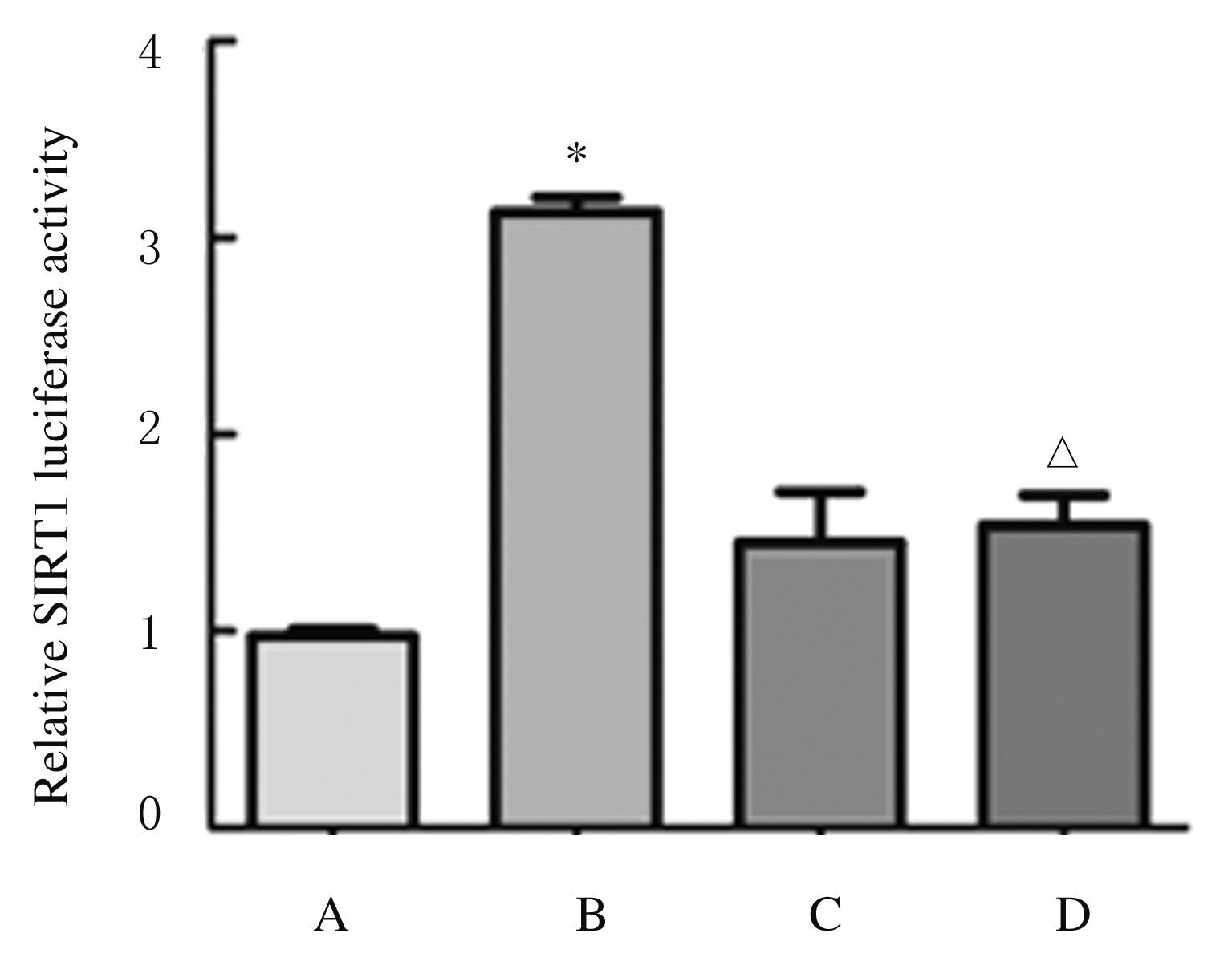
采用不同浓度Genistein(0、10、30、60和100 μmol·L-1)作用BEAS-2B细胞24h,利用倒置显微镜观察各组BEAS-2B细胞形态的改变,Genistein浓度大于30 μmol·L-1时,细胞排列逐渐稀疏,形态改变明显(图3,见插页三)。因此,后续实验选用30 μmol·L-1 Genistein作为实验浓度。利用SIRT1启动子的荧光素酶报告基因技术检测BEAS-2B细胞中SIRT1荧光素酶活性,Genistein(30 μmol·L-1)能够抑制苯并芘诱导的SIRT1荧光素酶活性增加,与苯并芘组比较差异有统计学意义(P<0.05)。见图4。
|
| A:Control group;B: B[a]P (8 μmol·L-1) group;C:Genistein (30 μmol·L-1) group;D:B[a]P (8 μmol·L-1)+ Genistein (30 μmol·L-1) group. *P<0.01 compared with control group;△P<0.05compared with B[a]P (8 μmol·L-1) group. 图4 Genistein作用后各组BEAS-2B细胞中SIRT1荧光素酶活性直条图 Fig.4 Histogram of SIRT1 luciferase activities in BEAS-2B cells after treated with Genistein |
采用免疫组织化学法(图5A和B,见插页四)和HE染色法(图5C和D,见插页四)检测人肺组织标本中EGFR蛋白表达水平,结果显示:肺癌组织中EGFR蛋白表达水平明显高于正常肺组织。进一步采用Imagepro Plus软件对免疫组织化学图片进行分析:肺癌组织中EGFR蛋白表达水平明显高于正常肺组织(36.09 ± 8.84 vs 1.00±0.50)(P<0.001)。
3 讨 论在世界范围内,肺癌已经成为发病率和致死率最高的恶性肿瘤,约占所有恶性肿瘤死亡人数的28%和新发恶性肿瘤患者的14%。同时,中国的肺癌发病率已经处于世界首位。根据中国卫生部2008年发表的第3次居民死亡原因调查结果显示:肺癌已经取代肝癌,成为我国首位恶性肿瘤死因,20世纪90年代与70年代比较,肺癌死亡率上升了465%,占全部恶性肿瘤死亡人数的22.7%。同时,由于缺乏有效的早期发现手段,中晚期患者治疗花费大而且收获小,使得肺癌防治成为癌症防治的重点和难点[10, 11]。现有的研究已经阐述了肺癌与众多诱因之间的关系,包括吸烟、环境因素和遗传等,并且已经确认吸烟是肺癌发病的首要高危因素。迄今为止,香烟中已经证实了超过60种致癌物质,其中苯并芘及其代谢产物B[a]PDE是香烟中最为明确且典型的重要致肺癌化合物。虽然每支香烟中苯并芘的含量仅有8.5~17.6ng,但长期吸烟或从污染的空气中吸入的苯并芘具有累积效应[12, 13, 14]。早期研究[15]显示:苯并芘及B[a]PDE能够形成DNA加合物,导致DNA的损伤和p53基因G→T发生突变。本课题组前期研究[2]表明:苯并芘致肺癌发生发展的过程与肺慢性炎症密切相关,但其具体作用机制尚待进一步探讨。
随着研究的不断深入以及肺癌患者人数的逐年升高,慢性炎症在肺癌发生发展中的调控机制得到了越来越多研究者的关注,慢性炎症已被证实可能与20%的癌症发病相关。同时,慢性炎症导致肿瘤的发生发展可能与由炎性细胞和炎性调控因子(包括细胞因子、趋化因子、酶)组成的炎性微环境有关联。炎性微环境在抑制肿瘤生长的同时,也能通过不同信号转导通路促进肿瘤的发生发展[16]。本课题组前期研究[2]表明:苯并芘可能是通过诱导SIRT1的表达,从而诱导肺慢性炎症反应,但其具体作用机制尚待进一步研究。
近年来研究[2, 3]显示:SIRT1能够通过调控炎性因子的表达,参与机体炎性免疫系统调控肿瘤发生发展的过程。与大量肿瘤相关细胞因子的多效性相似,SIRT1在肿瘤发生发展过程中的功能较为复杂。SIRT1表达于许多癌组织中,如人类前列腺癌、急性髓性白血病和原发性结肠癌中SIRT1表达水平明显升高。本课题组前期研究利用免疫组织化学实验检测人肺组织标本中SIRT1蛋白表达水平的结果表明:SIRT1蛋白在肺恶性肿瘤组织,包括腺癌和鳞癌中的表达水平明显高于正常肺组织。同时,SIRT1能够降低肿瘤抑制蛋白的表达水平和DNA损伤修复蛋白的活性[2, 17]。因此,SIRT1被认为是一种促癌基因。也有研究[4]显示:SIRT1在一些其他类型的癌症组织中表达水平降低,并且SIRT1缺陷会导致遗传不稳定性和肿瘤形成,从而使得SIRT1发挥抑癌基因效应。也有研究者[18, 19]发现:在81例人结肠癌标本中,异位过表达SIRT1能够较大程度降低由活性β-catenin调控的人结肠癌细胞系的增殖水平。SIRT1在肿瘤发生发展过程中的双重作用可能与其蛋白、组蛋白和染色体的表观遗传修饰在基因表达、癌症形成和寿命调控过程中发挥的不同作用有关。为了进一步探讨SIRT1在苯并芘诱发慢性炎症中的作用,本研究利用MOTIF SearchTM分析软件对SIRT1启动子序列(-3000~200bp)的结合位点进行了预测,结果发现:SIRT1启动子序列上含有3个转录DNA结合位点,包括EGF、vWF和2Fe-2S。
EGFR是EGF信号转导和细胞增殖的受体,作为EGF的主要效应分子,在肺癌、结肠癌和胰腺癌等癌组织中表达水平均升高。正常情况下,机体能够根据细胞外的信号刺激,调控EGFR基因的表达,进而调控细胞生长速度。当机体遇到激发信号时,细胞表面的EGFR受体就会发生聚合反应,形成EGFR二聚体,从而激活下游相关的激酶系统,诱发细胞增殖[8, 9]。为了验证EGFR在苯并芘诱导肺癌发生发展中的作用,本研究检测了BEAS-2B细胞暴露在苯并芘环境时EGFR mRNA和蛋白表达水平的结果显示:苯并芘无论在mRNA水平还是蛋白水平均能促进EGFR的表达。同时,本研究收集了相关肺组织临床标本,利用免疫组织化学法检测了EGFR蛋白表达水平,结果显示: 在人肺癌组织中EGFR蛋白表达水平高于正常肺组织。
本研究结果显示:苯并芘能够分别诱导SIRT1和EGFR的表达,并且SIRT1转录因子结合位点包含EGFR。因此推测:苯并芘暴露下,EGFR能够增强SIRT1的转录活性,进而提高SIRT1的表达量。本文作者通过构建SIRT1启动子的荧光素酶报告质粒以及荧光素酶实验,检测了在BEAS-2B细胞培养基中加入hEGF和Genistein后,在有或无苯并芘暴露的情况下,EGFR对SIRT1转录活性的影响,实验结果验证了本文作者的推测。
研究[8, 9]显示:EGFR在NSCLC等肿瘤中高表达,能够促进细胞的增殖和分化,与NSCLC等肿瘤的发生发展及预后密切相关。因此,EGFR成为了临床诊断和治疗NSCLC的重要靶点。表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)正是运用以上机制,通过抑制EGFR活性,进而抑制EGFR磷酸化水平和相关信号转导通路的活性,从而发挥抗肿瘤作用,该机制的研究为NSCLC患者、特别是晚期NSCLC患者的治疗提供了新的思路。
本研究结果表明:在苯并芘暴露下,EGFR的表达水平明显升高,并且EGFR能够促进SIRT1的转录活性,进而提高SIRT1的表达水平,诱导肺慢性炎症反应。本研究结果为今后进一步探讨苯并芘通过肺慢性炎症致肺癌发生发展的作用机制,以及EGFR靶向抗癌药物特别是抗肺癌药物的药理机制研究提供了理论依据。
| [1] | Pass DP,Carbone DH,Johnson,et al. Principles and practice of lung cancer:the offical referencetext of the LASLC[M]. 4th ed. Philadelphia:Lippincott Williams & Wilkins,2010:287-324. |
| [2] | Lu J,Zhang M,Huang Z,et al. SIRT1 in B[a]P-induced lung tumorigenesis[J]. Oncotarget,2015,6(29):27113-27229. |
| [3] | 曲 柳,仇丽鸿.SIRT1抑制炎症反应的研究进展[J].中国实用口腔科杂志,2013,6(9):566-570. |
| [4] | Yang H,Bi Y,Xue L. Multifaceted modulation of SIRT1 in cancer and inflammation[J]. Crit Rev Oncog,2015,20(1/2):49-64. |
| [5] | Debelec-Butuner B,Ertunc N,Korkmaz KS. Inflammation contributes to NKX3.1 loss and augments DNA damage but does not alter the DNA damage response via increased SIRT1 expression[J]. J Inflamm (Lond),2015,12:12. |
| [6] | Gao R,Chen J,Hu Y,et al. Sirt1 deletion leads to enhanced inflammation and aggravates endotoxin-induced acute kidney injury[J]. PLoS One,2014,9(6):e98909. |
| [7] | Gao R,Ma Z,Hu Y,et al. Sirt1 restrains lung inflammasome activation in a murine model of sepsis[J]. Am J Physiol Lung Cell Mol Physiol,2015,308(8):L847-853. |
| [8] | Ge L,Shi R. Progress of EGFR-TKI and ALK/ROS1 inhibitors in advanced non-small cell lung cancer[J]. Int J Clin Exp Med,2015,8(7):10330-10339. |
| [9] | Tan CS,Gilligan D,Pacey S. Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer[J]. Lancet Oncol,2015,16(9):e447-459. |
| [10] | 赵俊刚,任开明,汤 隽,等.上调mir-7表达后肺腺癌细胞对吉非替尼敏感性的变化及其机制研究[J].解放军医学杂志,2013,38(6):481-484. |
| [11] | 张 敏,曹述任.丹酚酸B对人肺成纤维细胞TGF-β1/Smad信号通路相关蛋白表达的影响及其机制[J].吉林大学学报:医学版,2014,40(4):705-709. |
| [12] | Besaratinia A,Pfeifer GP. Second-hand smoke and human lung cancer[J]. Lancet Oncol,2008,9(7):657-666. |
| [13] | Rustemeier K,Stabbert R,Haussmann HJ,et al. Evaluation of the potential effects of ingredients added to cigarettes. Part 2:chemical composition of mainstream smoke[J]. Food Chem Toxicol,2002,40(1):93-104. |
| [14] | 吕建祎,张 敏,金红蕾,等.环境致癌物诱导慢性炎症致肺癌发生发展的研究进展[J].生物化学与生物物理进展,2014,41(1):41-51. |
| [15] | Ruggeri B,DiRado M,Zhang SY,et al. Benzo[a]pyrene-induced murine skin tumors exhibit frequent and characteristic G to T mutations in the p53 gene[J]. Proc Natl Acad Sci U S A,1993,90(3):1013-1017. |
| [16] | Vendramini-Costa DB,Carvalho JE. Molecular link mechanisms between inflammation and cancer[J]. Curr Pharm Des,2012,18(26):3831-3852. |
| [17] | Xie J,Zhang X,Zhang L. Negative regulation of inflammation by SIRT1[J]. Pharmacol Res,2013,67(1):60-67. |
| [18] | Firestein R,Blander G,Michan S,et al. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J]. PLoS One,2008,3(4):e2020. |
| [19] | 卢 红,王建军,周 芳.食管鳞癌组织中磷酸化表皮生长因子受体和Akt蛋白的表达[J]. 郑州大学学报:医学版,2015,50(1):5-8. |
 2016, Vol. 42
2016, Vol. 42


