扩展功能
文章信息
- 史毅, 金晓红, 吴伟忠, 霍安, 周伟, 黄汉
- SHI Yi, JIN Xiaohong, WU Weizhong, HUO An, ZHOU Wei, HUANG Han
- 吉林大学学报(医学版), 2016, 42(04): 725-730
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 725-730
- 10.13481/j.1671-587x.20160418
-
文章历史
- 收稿日期: 2015-08-30
2. 江苏省丹阳市云阳人民医院内科, 江苏 丹阳 212300;
3. 辽宁医学院附属第一医院口腔科, 辽宁 锦州 121001
2. Department of Internal Medicine, Yunyang People's Hospital of Danyang City, Jiangsu Province, Danyang 212300, China;
3. Department of Stomatology, First Affiliated Hospital, Liaoning Medical College, Jinzhou 121001, China
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是口腔颌面部最为多见的恶性肿瘤[1, 2]。目前临床上对TSCC的治疗主要有手术、化疗、放疗和免疫治疗等方法。手术虽可作为多数TSCC治疗的首选方法,但却受到肿瘤侵及范围和有无转移等诸多因素的制约。化疗作为另一重要的治疗方法,由于其特异性差,在杀死肿瘤细胞的同时,也会不可避免地杀伤正常的组织细胞,破坏患者的免疫系统,因此临床上化疗药物的应用成了一把"双刃剑"。补骨脂为豆科一年生草本植物,广泛分布于中国。补骨脂乙素(isobavachalcone,IBC)是从补骨脂中分离得到的天然化合物。Nishimura等[3]发现:IBC通过线粒体途径诱导人神经母细胞瘤凋亡,而对正常小脑颗粒细胞无细胞毒性。进一步研究[4]证实:IBC促进肿瘤细胞OVCAR-8、PC3、A549和MCF-7的凋亡,同时又对正常肝细胞L-02和人脐静脉内皮细胞(HUVEC)无毒性作用。随着对IBC研究的不断深入,近年来研究[5]显示:IBC可有效促进多种多重耐药的肿瘤细胞凋亡。以上结果表明:IBC作为新发现的抗肿瘤药物,具有低毒高效的特征,有可能应用于临床,用以减轻化疗的毒副作用。但IBC在TSCC化疗方面的应用研究国内外尚无相关报道。本研究观察不同浓度IBC对人TSCC的Tca8113细胞增殖及凋亡的影响,同时还观察了IBC作用后凋亡相关蛋白Akt、p-Akt、Erk、p-Erk、Bax、Bcl-2和Caspase-3表达水平的变化,为IBC在TSCC临床治疗中的应用提供理论依据。
1 材料与方法 1.1 药品和主要试剂商品纯度>98%的IBC 购自上海同田生物技术有限公司。用DMSO配制成100mmol·L-1的IBC储存液,实验前用RPMI1640培养基稀释至实验所需的各种浓度,并保证DMSO终浓度<0.01%。MTT和Annexin Ⅴ-FITC/PI双染凋亡试剂盒购于南京凯基生物科技发展有限公司。Transwell小室和基质胶购于美国Sigma公司。所有抗体均购自美国Santa Cruz公司。
1.2 细胞培养人TSCC的Tca8113细胞株购自上海中科院细胞库。Tca8113细胞培养于含有10%胎牛血清、100 U·mL-1 青霉素和100 mg·L-1链霉素的RPMI 1640培养基中。在37℃、5%CO2的培养箱中培养,0.25%胰酶消化液消化传代,3~4d传代1次。取对数生长期细胞用于本实验。
1.3 MTT法检测细胞增殖抑制率取对数生长期的Tca8113细胞,制成单细胞悬液,以每孔5000个细胞铺至96孔板,设5个复孔。37℃、5%CO2培养箱中培养至70%~80%融合后加入不同浓度(0、10、20、40、80 μmol·L-1)IBC,0 μmol·L-1IBC组为对照组,同时设空白组。分别作用12、24和48h后每孔加入20 μL MTT(用1×PBS配制,5g·L-1),培养箱孵育4h后弃去MTT,再每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解,于490nm波长条件下测定吸光度(A)值。细胞增殖抑制率=1-(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.4 流式细胞术检测细胞凋亡率不同浓度IBC(0、20、40 μmol·L-1)处理Tca8113细胞48h,0 μmol·L-1IBC组为对照组。处理后的细胞1000 r·min-1离心 5 min,预冷的PBS离心洗涤1次。加入500 μLBinding Buffer混悬细胞。加入5 μLAnnexin V-FITC混匀后,加入5 μLPI混匀,室温避光反应15 min,立即采用流式细胞仪检测。实验重复3次,结果以细胞凋亡率表示。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.5 Western blotting法检测蛋白表达水平变化将对照组(0 μmol·L-1IBC组)和实验组(20和40 μmol·L-1IBC组)的细胞加RIPA裂解液在冰上裂解30 min,并用超声波裂解10s。12000 r·min-1、4℃离心30 min后,取上清液,采用Lowry法进行蛋白定量。与3×样品缓冲液混合后,煮沸5 min。取20 μL蛋白样品在12% 十二烷基硫酸钠SDS-聚丙烯凝胶中电泳约2h,然后转印至硝酸纤维素膜上。用5%脱脂奶粉封闭1h后,按预染Marker标记的相对分子质量剪裁转印膜,分别加入Akt、p-Akt、Erk、p-Erk、Bax、Bcl-2、Caspase-3及β-actin抗体4℃过夜。Tris盐水缓冲液TTBS洗4次,加入辣根过氧化物酶标记的二抗作用30 min,发光免疫分析ECL法显色后凝胶图像分析系统拍照,使用Image-Pro Plus 6.0系统分析处理结果,蛋白表达水平以目标蛋白条带灰度值与β-actin蛋白条带灰度值的比值表示。
1.6 统计学分析应用SPSS16.0统计软件进行统计学分析。各组细胞增殖抑制率、凋亡率和凋亡相关蛋白表达水平均以 ±s表示,组间比较采用单因素方差分析,两两比较采用t检验。以P<0.05表示差异有统计学意义。
±s表示,组间比较采用单因素方差分析,两两比较采用t检验。以P<0.05表示差异有统计学意义。
IBC处理Tca8113细胞12、24和48h后 IBC的半数抑制浓[LL]度(IC50)分别为(285.13±8.97)、(132.40±7.76)和(58.56±5.93) μmol·L-1。12、24和48 h时Tca8113细胞的IC50值比较差异均有统计学意义(P<0.05)。随着IBC浓度增加和作用时间的延长,各组Tca8113细胞的增殖抑制率逐渐增加,IBC呈时间-浓度依赖性抑制Tca8113细胞的增殖。见图1。
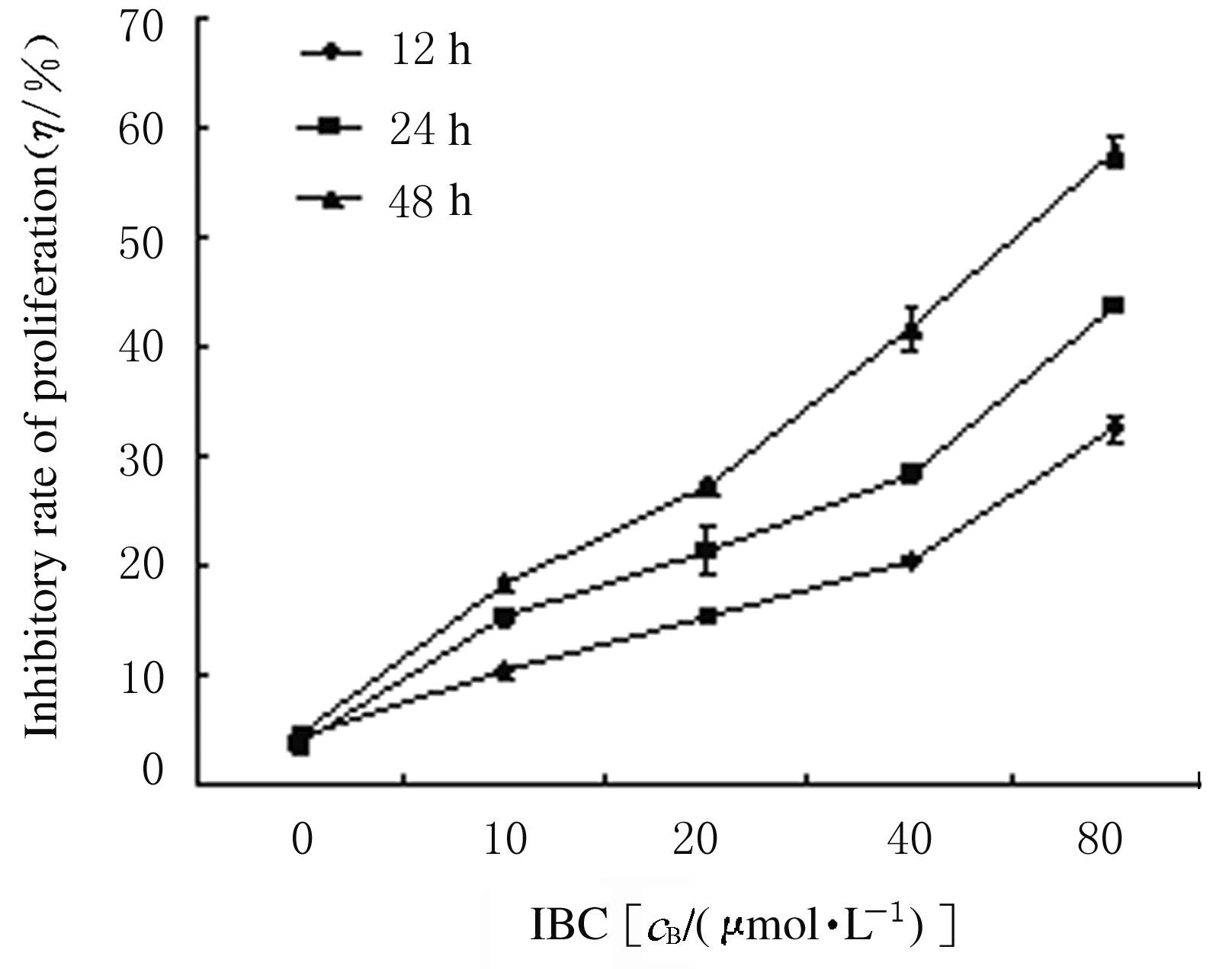
|
| 图1 各组Tca8113细胞的增殖抑制率 Fig.1 Inhibitory rates of proliferation of Tca8113 cells in various groups |
20和40 μmol·L-1 IBC作用于舌癌Tca8113细胞48 h后,细胞凋亡率分别为8.21%±2.32%和22.45%±1.18%,与对照组(1.69%±0.65%)比较差异有统计学意义(P<0.05)。见图2。
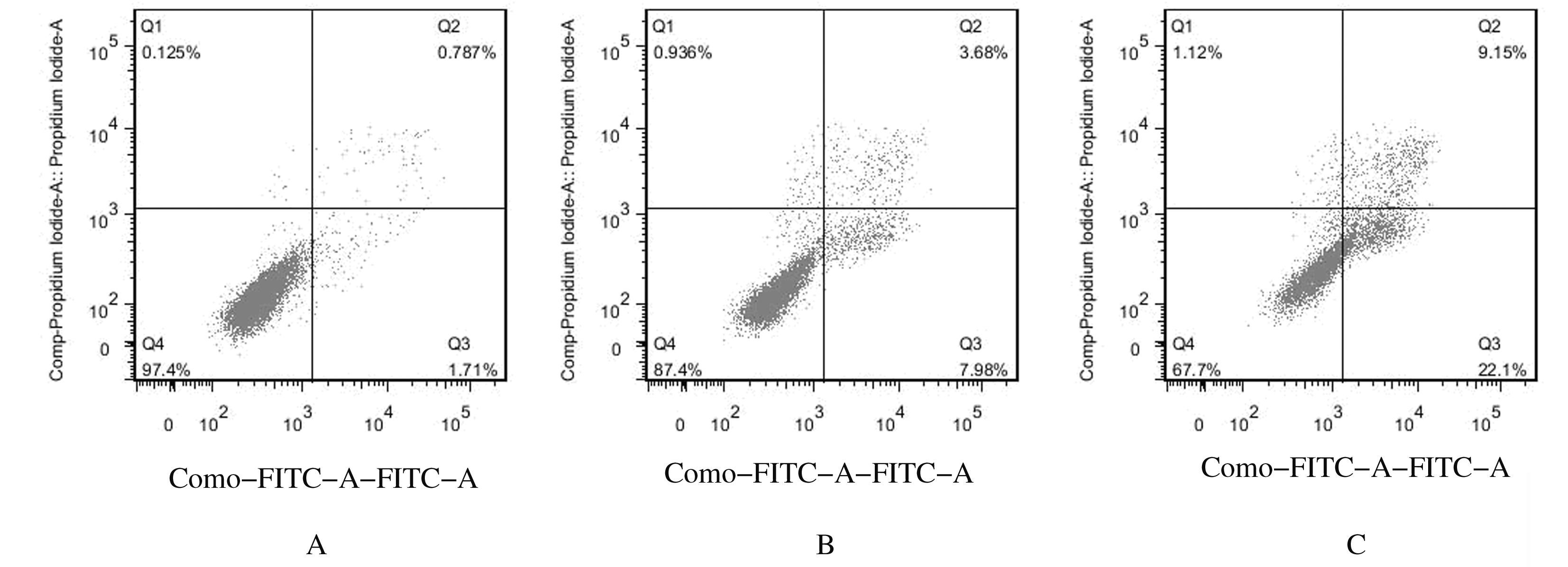
|
| 图2 Annexin Ⅴ-FITC/PI染色法检测IBC作用后各组Tca8113细胞凋亡率 Fig.2 Apoptotic rates of Tca8113 cells after treatment of IBC in various groups detected by Annexin Ⅴ-FITC/PI staining |
与对照组比较,作用48h后20和40 μmol·L-1 IBC组Tca8113细胞中抗凋亡蛋白Bcl-2表达水平明显降低(P<0.05),凋亡蛋白Bax的表达水平明显升高(P<0.05)。随着IBC作用浓度的增加,Caspase-3蛋白的裂解水平逐渐升高,与对照组比较,40 μmol·L-1IBC组Caspase-3蛋白表达水平差异有统计学意义(P<0.05)。与对照组比较,20和40 μmol·L-1 IBC组Tca8113细胞中p-Akt和p-Erk蛋白表达水平明显降低(P<0.05)。见图3。
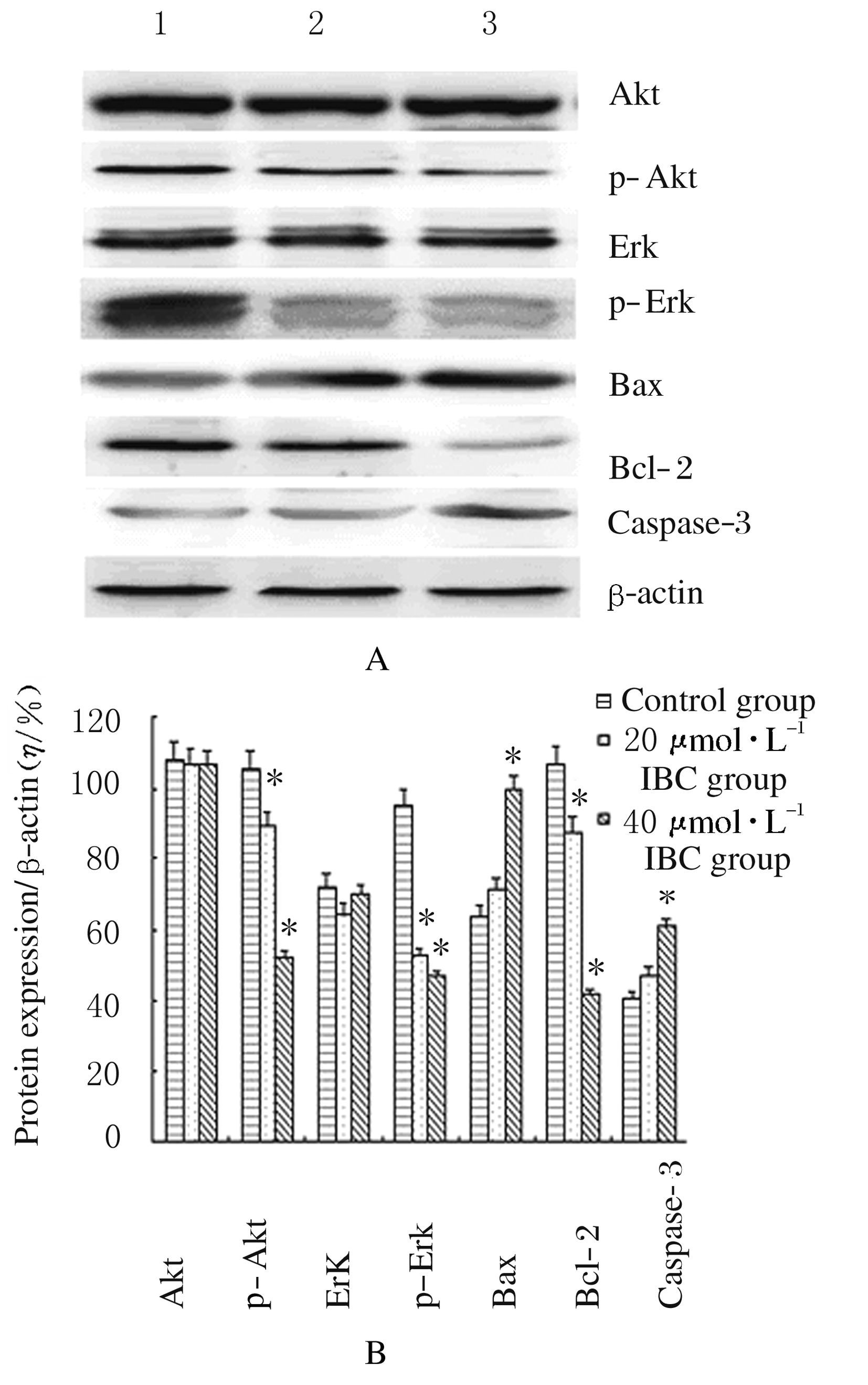
|
| Lane 1:Control group;Lane 2:20 μmol·L-1 IBC group;Lane 3:40 μmol·L-1 IBC group.*P<0.05 vs control group 图3 各组Tca8113细胞中Akt、p-Akt、Erk、p-Erk、Bax、Bcl-2和Caspase-3蛋白表达电泳图(A)和蛋白表达水平直条图(B) Fig.3 Electrophoregram(A) and histogram (B) of expression levels of Akt,Erk,Bax,Bcl-2,and Caspase-3 proteins in Tca8113 cells in various groups |
为了观察IBC不同作用时间对Tca8113细胞中蛋白表达的影响,40 μmol·L-1 IBC作用Tca8113细胞12、24和48h结果显示:与对照组比较,IBC作用48h时p-Akt和p-Erk蛋白表达水平明显降低(P<0.05),Akt和Erk蛋白表达水平无明显变化(P<0.05)。见图4。

|
| Lane 1:Control group;Lane 2-4:12,24,and 48 h.*P<0.05 vs control group. 图4 不同作用时间各组Tca8113细胞中Akt、p-Akt、Erk和p-Erk 蛋白表达电泳图(A)和蛋白表达水平直条图(B) Fig.4 Electrophoregram(A) and histogram (B) of expression levels of Akt,p-Akt,Erk,and p-Erk proteins in Tca8113 cells in various groups at different time |
TSCC的主要治疗手段是手术治疗。但过度的手术切除会严重影响TSCC患者的口腔功能,从而明显降低患者术后生活质量。化疗在TSCC的综合治疗中具有重要的意义,但由于其具有肝肾毒性、抑制造血系统和破坏机体免疫力等毒副作用,使得其在临床应用方面受到了一定程度的限制[6]。寻找治疗TSCC的新方法以及新的高效的抗肿瘤药物,成为现代医学特别是临床医学中非常重要的研究课题。
传统中药主要是天然的动植物和矿物质,其具有毒副作用小、来源经济等特点,成为目前研究的热点。现代医学研究显示:中药提取物可有效促进多种肿瘤细胞凋亡。补骨脂隶属被子植物门、双子叶植物纲、豆科,具有温肾、助阳等功效。既往研究[7]显示:从补骨脂中提取的多种有效成分均可以通过不同的机制发挥抗癌作用。IBC是从补骨脂中提取的一种活性成分,其药物特性包括抗细菌、抗真菌和抗氧化等作用[8]。近期研究[3, 4, 9, 10]已证实:IBC可以在不杀伤正常细胞的前提下,抑制多种肿瘤细胞(OVCAR-8、PC3、A549和MCF-7)的增殖并诱导其凋亡。
本实验通过体外培养TSCC的Tca8113细胞,采用MTT和流式细胞术观察IBC对其细胞增殖及凋亡影响的MTT结果显示:IBC有明显的抑制Tca8113细胞增殖的作用,且有明显的时间-浓度依赖性;20和40 μmol·L-1 IBC作用Tca8113细胞48h后,早期细胞凋亡率分别为8.21%±2.32%和22.45%±1.18%,与对照组比较差异有统计学意义。本研究结果表明:IBC呈时间-浓度依赖性抑制Tca8113细胞的增殖,促进细胞凋亡。
Bcl-2基因家族作为一组重要的凋亡相关基因已经得到人们的广泛认可。Bcl-2基因和Bax基因为Bcl-2基因家族中重要的抗凋亡基因和促凋亡基因[11]。Bcl-2蛋白在正常组织中低表达,而在肿瘤细胞中表达异常增高。肿瘤的预后与Bcl-2基因表达水平有很大关系。Zhang等[12]通过免疫组织化学法观察Bcl-2蛋白在TSCC组织中表达的结果表明:Bcl-2蛋白在TSCC组织中高表达,与癌旁组织中Bcl-2蛋白表达量比较差异有统计学意义。Bcl-2的高表达也与舌癌细胞铂类药物耐药高度相关。Bcl-2蛋白的过度表达不但能够抑制生长因子缺乏引起的细胞凋亡,也能够抑制化疗和放疗等原因引起的细胞凋亡[13]。因此,本文作者认为:如果能够降低Bcl-2基因在舌癌组织中的表达,那么或许能够在诱导肿瘤凋亡的同时,还能解决肿瘤细胞的耐药性和放射敏感性差等问题,从而提高化疗和放疗对TSCC的疗效,为临床提供更多的可供选择的治疗TSCC的方法。本实验通过Western blotting法观察不同浓度IBC作用Tca8113细胞48h后Bcl- 2和Bax蛋白表达变化的结果显示:随着IBC作用浓度的增加,Bcl-2蛋白表达水平明显降低,而Bax蛋白表达水平随着药物浓度的增加明显升高,Bcl-2/Bax比值分别为1.23和0.42。
丝氨酸/苏氨酸 (serine/threonine,Ser/Thr)蛋白激酶Akt作为PI3K/Akt信号转导通路的重要靶点,在多种恶性肿瘤(如舌癌、胃癌、宫颈癌)中均异常活化[14]。Akt能磷酸化并调控许多与细胞代谢、凋亡、增殖和分化有关的蛋白,进而抑制肿瘤细胞的凋亡并促进肿瘤细胞的生长[15, 16]。通过调节Akt蛋白的表达可调整细胞增殖与凋亡之间的平衡,从而达到抑制肿瘤生长的目的。此外,p-Akt可将Bad 蛋白磷酸化,失去与Bcl-XL 蛋白结合的能力,从而恢复Bcl-2蛋白的抗凋亡能力。Erk是一类特殊的细胞信号传导蛋白,其功能是把信号从细胞表面传导到细胞核内部。已在包括TSCC在内的众多肿瘤中发现Erk信号通路的异常明显活化,其异常活化对肿瘤的发生发展具有重要意义。本课题组在既往研究中已证实:IBC可呈剂量依赖性抑制胃癌MGC803细胞的Akt和Ekr通路的活化。本实验也得出相似的结论:Tca8113细胞内源性的表达磷酸化Akt和Erk,这表明p-Akt和p-Erk为Tca8113细胞组成性的激活突变基因。在不同处理浓度或不同处理时间的条件下,IBC均可以抑制p-Akt和p-Erk蛋白的表达,表明IBC可能通过抑制Akt 和Erk通路促进TSCC细胞凋亡。
本研究结果显示:IBC呈时间-浓度依赖性抑制 Tca8113 细胞增殖,诱导细胞凋亡,从而发挥抗肿瘤作用。此外,IBC能够下调细胞凋亡相关蛋白 Bcl-2 的表达,上调Bax蛋白的表达,并且呈时间-剂量依赖性下调p-Akt和p-Erk蛋白的表达,这可能是其促肿瘤细胞凋亡的机制之一。另外,本研究中Bcl-2 蛋白表达水平的降低使IBC有可能作为TSCC的放、化疗增敏剂应用于临床。本研究为临床应用IBC治疗TSCC及其他恶性肿瘤提供了实验依据。
| [1] | Clump DA,Bauman JE,Ferris RL. Cancer of the oropharynx [J].Surg Oncol Clin N Am,2015,24(3):509-520. |
| [2] | Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015 [J]. CA Cancer J Clin,2016,66(2):115-132. |
| [3] | Nishimura R,Tabata K,Arakawa M,et al. Isobavachalcone,a chalcone constituent of Angelica keiskei,induces apoptosis in neuroblastoma [J]. Biol Pharm Bull,2007,30(10):1878-1883. |
| [4] | Jing H,Zhou X,Dong X,et al. Abrogation of Akt signaling by Isobavachalcone contributes to its anti-proliferative effects towards human cancer cells [J]. Cancer Lett,2010,294(2):167-177. |
| [5] | Kuete V,Mbaveng AT,Zeino M,et al. Cytotoxicity of three naturally occurring flavonoid derived compounds (artocarpesin,cycloartocarpesin and isobavachalcone) towards multi-factorial drug-resistant cancer cells [J]. Phytomedicine,2015,22(12):1096-1102. |
| [6] | Funk GF,Karnell LH,Robinson RA,et al. Presentation,treatment,and outcome of oral cavity cancer a National Cancer Data Base report [J]. Head Neck,2002,24(2):165-180. |
| [7] | Akihisa T,Tokuda H,Hasegawa D,et al. Chalcones and other compounds from the exudates of Angelica keiskei and their cancer chemopreventive effects [J]. J Nat Prod,2006,69(1):38-42. |
| [8] | Nowakowska Z. A review of anti-infective and anti-inflammatory chalcones [J]. Eur J Med Chem,2007,42(2):125-137. |
| [9] | Szliszka E,Jaworska D,Ksek M,et al. Targeting death receptor TRAIL-R2 by chalcones for TRAIL-induced apoptosis in cancer cells [J]. Int J Mol Sci,2012,13(11):15343-15359. |
| [10] | Szliszka E,Czuba ZP,Mazur B,et al. Chalcones enhance TRAIL-induced apoptosis in prostate cancer cells [J]. Int J Mol Sci,2009,11(1):1-13. |
| [11] | Adams JM,Cory S. The Bcl-2 Protein family:arbiters of cell survival [J]. Science,1998,281(5381):1309-1312. |
| [12] | Zhang B,Liu M,Tang HK,et al. The expression and significance of MRP1,LRP,TOPOⅡβ,and BCL2 in tongue squamous cell carcinoma [J]. J Oral Pathol Med,2012,41(2):141-148. |
| [13] | Meterissian SH,Kontogiannea M,Po J,et al. Apoptosis induced in human colorectal carcinoma by anti-Fas antibody [J]. Ann Surg Oncol,1997,4(2):169-175. |
| [14] | Dent P. Crosstalk between ERK,AKT and cell survival [J]. Cancer Biol Ther,2014,15(3):245-246. |
| [15] | Briest F,Grabowski P.PI3K-AKT-mTOR signaling and beyond:the complex network in gastroenteropancreatic neuroendocrine neoplasms [J]. Theranostics,2014,4(4):336-365. |
| [16] | Polivka J Jr,Janku F. Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway [J]. Pharmacol Ther,2014,142(2):164-175. |
 2016, Vol. 42
2016, Vol. 42


