扩展功能
文章信息
- 徐召南, 毕也, 王溪, 张泽兵, 王舒煜, 姜斯文, 贾杰
- XU Zhaonan, BI Ye, WANG Xi, ZHANG Zebing, WANG Shuyu, JIANG Siwen, JIA Jie
- 吉林大学学报(医学版), 2016, 42(04): 716-720
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 716-720
- 10.13481/j.1671-587x.20160416
-
文章历史
- 收稿日期: 2016-01-24
2. 吉林大学口腔医院吉林省牙发育及颌骨重塑与再生 重点实验室, 吉林 长春 130021;
3. 吉林大学第二医院放疗科, 吉林 长春130041;
4. 吉林大学中日联谊医院电诊科, 吉林 长春 130033
2. Jinlin Provincial Key Laboratory of Tooth Development and Bone Remodeling, Jilin University, Changchun 130021, China;
3. Department of Radiotherapy, Second Hospital, Jilin University, Changchun 130041, China;
4. Department of Electrical Diagnosis, China-Japan Union Hospital, Jilin University, Changchun 130033, China
口腔鳞状细胞癌是头颈部常见的恶性肿瘤,主要采用以手术为主的综合治疗[1],其中放射治疗是口腔癌综合治疗的重要手段。在临床实践过程中,肿瘤细胞对射线产生的抗性使治疗效果不佳,因此增加肿瘤细胞放疗敏感性、减少放疗抵抗是国内外研究的热点。自噬是通过降解细胞内细胞器和长寿命蛋白来实现氨基酸重复利用和能量循环的一种高度保守的细胞程序[2]。肿瘤细胞对放射治疗的抗性与自噬现象存在密切关联。自噬可在应激条件下,清除细胞质内受损的细胞器,回收代谢物质,降低活性氧簇的伤害,修复受损的DNA,保护细胞,促进肿瘤细胞在逆境中的存活,被认为是肿瘤细胞耐受放疗的一种机制。本研究利用自噬抑制剂氯喹(chloroquine,CQ)和3-甲基腺嘌呤(3-methyladenine,3-MA)联合放射治疗作用于口腔鳞状细胞癌CAL-27及KB细胞,通过观察细胞的生存率、凋亡率以及自噬相关蛋白的表达,探讨自噬在口腔鳞状细胞癌放射治疗中的作用。
1 材料与方法 1.1 细胞、主要试剂和仪器口腔鳞状细胞癌 CAL-27 细胞株由上海交通大学口腔医学院陈万涛教授惠赠,人口腔上皮癌KB细胞株由吉林大学口腔医院孙宏晨教授惠赠。H-DMEM 培养基粉剂、RPMI-1640培养基粉、牛血清白蛋白(BSA)和胎牛血清(美国Gibco 公司),青霉素-链霉素(奥地利PAA 公司),4-羟乙基哌嗪乙磺酸(HEPES)、3-MA和二甲基亚砜 ( DMSO )(美国Sigma 公司),CQ(中国食品药品检定研究所),噻唑蓝(MTT)和 FITC标记的山羊抗兔二抗(北京中杉金桥公司),MAP1-LC3 兔多克隆抗体 (美国Santa Cruz公司),AnnexinV-FITC/PI 试剂盒(南京凯基生物有限公司)。放射治疗仪器:Varian2300EX、Varian模拟定位机和CT-Sim三维模拟定位系统(吉林大学第二医院提供)。
1.2 细胞培养和实验分组口腔鳞状细胞癌CAL-27 细胞在含 10%胎牛血清的 H-DMEM 培养基(含 100 U·mL-1 青霉素和 100 mg·L-1链霉素)中,口腔鳞状细胞癌KB细胞在含 10%胎牛血清的RPMI-1640培养基(含 100 U·mL-1青霉素和 100 mg·L-1链霉素)中,置于 37℃ 、 5%CO2 、 95% 相对湿度的培养箱中培养。 每2d换液传代 1 次,使细胞保持对数生长状态,取生长状态良好的对数生长期细胞用于实验。实验分组:1对照组。CAL-27和KB细胞不做任何处理。2CQ组。5mg·L-1CQ与细胞进行12h共培养。33-MA组。10 mg·L-13-MA与细胞进行12h共培养。4放射组(IR组)。每次6 Gy剂量X线照射,照射3 h后检测。5联合放射组。CQ+ IR组,细胞经5 mg·L-1CQ处理12 h后进行6 Gy剂量X线照射,3 h后检测;3-MA+IR组,细胞经10 mg·L-13-MA处理12 h后进行6Gy剂量X线照射,3 h后进行检测。
1.3 细胞生存率检测将处于对数生长期的CAL-27和KB细胞分别接种于 96 孔细胞培养板内(细胞密度为每孔 1×104个细胞),每孔加入 200 μL细胞悬液,置于 37℃、5% CO2孵箱中培养 24 h 后将上清液吸走弃掉后,按照上述实验分组方式分别对CAL-27细胞及KB细胞进行处理。设置不加 MTT 孔为空白调零组,每组设6个复孔。 处理后每孔加入20 μL MTT 液( 5 g·L-1 ,调零孔除外) ,继续培养 4 h 后弃去孔内液体,加入 150 μL DMSO ,振荡 10 min ,于酶标仪492 nm波长处测定各孔吸光度(A)值,根据公式计算细胞生存率。细胞生存率=实验组A值/对照组A值×100%。实验重复 3 次。
1.4 免疫荧光法检测CAL-27细胞中LC3-Ⅱ蛋白 免疫荧光强度取对数生长期的 CAL-27 细胞,调整细胞浓度为2×104 mL-1,接种于盖玻片经多聚赖氨酸处理6孔板内,培养24 h。按上述实验分组处理后,收获细胞,用4℃丙酮固定15 min,PBS溶液冲洗2次,每次5 min,1%BSA封闭液封闭细胞30 min,兔抗人MAP1-LC3-Ⅱ多克隆抗体(1∶200)孵育4℃过夜;次日,PBS溶液冲洗2次,每次5min ,FITC山羊抗兔IgG 二抗避光孵育,37℃、1h;PBS溶液冲洗2次,每次5min,PI核染色2min,封片;激光共聚焦显微镜下观察、摄片。采用FVViewer1.7软件分析LC3-Ⅱ蛋白免疫荧光强度,以该荧光强度表示自噬水平。
1.5 Western blotting法检测CAL-27细胞中LC3和beclin-1蛋白表达水平取接种于6孔板中的CAL-27细胞,按上述实验分组进行药物及照射处理后,冷PBS洗2次,加入细胞裂解液于4℃裂解20 min,12000 r·min-1离心20 min,收集上清,提取细胞总蛋白,BCA法测蛋白浓度。取20g样品煮沸变形后进行Tricine-SDS-PAGE电泳,转膜,5%脱脂奶粉37℃封闭2h,一抗4℃孵育过夜,洗膜,二抗37℃孵育1 h,ECL法显影,分析条带灰度值,以目的条带与β-actin条带灰度值比值表示蛋白相对表达水平。
1.6 AnnexinV-FITC流式细胞术检测KB细胞凋亡率取生长状况良好的对数生长期KB细胞,接种于6孔板内,培养24 h后每孔加入2 mL溶液,每组设3个复孔,按照上述分组进行加药或照射处理。收获细胞后PBS溶液洗2次,调整细胞密度为5×105 ~1×106mL-1,取1 mL细胞悬液4℃、1000 r·min-1离心5 min,弃上清。加入500 μL的binding buffer悬浮细胞,并混匀。各组细胞中分别依次加入5 μL AnnexinV-FITC和5 μLPI溶液,室温避光处理。15 min后采用流式细胞仪检测,激发波长为488nm,发射波长为530nm。检测AnnexinV/PI阳性细胞所占百分率,即为细胞凋亡率。
1.7 统计学分析采用SPSS17.0统计软件进行统计学分析。细胞生存率、
LC3-Ⅱ蛋白荧光强度及和细胞凋亡率以 ±s表示,LC3和beclin-1蛋白表达水平以平均值(
±s表示,LC3和beclin-1蛋白表达水平以平均值( )表示,组间比较采用单因素方差分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
)表示,组间比较采用单因素方差分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
口腔鳞状细胞癌CAL-27和KB 2种细胞中,IR组、CQ+IR组和3-MA+IR组细胞生存率低于对照组(P<0.01),表明放射疗法能有效抑制CAL-27和KB细胞的增殖。与IR组比较,CQ+IR组和3-MA+IR组细胞生存率明显降低(P<0.05)。见表1。
(n=3, ±s,η/%) ±s,η/%) | ||
| Group | Survival rate | |
| CAL-27 | KB | |
| Control | 100.00±2.20 | 100.00±0.80 |
| CQ | 96.97±1.70 | 98.13±2.20 |
| 3-MA | 95.82±1.40 | 97.44±1.80 |
| IR | 76.89±1.30 * | 81.37±1.60* |
| CQ+IR | 75.15±3.20*△ | 75.91±0.30*△ |
| 3-MA+IR | 63.36±4.20*△ | 67.12±0.60*△ |
| *P<0.01 compared with control group;△P<0.05 compared with IR group. | ||
经绿色荧光FITC标记的自噬特异性蛋白LC3-Ⅱ和红色荧光PI标记DNA,通过激光共聚焦显微镜观察自噬水平。在IR组中,LC3-Ⅱ绿色荧光呈点状散在分布于细胞质内,表明照射能够诱导CAL-27细胞发生自噬。CQ+IR 组及3-MA+IR 组细胞中LC3-Ⅱ荧光强度降低。利用FV Viewer 1.7软件分析荧光强度结果:CQ组细胞荧光强度为204.18±15.77,3-MA组为188.24±19.24,对照组为295.83±30.65,IR组为366.23±16.83,CQ+IR组为326.35±17.47,3-MA+IR组为318.59±20.35,IR组细胞荧光强度高于其他各组,差异均有统计学意义(P<0.05)。见图1(插页三)。
2.3 Western blotting法检测各组CAL-27细胞中LC3和beclin-1蛋白表达水平利用Image Pro Plus进行蛋白灰度分析。在CAL-27细胞中,与对照组(2524.224)比较,IR组LC3蛋白的表达水平(3 536.891)明显升高(P<0.05),3-MA+IR组和CQ+IR组LC3蛋白表达水平(574.335和1 365.113)明显降低 (P<0.05)。与对照组(7 735.933)比较,IR组beclin-1蛋白表达水平(8 265.983)明显升高(P<0.05),3-MA+IR组和CQ+IR组beclin-1蛋白表达水平(1 480.648和4 747.305)明显降低 (P<0.05)。见图2。

|
| Lane 1:Control group;Lane 2:CQ group;Lane 3:3-MA group;Lane 4:IR group;Lane 5:CQ+IR group;Lane 6:3-MA+IR group. 图2 Western blotting法检测 CAL-27细胞中LC3(A)和beclin-1(B)蛋白表达电泳图 Fig.2 Electrophoregram of expressions of LC3(A) and beclin-1(B) proteins in CAL- 27 cells detected by Western blotting method |
与对照组(6.32%±0.45%)比较,CQ组细胞凋亡率(9.24%±0.78%)升高,3-MA组细胞凋亡率(4.79%±2.88%)稍有降低,但差异均无统计学意义(P>0.05);而IR组(16.78%±2.96%)、3-MA+IR组(21.04%±3.11%)和CQ+IR组(21.43%±3.52%)细胞凋亡率均明显升高,差异有统计学意义(P<0.05)。与IR组比较,3-MA+IR组和CQ+IR组细胞凋亡率明显升高,差异有统计学意义(P<0.05)。见图3 。
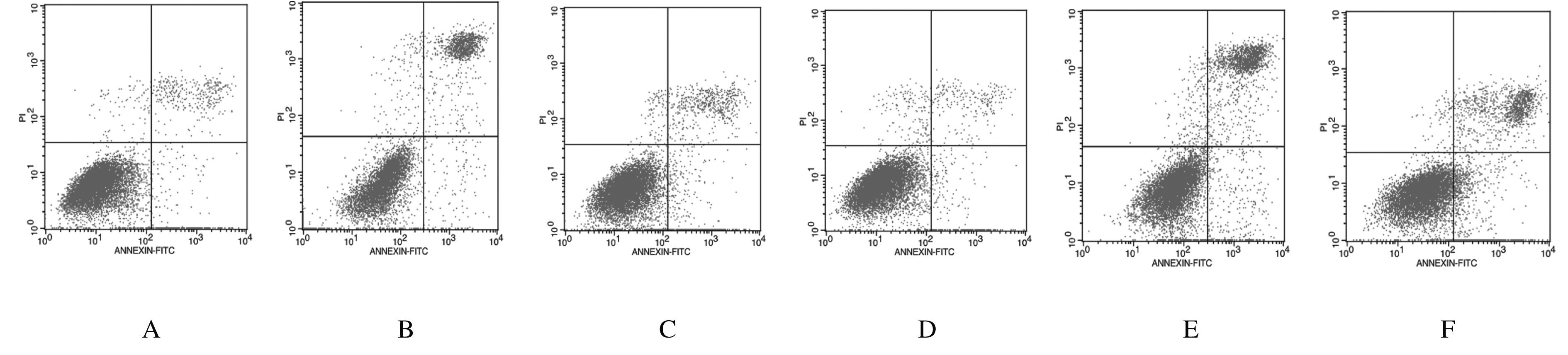
|
| A:Control group;B:IR group;C:CQ group; D:3-MA group;E:CQ+IR group;F:3-MA+IR group. 图3 流式细胞术检测各组KB细胞凋亡率 Fig.3 Apoptotic rates of KB cells in various groups detected by flow cytometry |
口腔鳞状细胞癌治疗采取以手术治疗为主,辅以放射治疗和化疗的综合序列治疗策略。虽然口腔癌的治疗得到改进,但口腔癌患者5年生存率无明显提高[3]。在放射线诱导肿瘤细胞凋亡过程中,常出现肿瘤细胞放射抵抗,影响口腔癌放射治疗效果。研究[4, 5] 显示:放射线可诱导乳腺癌细胞和肝癌细胞自噬活性增高并导致放射抵抗。对 Bax/Bak 基因敲除的乳腺癌 MEF 细胞,放射线可导致自噬相关基因(autophagy-related gene,ATG)ATG5、ATG12和beclin-1 等表达增强[6],放射线诱导自噬活性增加,表明放射诱导的肿瘤细胞自噬活性增加可能是导致肿瘤细胞放射抵抗的原因之一[7, 8]。自噬不仅与肿瘤发生发展有关,自噬活性的改变也存在于多种肿瘤治疗过程中,如肺癌、结肠癌和食管癌治疗等[9, 10, 11]。自噬在肿瘤发生发展中具有促进和抑制双重作用[12],在肿瘤形成早期,自噬通过维持细胞染色体的稳定性和诱导自噬性细胞死亡从而抑制肿瘤发生;当肿瘤进展时,肿瘤细胞通过自噬抵抗乏氧、饥饿等恶劣环境得以生存[13, 14]。最近研究[12]显示:一个高自噬活性的细胞群在肿瘤中持续存在,如乏氧细胞、干细胞等,这些细胞生命力顽强,可能是导致肿瘤放射抵抗的原因之一。适当的调控自噬,抑制自噬性生存,促进自噬性死亡可以增强抗肿瘤治疗的细胞毒性,改善肿瘤细胞放射抵抗。
本研究通过激光共聚焦显微镜观察LC3-Ⅱ蛋白表达情况,应用Western blotting法检测beclin-1和LC3蛋白表达水平结果显示:在CAL-27细胞中,IR组细胞自噬相关蛋白LC3-Ⅱ荧光强度明显高于其余各组,表明照射可以诱导CAL-27细胞产生自噬;而应用自噬抑制剂CQ和3-MA预处理后进行照射的CQ + IR及3-MA + IR组中,LC3-Ⅱ荧光强度降低;与IR组比较,联合放射组细胞生存率明显降低,细胞凋亡率明显提高。本研究结果表明:应用CQ和3-MA抑制口腔癌细胞基础自噬水平,可增强照射对口腔癌细胞的生长抑制作用及杀伤作用。相关研究[15, 16]也证明:下调细胞的自噬水平,能增加肿瘤细胞对放射治疗和/(或)化疗的敏感性,促进细胞凋亡和坏死。
综上所述,口腔鳞状细胞癌细胞本身的自噬可能是肿瘤细胞放疗抵抗的重要机制,下调基础自噬水平有望提高肿瘤细胞对放疗的敏感性,对提高口腔鳞状细胞癌放射治疗效果有重要临床意义。
| [1] | Vikulova Iu.The state-of-the-art of the diagnosis of oral and oropharyngeal cancer[J]. Vestn Rentgenol Radiol,2012,5(3):51-54. |
| [2] | Todde V,Veenhuis M,van der Klei IJ. Autophagy:principles and significance in health and disease [J]. Biochim Biophys Acta,2009,1792(1):3-13. |
| [3] | 李金忠,李 鑫,郑家伟. 早期口腔癌检查及诊断方法的研究进展[J]. 中国口腔颌面外科杂志,2012,10(6):516-521. |
| [4] | Bristol ML,Di X,Beckman MJ,et al. Dual functions of autophagy in the response of breast tumor cells to radiation:cytoprotective autophagy with radiation alone and cytotoxic autophagy in radiosensitization by vitamin D3 [J]. Autophagy,2012,8(5):739-753. |
| [5] | Tseng HC,Liu WS,Tyan YS,et al. Sensitizing effect of 3-methyladenine on radiation-induced cytotoxicity in radio-resistant HepG2 cells in vitro and in tumor xenografts [J]. Chem Biol Interact,2011,192(3):201-208. |
| [6] | Moretti L,Attia A,Kim KW,et al. Crosstalk between Bak/Bax and mTOR signaling regulates radiation-induced autophagy [J]. Autophagy,2007,3(2):142-144. |
| [7] | Apel A,Herr I,Schwarz H,et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy [J]. Cancer Res,2008,68(5):1485-1494. |
| [8] | Phadwal K,Alegre-Abarrategui J,Watson AS,et al. A novel method for autophagy detection in primary cells:impaired levels of macroautophagy in immunosenescent T cells [J]. Autophagy,2012,8(4):677-689. |
| [9] | Kim KW,Moretti L,Lu B. M867,a novel selective inhibitor of caspase-3 enhances cell death and extends tumor growth delay in irradiated lung cancer models [J]. PLoS One,2008,3(5):e2275. |
| [10] | Schonewolf CA,Mehta M,Schiff D,et al. Autophagy inhibition by chloroquine sensitizes HT-29 colorectal cancer cells to concurrent chemoradiation [J]. World J Gastrointest Oncol,2014,6(3):74-82. |
| [11] | Chen YS,Song HX,Lu Y,et al. Autophagy inhibition contributes to radiation sensitization of esophageal squamous carcinoma cells[J]. Dis Esophagus, 2011, 24(6):437-443. |
| [12] | Gewirtz DA. An autophagic switch in the response of tumor cells to radiation and chemotherapy[J]. Biochem Pharmacol,2014,90(3):208-211. |
| [13] | Gewirtz DA. The four faces of autophagy:implications for cancer therapy [J]. Cancer Res,2014,74(3):647-651. |
| [14] | Hönscheid P,Datta K,Muders MH. Autophagy:detection,regulation and its role in cancer and therapy response [J]. Int J Radiat Biol,2014,90(8):628-635. |
| [15] | McAfee Q,Zhang Z,Samanta A,et al. Autophagy inhibitor Lys05 has single-agent antitumor activity and reproduces the phenotype of a genetic autophagy deficiency [J]. Proc Natl Acad Sci U S A,2012,109(21):8253-8258. |
| [16] | Chen Y,Li X,Guo L,et al. Combining radiation with autophagy inhibition enhances suppression of tumor growth and angiogenesis in esophageal cancer [J]. Mol Med Rep,2015,12(2):1645-1652. |
 2016, Vol. 42
2016, Vol. 42


