扩展功能
文章信息
- 陈雪, 张玉影, 邵玉, 张璐妮, 宁明杰, 唐英, 齐玲, 李蕴潜
- CHEN Xue, ZHANG Yuying, SHAO Yu, ZHANG Luni, NING Mingjie, TANG Ying, QI Ling, LI Yunqian
- 吉林大学学报(医学版), 2016, 42(04): 711-715
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 711-715
- 10.13481/j.1671-587x.20160415
-
文章历史
- 收稿日期: 2015-10-14
2. 吉林医药学院病理教研室, 吉林 吉林 132013;
3. 吉林大学第一医院神经外科, 吉林 长春 130021
2. Department of Pathology, Jilin Medical University, Jilin 132013, China;
3. Department of Neurosurgery, First Hospital, Jilin University, Changchun 130021, China
五味子是木兰科植物五味子或华中五味子的干燥成熟果实,含有五味子甲素等木脂素类化合物。五味子具有补肾涩精、收敛止泻的功效[1],故为著名的滋补性中药。脑胶质瘤为中枢神经系统中最常见的原发性肿瘤,其恶性程度高[2]。胶质瘤常呈浸润性生长,边界不清,故手术难以根除,且具有发病率、复发率、死亡率高和治愈率低的特点,目前仍缺乏满意的治疗手段。本课题组前期研究[3]显示:五味子提取物可以抑制胶质瘤的生长,而五味子甲素是否有抗胶质瘤作用国内外尚未见相关报道。本文作者通过研究五味子甲素对体外培养大鼠脑胶质瘤C6细胞生长的影响,旨在探讨五味子甲素对脑胶质瘤细胞生长的作用及其机制。
1 材料与方法 1.1 主要试剂和仪器RPMI-1640培养液(美国Hyclone公司),0.25%胰酶和小牛血清(美国Gibco公司),二甲基亚枫(DMSO)和噻唑蓝(MTT)(美国Sigma公司),Bax、Bcl-2、Caspase-3和CyclinD1抗体(北京中杉公司)。CB150型CO2培养箱(德国Binder公司),J-26XP型超低温高速离心机(美国贝克曼公司),PLUS 384型全自动酶标仪(美国MDC公司),IX-70型倒置式显微镜(日本Olympus公司)。
1.2 细胞分组与处理取生长状态良好的脑胶质瘤C6细胞(由吉林医药学院科研实验室提供)制成单细胞悬液,按8×103个细胞密度将其接种于96孔细胞培养板中,置于37℃、5% CO2及饱和湿度条件下培养过夜。分别于24、48和72 h 弃去上清液,加入200 μL不同浓度( 0、50、100和200 mg·L-1)的五味子甲素,进行MTT检测。再将1×107个细胞接种于25 cm2培养瓶中,分别用不同浓度( 0、50、100和200 mg·L-1)五味子甲素作用24 h,用于流式细胞术检测和酶联免疫吸附实验(ELISA)。每组设5个复孔,0 mg·L-1 五味子甲素组为对照组。
1.3 MTT法检测C6细胞增殖率各组细胞培养24、48和72 h,实验终止前每孔加入20 μL MTT并继续孵育4 h,弃去上清液后,每孔分别加入150 μL DMSO,振荡10 min后于全自动酶标仪上测定各孔490 nm处的吸光度(A)值,细胞增殖率=药物组A值/对照组A值×100%。
1.4 流式细胞术测定细胞周期百分率磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤及重悬各组细胞,台盼兰计数活细胞,80%冷甲醇-20℃固定过夜。次日1000r·min-1离心5 min,PBS再次洗涤细胞,调整细胞密度1×107mL-1,取100 μL细胞悬液至流式管内,加入PI溶液400 μL,混匀后避光孵育30 min,300目尼龙筛网过滤。用流式细胞仪检测细胞周期百分率,WinMDI软件分析结果。
1.5 C6细胞中Bax、Bcl-2、Caspase-3和CyclinD1蛋白表达水平取细胞培养上清,将上清液与包被液按1∶1的比例包被后4℃过夜封闭,然后分别加入一抗Bax、Caspase-3、Bcl-2和CyclinD1(1∶1000稀释)于4℃过夜。加入二抗(1∶1000稀释)室温下孵育2h,加显色液室温避光显色后于自动酶标仪492 nm处测定A值,根据标准曲线计算蛋白表达水平。
1.6 统计学分析采用SPSS 17.0 统计软件进行统计学分析。细胞增殖率、细胞周期百分率和C6细胞培养上清中Bax、Bcl-2、Caspase-3和CyclinD1蛋白表达水平均以 ±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
50、100和200 mg·L-1五味子甲素作用于C6细胞24和48h时,细胞增殖率均明显降低,与对照组比较差异均有统计学意义(P<0.01)。50、100和200 mg·L-1五味子甲素作用于C6细胞72 h时,细胞增殖率亦明显降低,与对照组比较,100和200 mg·L-1五味子甲素组差异均有统计学意义(P<0.05或P<0.01)。不同浓度五味子甲素作用于胶质瘤C6细胞24 h时对细胞增殖的抑制作用最明显(IC50=249.33 mg·L-1),因此后续实验均采用这一时间点。见图1。
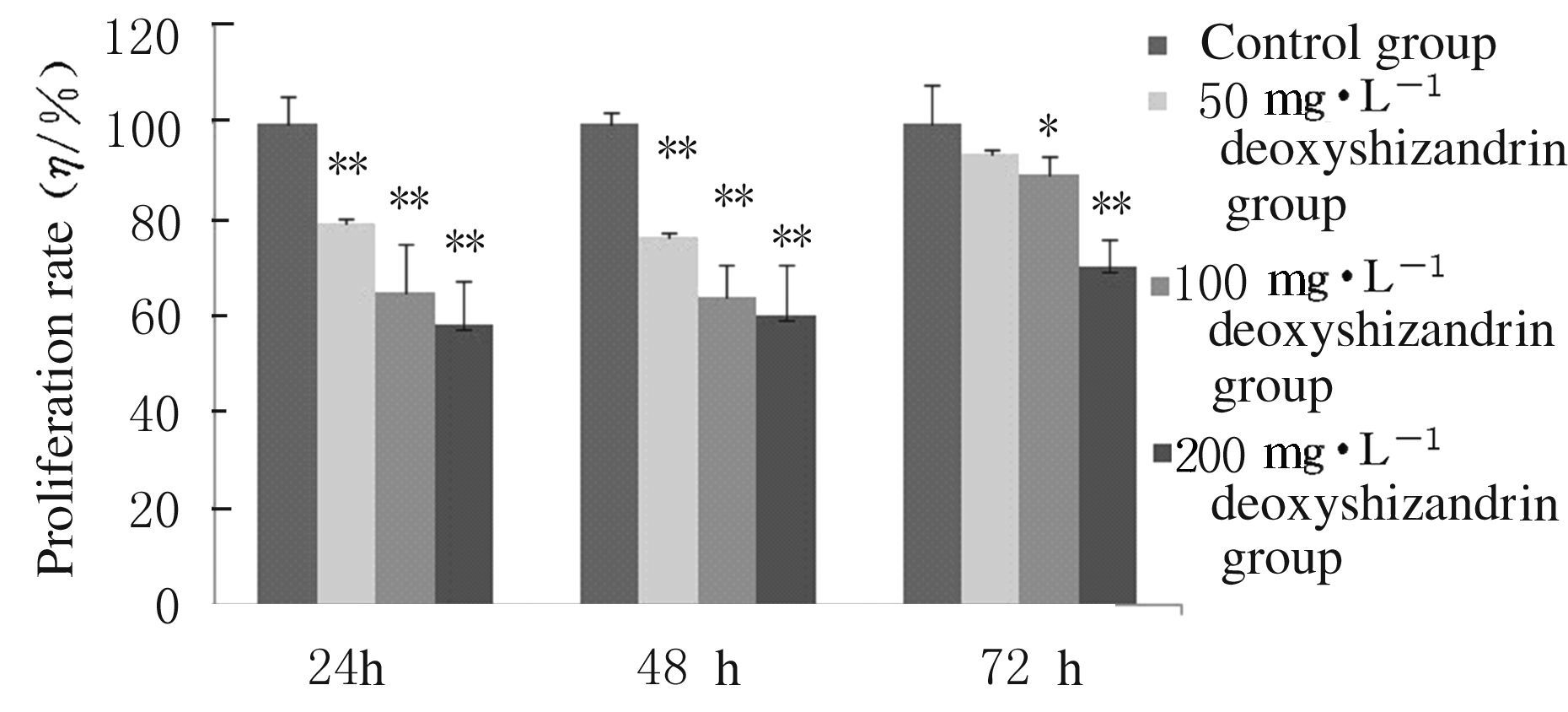
|
| * P<0.05,** P<0.01 vs control group. 图1 五味子甲素作用不同时间后各组C6细胞增殖率 Fig.1 Proliferation rates of C6 cellsafter treated with deoxyschizandrin for different time |
50、100和200mg·L-1五味子甲素作用C6细胞后,SubG1期细胞百分率随着药物浓度升高呈上升趋势,与对照组比较,200 mg·L-1五味子甲素组差异有统计学意义(P<0.05)。G0/G1期细胞百分率也随着五味子甲素浓度的增加呈升高趋势,但与对照组比较差异无统计学意义(P>0.05)。[CM(22]而S期和G2/M期细胞百分率则随着五味子甲素[CM)][LL]作用浓度的升高呈下降趋势,与对照组比较,200 mg·L-1五味子甲素组S期细胞百分率差异有统计学意义(P<0.05)。见表1和图2。
(n=3, ±s,η/%) ±s,η/%) | |||||
| Group | Dose(mg·L-1) | Percentage of C6 cells | |||
| G2/M | SubG1 | G0/G1 | S | ||
| Control | 0 | 1.03±0.12 | 65.23±1.55 | 22.11±1.03 | 11.63±3.32 |
| Deoxyschizandrin | |||||
| 50 | 6.98±0.38 | 66.85±2.37 | 15.38±2.86 | 10.79±1.58 | |
| 100 | 7.80±0.78 | 68.66±3.53 | 14.25±4.54 | 9.29±0.39 | |
| 200 | 12.74±1.25* | 69.50±3.18 | 11.40±2.12* | 6.36±1.21 | |
| *P<0.05 vs control group | |||||

|
| 图2 五味子甲素作用后各组C6细胞的流式细胞图 Fig.2 Flow cytometry diagram of C6 cells in various groups after treated with deoxyschizandrin |
随着药物浓度的升高,肿瘤细胞Bax蛋白表达水平明显升高,与对照组比较,不同浓度五味子甲素组差异均有统计学意义(P<0.05 或P<0.01);Bcl-2蛋白表达水平呈下降趋势,与对照组比较,200 mg·L-1五味子甲素组差异有统计学意义(P<0.01);随着药物浓度升高,Bax/Bcl-2比值升高,与对照组比较,差异有统计学意义(P<0.01)。不同浓度五味子甲素组Caspase-3蛋白表达水平升高,与对照组比较,200 mg·L-1五味子甲素组差异有统计学意义(P<0.01);CyclinD1蛋白表达水平呈下降趋势,与对照组比较,100和200mg·L-1五味子甲素组差异均有统计学意义(P<0.01)。见表2。
(n=3, ±s) ±s) | ||||||
| Group | Dose(mg·L-1) | Bax | Bcl-2 | Bax/Bcl-2 | Caspase-3 | CyclinD1 |
| Control | 0 | 0.71±0.06 | 2.34±0.10 | 0.31±0.06 | 1.60±0.48 | 2.12±0.08[BHDW |
| Deoxyschizandrin | ||||||
| 50 | 1.26±0.04* | 2.20±0.02 | 0.57±1.28** | 1.73±0.49 | 1.74±0.10 | |
| 100 | 1.41±0.09** | 2.18±0.26 | 0.64±0.03** | 1.75±0.25 | 1.44±0.11** | |
| 200 | 1.42±0.07** | 1.55±0.01** | 0.91±0.05** | 2.05±0.48** | 1.21±0.09** | |
| *P<0.05,** P<0.01 vs control group | ||||||
胶质瘤是颅内最常见的恶性肿瘤,其发病率和死亡率均很高,且病程难以控制[4]。肿瘤的共同生物学特征是失控性生长,其主要的分子机制是细胞周期紊乱导致细胞增生过多和凋亡减少,但目前治疗方案仍只是以手术切除为主,并辅以放疗和化疗等,因此抑制肿瘤细胞增殖,诱导其凋亡已成为肿瘤治疗的重要手段之一[5]。五味子具有抗肿瘤作用,其抗肿瘤作用部分主要集中在木脂素和多糖部位[6, 7]。五味子甲素为木脂素的主要成分之一,所以,五味子甲素也可能具有抗肿瘤作用。本研究结果显示:不同浓度五味子甲素均可以明显抑制胶质瘤C6细胞的生长,且具有明显的浓度依赖效应。
细胞增殖是通过细胞周期来实现的,本实验通过流式细胞术检测细胞周期结果显示:SubG1期和G0/G1期细胞百分率随着五味子甲素浓度的增加而呈现增加的趋势,而S期和G2/M期细胞百分率呈下降趋势。说明五味子甲素既可以诱导细胞发生凋亡,又可以抑制细胞进入DNA合成前期,使细胞的生长受到阻滞。而细胞周期受细胞周期蛋白(Cyclins)和细胞周期蛋白依赖性激酶抑制因子的调控。在众多的细胞周期蛋白中,CyclinD1对细胞的生长具有正向的调节作用[8, 9]。本研究结果显示:五味子甲素作用于C6细胞后,细胞分泌CyclinD1蛋白水平呈明显下降的趋势,因此五味子甲素可能是通过下调CyclinD1蛋白表达,使细胞周期受到阻滞。
细胞凋亡是一种广泛存在于生理和病理状态下的程序化死亡,目前已发现许多与凋亡相关的基因,其中Bax和Bcl-2是一对凋亡的重要调控因子[10]。研究[11]表明:当Bcl-2蛋白表达增加时,在细胞内可形成Bcl-2/Bax异源二聚体,抑制凋亡的产生;当Bax表达加强时则促进Bax/Bax同源二聚体的形成从而加速细胞凋亡。因此Bax/Bcl-2比例对细胞的凋亡与否起决定性的作用[12]。当Bax/Bcl-2比值升高时,Bax激活引起线粒体膜上大孔通道开放,线粒体内细胞色素C等蛋白释放[13, 14]。线粒体蛋白释放会激活Caspase-3,Caspase-3是凋亡的"执行者"[15]。活化的Caspases-3再激活或者破坏下游的某些酶,导致特征性DNA断裂,最终引起凋亡发生[16]。本研究结果显示:随着药物作用浓度的升高,不同浓度五味子甲素组细胞分泌Bax蛋白增加,分泌Bcl-2蛋白减少,Bax/Bcl-2比值升高。因此五味子甲素可以增加C6细胞促凋亡因子的分泌,使得促凋亡因子占优势,下游Caspase-3表达增加也间接证实了凋亡通路的激活,但这还需要进一步检测活化Caspase-3情况才能最终确认。
| [1] | 王建华,齐锦生,李 恩. 五味子甲素对大鼠成骨细胞增殖分化的影响[J]. 天然产物研究与开发,2002,14(6):44-46. |
| [2] | Wang L,Zhang L,Shen W,et al.High expression of VEGF and PI3K in glioma stem cells provides new criteria for the grading of gliomas[J]. Exp Ther Med,2016,11(2):571-576. |
| [3] | 齐 玲,金 宏,沈 楠,等. 五味子提取物对脑胶质瘤神经球细胞增殖的抑制作用[J]. 吉林大学学报:医学版,2013,39(5):876-879. |
| [4] | 于洪泉,张 宇,金 宏,等. 恶性胶质瘤细胞死亡诱导信号复合体表达与TRAIL诱导凋亡的关系[J]. 吉林大学学报:医学版,2012,38(5):904-906. |
| [5] | Qi L,Bellail AC,Rossi MR,et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011,16(11):1150-1164. |
| [6] | 许珂玉,肖建英. 五味子多糖对甲状腺癌细胞株SW579凋亡及 survivin表达的影响[J]. 吉林大学学报:医学版,2011,37(2):279-283. |
| [7] | 任丽佳,李 林,殷放宙,等. 五味子抗肿瘤活性成分及作用机制研究进展[J].中国药理学通报,2012,28(1):140-142. |
| [8] | 刘世宜,李 昕. 低剂量长期砷暴露对HaCat细胞周期及周期蛋白的影响[J]. 中国公共卫生,2013,29(8):1190-1192. |
| [9] | Gopalakrishnan N, Saravanakumar M,Madankumar P,et al .Colocalization of β-catenin with Notch intracellular domain in colon cancer:a possible role of Notch1 signaling in activation of Cyclin D1-mediated cell proliferation[J]. Mol Cell Biochem,2014,396( 1/2): 281- 293. |
| [10] | 刘 英,郭世杰,孙景辉,等. 缺氧缺血性脑损伤新生大鼠心肌细胞凋亡及凋亡蛋白 Bax、Bcl-2表达的变化[J]. 临床儿科杂志,2009,27(12):1172-1176. |
| [11] | Reed JC. Proapoptotic multidomain Bcl-2/Bax-family proteins mechanisms physiological roles and therapeutic opportunities[J]. Cell Death Differ, 2006,13(8):1378-1386. |
| [12] | Bellail AC,Qi L,Mulligan P,et al. TRAIL agonists on clinical trials for cancer therapy:the promises and the challenges[J]. Rev Recent Clin Trials,2009,4(1):34-41. |
| [13] | 李 军,王国荣,张秀芹,等. 二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及 bcl-2、bax、caspase-3 表达的影响[J]. 中国病理生理杂志,2013,29(4):743-747. |
| [14] | 卢 阳,李 薇,崔久嵬,等. 胡桃醌对人结肠癌HCT-8细胞黏附及基质金属蛋白酶活性的影响[J]. 吉林大学学报:医学版,2012,38(1):89-93. |
| [15] | Deng Y,Lin Y,Wu X. TRAIL induced apoptosis requires Bax-dependent mitochondrial release of Smac / DIABLO[J]. Genes Dev,2002,16(1):33-45. |
| [16] | 齐 玲,刘玉翠,杨 阳,等. 双氢青蒿素抑制胶质瘤细胞生长机制[J]. 中国公共卫生,2015,31(11):1396-1398. |
 2016, Vol. 42
2016, Vol. 42


