扩展功能
文章信息
- 袁丽, 刘奇, 范喆, 李德顺, 吴建红, 张智华, 吕银娟, 韩永明
- YUAN Li, LIU Qi, FAN Zhe, LI Deshun, WU Jianhong, ZHANG Zhihua, LYU Yinjuan, HAN Yongming
- 吉林大学学报(医学版), 2016, 42(04): 704-710
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 704-710
- 10.13481/j.1671-587x.20160414
-
文章历史
- 收稿日期: 2015-09-03
抑郁症是一种常见的并且严重影响患者生活质量的疾病,目前西医抗抑郁治疗的药物具有较大的毒副作用,应用受到一定的限制。中医对抑郁症治法、方药研究应用历史悠久。《金匮要略》中的百合知母汤(Baihe Zhimu decoction,BZD)原用于治疗"百合病",现代临床上广泛用于治疗抑郁症、失眠症和更年期综合征等多种精神情志疾病。研究[1, 2, 3, 4, 5, 6, 7]表明:百合知母汤以及单味百合、知母中的皂苷成分可以通过提高单胺递质,调节下丘脑-垂体-肾上腺轴(Hypothalamic - pituitary - adrenal axis,HPA)等机制发挥抗抑郁作用[1, 2, 3, 4, 5, 6],百合和知母合用的有效成分浓度及效应明显高于单用[7]。前期研究[8]证实:百合知母汤可通过激活cAMP -CREB信号转导机制发挥抗抑郁作用。本文作者主要研究百合知母汤对抑郁症大鼠钙调蛋白(calmodulin,CaM)信号通路中关键分子CaM、钙调蛋白激酶Ⅱ(calmodulinkinase Ⅱ,CaMKⅡ)和反应元件结合蛋白(response element binding protein,CREB)表达的影响,探讨其抗抑郁的机制。
1 材料与方法 1.1 实验动物SPF级SD大鼠50只,体质量150~200g,由湖北省实验动物研究中心提供,许可证号:SCXK(鄂) 2008-0005。饲养条件:室温(25±3)℃,湿度60%~70%,光/暗周期为12h/12h(光照时间 8:00-20:00)。
1.2 药物和试剂百合、知母均购于北京同仁堂健康药业有限公司。按《金匮要略》中记载的方法:百合清水浸泡12h,去水,再加清水,武火煎开后改为文火,得百合煎煮液;再清水煎煮知母,武火煎开后改为文火,得知母煎煮液;将2种煎煮液混合,文火浓缩得煎煮液,放入冰箱储存备用,临用时取出,浓缩至合适体积。氟西汀胶囊(礼来苏州制药有限公司,产品批号3437A)。Tris-Base(美国Amresco公司,货号0497),Page Ruler prestained protein ladder(美国Thermo公司,货号26616),显影定影液和曝光胶片(日本Kodak公司,货号分别为6610190和XBT-1),一抗、二抗(中国碧云天公司,货号P0025),TRIzol(美国Invitrogen公司,货号15596026),DNase I、Revert Aid Reverse Transcriptase和RiboLock RNase Inhibitor(美国Fermentas公司产品,货号分别为EN0521、EP0442、R0191和E00381),qPCR试剂盒(美国GeneCopoeia公司,货号AOPR-1200)。
1.3 主要仪器微型高速离心机(美国Labnet公司,型号:C2500-R-230),电热恒温培养箱(日本ASONE公司,型号:ICV-450),全自动酶标仪(美国Thermo Scientific公司,型号:Multiskan MK3),迷你电泳槽和转膜芯(北京六一生物科技有限公司,型号分别为DYZC-24DN和DYZC-40D),PVDF膜(美国Millipore公司,型号:CAT.NO.IPVH00010),RT-PCR仪(美国ABI公司,型号:Stepone plus),滤纸(英国Whatman公司,型号:3MM CHR),显微镜(日本尼康公司,型号:BX60-32FB-E01)。
1.4 抑郁症大鼠模型制备及分组按照体质量将50只大鼠随机分为5组,即对照组、模型组、阳性药氟西汀组和百合知母汤低、高剂量组,每组10只。除对照组外,其余各组大鼠采用慢性轻度不可预见性温和刺激结合孤养的方法制备抑郁症模型:各造模组大鼠均单笼饲养,刺激因子包括禁食24h、禁水24h、4℃冰水游泳5 min、夹尾5 min、潮湿垫料12h、倾斜45°12h、束缚应激2h、空笼刺激12h、噪音刺激10 min、闪光刺激2h、水平震荡5 min和昼夜颠倒24h等14种。每日随机给予2~3种刺激,每种刺激交叉累计使用2~3次,持续21d。各组动物于第22天开始灌胃给药,百合知母汤低剂量组大鼠给予1.5 g·kg-1百合知母汤,百合知母汤高剂量组大鼠给予3.0 g·kg-1百合知母汤,氟西汀组大鼠给予1.8 mg·kg-1氟西汀,对照组、模型组大鼠给予等体积生理盐水,每日1次,连续灌胃28d。
1.5 Morris水迷宫实验采用Morris水迷宫对各组大鼠学习记忆功能进行检测。所有大鼠于正式实验前3d每日进行1次定位航行训练,末次给药后正式测试,记录90s内大鼠在平台象限运动的总时间、总路程、穿越平台次数及第一次穿越平台用时。
1.6 敞箱实验木质敞箱:长、宽、高为80 cm×80 cm×40 cm,内侧壁、底面为黑色,底面用白线划分为面积相等的25块正方形。室内安静环境下将大鼠放置于敞箱底面的中心方格内,人距离敞箱1m之外,记录大鼠在3 min内活动率,穿越底面正方形块数为水平穿越格数,两后肢直立的次数为竖立活动次数。每只大鼠测1次,测定完毕后彻底清洁敞箱再进行下一只观察,分别在第0、21和49天进行大鼠的敞箱实验。以大鼠水平活动次数和直立次数的总和记录大鼠自主活动情况。
1.7 强迫游泳实验敞箱实验结束后,将动物放入树脂玻璃缸(高50 cm,直径20 cm,水温21~23℃)6 min,水深约30 cm,以大鼠后足刚可触及缸底却不足以支撑身体为宜,观察记录后5 min游泳测试中大鼠"不动状态"的持续时间(不动时间),由对实验不知情者记录。
1.8 大鼠海马神经元尼氏染色各组随机选取5只大鼠,分别于末次给药后麻醉,常规灌注固定,取大鼠全脑,10%低聚甲醛固定48~60h。以松果体为标志物,向头侧横向切取3段,每段厚2 mm。4℃下脱水透明后,石蜡包埋,连续切片,片厚5 μm,用于尼氏染色。切片脱蜡至水,将脑组织切片置于0.5%甲苯胺蓝中室温下染色30 min。在75%、95%和100%酒精中各脱色1 min,二甲苯透明10 min,中性树胶封片,显微镜下观察并拍照。
1.9 Western blotting法检测大鼠海马组织中CaM和CaMKⅡ蛋白表达水平各组剩余的大鼠末次给药后断头,冰台上迅速取新鲜海马组织,放置于1.5mLEP管中,生理盐水冲洗2次,充分剪碎,离心去上清。每管加4℃裂解液1mL,继续剪碎、混匀,低温超声匀浆;14000r·min-1离心5 min,取上清备用。取上清5 μL,加考马斯亮蓝3 μL,去离子水95 μL,595nm 处,1cm光径,蒸馏水调零,测各管吸光度(A)值,根据样品A值调整蛋白浓度。样品煮沸5 min,冷却后取50 μg上样;电泳(12%浓缩胶:90V,30 min;10%分离胶:120V、120 min);NC膜转印(70V、120 min);5%脱脂奶粉TBST溶液封闭抗体,摇床2h,TBS漂洗5 min×3。一抗孵育(兔抗人CaM、CaMKKⅡ多克隆抗体1∶500稀释),4℃过夜;二抗孵育(辣根酶标记羊抗兔IgG 1∶1500稀释),37℃、 1h;扫描并分析结果,条件设置为曝光2 min,CCD自动获取图像,同时以1∶1000稀释的小鼠抗大鼠β-actin单克隆抗体作为内参照,各蛋白相对表达水平以目的条带与β-actin灰度值的比值表示。
1.10 RT-PCR 法检测大鼠海马组织中CREBmRNA表达水平随机选取5个样本,测定大鼠海马组织中CREB mRNA表达水平。按照qPCR操作流程进行,引物由Primer5.0软件设计。引物序[HQ]列,β-actin:Forward,5'-CGTTGACACCGTAAGACCTC-3',Reverse,5'-TAGGAGCCAG-GGCAGTAATCT-3';CREB:Forward,5'-GCAG-TGACTGAGGAGCTTGT-3',Reverse,5'-ACT-CTGCTGGTTGTCTGCTC-3'。反应条件:95℃、10 min,95℃、10s,60℃、20s,72℃、20s,40个循环。每个样品做3个平行孔,取平均值,获得平均CT值,以β-actin作为内参照校正,用2-ΔΔCT值表示基因的相对表达水平。
1.11 统计学分析采用SPSS 13.0统计软件进行统计学处理。大鼠行为学指标和海马组织中CaM、CaMKⅡ蛋白和CREBmRNA的表达水平以 ±s表示。数据经检验符合正态分布,2组间比较采用独立样本t检验。检验水准为双侧α=0.05。
±s表示。数据经检验符合正态分布,2组间比较采用独立样本t检验。检验水准为双侧α=0.05。
与对照组比较,模型组大鼠在平台象限的总时间、总路程及穿越平台的次数均减少(P<0.01),第一次穿越平台用时和登上平台前的潜伏期增加(P<0.01)。与模型组比较,氟西汀组、百合知母汤低和高剂量组大鼠在平台象限的总时间、总路程以及穿越平台的次数均增加(P<0.05或P<0.01),第一次穿越平台用时和登上平台前的潜伏期缩短(P<0.05)。各治疗组间比较差异无统计学意义。见表1。
(n=10, ±s) ±s) | |||||
| Group | Total time in platform quadrant(t/s) | Total distance in platform quadramt(l/cm) | Number of crossing the platform | Time of thefirst crossing platform quadrant(t/s) | Latency time (t/s) |
| Control | 55.40±13.00 | 702.90±82.57 | 14.80±5.63 | 13.18±6.14 | 26.60±15.97 |
| Model | 38.87±8.90* | 494.60±70.19* | 4.60±1.78* | 29.86±8.05* | 71.89±21.05* |
| Fluoxetine | 56.13±11.88△△ | 639.20±88.91△△ | 15.20±5.92△△ | 16.85±8.68△△ | 34.81±18.65△△ |
| BZD | |||||
| Low dose | 52.21±11.75△ | 631.10±73.13△△ | 13.70±5.60△△ | 18.09±7.93△△ | 40.06±18.54△△ |
| High dose | 52.17±9.95△ | 649.10±80.08△△ | 14.30±5.85△△ | 14.36±5.94△△ | 36.25±19.61△△ |
| *P<0.05,** P<0.01 compared with control group;△P<0.01 compared with model group. | |||||
实验前(0 d)各组大鼠 敞箱实验总得分比较差异无统计学意义(P>0.05)。在造模后(21d),与对照组比较,造模的各组大鼠敞箱实验总得分明显降低,差异有统计学意义(P<0.01)。用药治疗后(49d),与模型组比较,氟西汀组、百合知母汤低和高剂量组大鼠敞箱实验总得分均明显提高,差异有统计学意义(P<0.01)。见表2。
(n=10, ±s) ±s) | ||||
| Group | Total score in open-field test | |||
| (t/d) 0 | 21 | 49 | ||
| Control | 97.60±13.93 | 91.70±11.56 | 89.20±4.69 | |
| Model | 99.00±13.41 | 54.00±17.25* | 39.20±14.57* | |
| Fluoxetine | 102.30±8.45 | 53.50±16.79* | 89.50±12.70△ | |
| BZD | ||||
| Low dose | 101.70±10.63 | 57.80±9.72* | 76.00±12.86△ | |
| High dose | 96.70±12.53 | 51.60±13.68* | 87.50±15.83△ | |
| *P<0.01compared with control group;△P<0.01compared with model group | ||||
实验前(0 d),各组大鼠在强迫游泳实验中的不动时间比较差异无统计学意义(P>0.05)。在造模后(21 d),与对照组比较,造模的各组大鼠在强迫游泳实验中的不动时间明显增加(P<0.01)。用药治疗后(49 d),与模型组比较,氟西汀组和百合知母汤低、高剂量组大鼠在强迫游泳实验中的不动时间明显缩短(P<0.05或P<0.01)。与氟西汀组比较,百合知母汤高剂量组大鼠在强迫游泳实验中的不动时间明显缩短(P<0.05)。见表3。
(n=10, ±s,t/s) ±s,t/s) | |||
| Group | Fixed time in forced swimming test | ||
| (t/d) 0 | 21 | 49 | |
| Control | 70.30±17.09 | 72.50±16.19 | 68.50±11.42 |
| Model | 69.90±18.75 | 119.30±34.46** | 115.90±21.74** |
| Fluoxetine | 70.10±22.69 | 129.10±40.92** | 84.60±8.73*△ |
| BZD | |||
| Low dose | 65.40±17.94 | 132.00±21.67** | 76.10±16.57*△ |
| High dose | 67.30±16.15 | 126.60±25.63** | 66.60±14.34△△# |
| *P<0.05,**P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group;#P<0.05 compared with fluoxetine group. | |||
对照组大鼠海马CA区锥体细胞带细胞层厚,排列整齐、紧密;模型组大鼠海马CA区锥体细胞带细胞数量减少(部分消失或溶解),间质水肿疏松、中断、紊乱,并可见凋亡小体,高倍显微镜镜下可见神经元胞膜溶解、破裂、尼氏小体数量减少;与模型组比较,氟西汀组及百合知母汤低、高剂量组大鼠CA区椎体细胞层细胞数量增加,排列较紧凑,间质水肿改善,尼氏小体数量增加。见图1(插页三)。
2.5 各组大鼠海马组织中CaM和CaMKⅡ蛋白表达水平与模型组比较,氟西汀组和百合知母汤低、高剂量组大鼠海马组织中CaM蛋白表达水平明显升高((P<0.05或P<0.01),百合知母汤低、高剂量组大鼠海马组织中CaMKⅡ蛋白表达水平明显升高 (P<0.05),氟西汀组大鼠海马组织中CaMKⅡ蛋白表达水平升高,但差异无统计学意义(P>0.05)。与氟西汀组比较,百合知母汤低、高剂量组大鼠海马组织中CaMKⅡ蛋白表达水平明显升高(P<0.05)。见图2和表4。
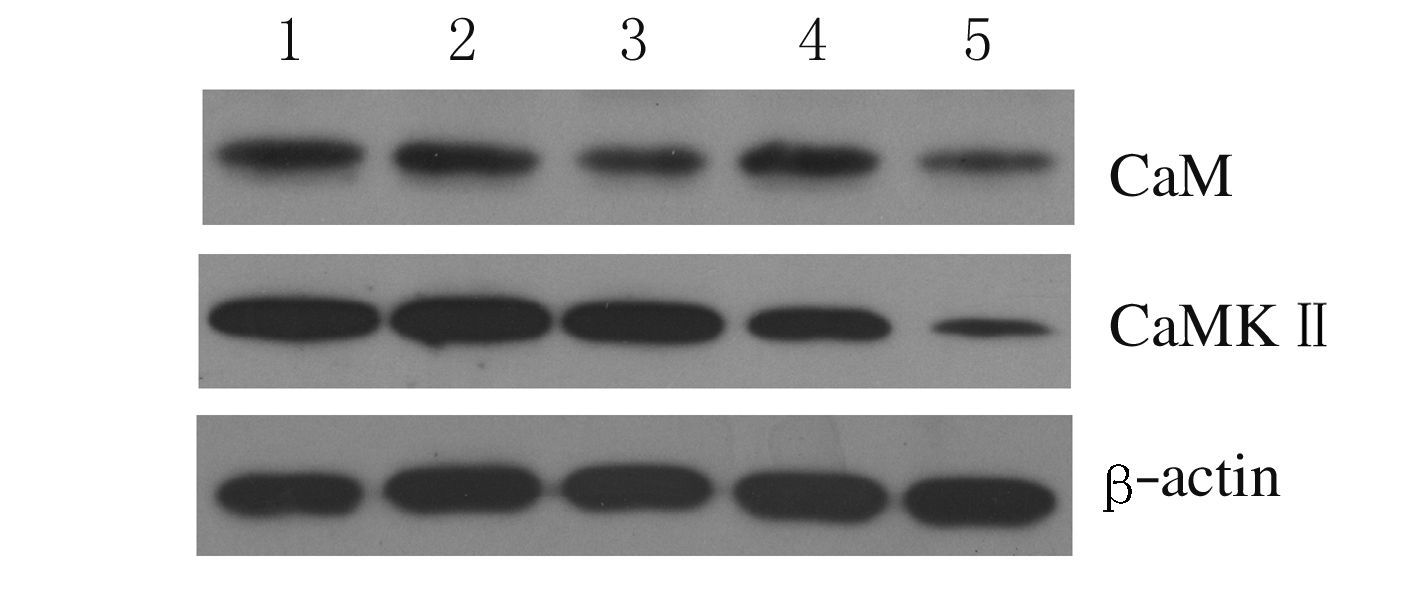
|
| Lane 1:Control group;Lane 2:High doseof BZD group;Lane 3:Low dose of BZD group;Lane 4:Fluoxetine group;Lane 5:Model group. 图2 各组大鼠海马组织中CaM和CaMKⅡ蛋白表达电泳图 Fig.2 Electrophoregram of expressions of CaM and CaMKⅡprotein in hippocampus tissue of rats in various groups |
(n=5, ±s) ±s) | ||
| Group | CaM | CaMKⅡ |
| Control | 147.49±55.29 | 126.00±68.17 |
| Model | 95.47±42.15 | 56.25±26.54 |
| Fluoxetine | 147.83±33.83** | 72.66±45.50 |
| BZD | ||
| Low dose | 136.13±17.92* | 127.96±73.82*△ |
| High dose | 140.69±17.48* | 128.82±78.61*△ |
| *P<0.05,**P<0.01 compared with model group;△P<0.05 compared with fluoxetine group. | ||
与对照组比较,模型组大鼠海马组织中CREB mRNA表达水平明显降低,差异有统计学意义(P<0.01);与模型组比较,氟西汀组及百合知母汤低、高剂量组大鼠海马组织中CREBmRNA表达水平均明显升高,差异有统计学意义(P<0.05或P<0.01)。见表5。
(n=5, ±s) ±s) | |
| Group | CREB mRNA |
| Control | 0.79±0.09 |
| Model | 0.13±0.07* |
| Fluoxetine | 0.54±0.04*△ |
| BZD | |
| Low dose | 0.73±0.24△△ |
| High dose | 0.76±0.23△△ |
| *P<0.05,** P<0.01 compared with control group;△ P<0.05 compared with model group. | |
大脑海马区属于脑区的边缘系统,与学习、行为、情绪密切相关,也是应激损伤的主要器官。慢性刺激可损害海马,引起结构和功能的改变,导致学习记忆、情绪等方面的改变[9, 10]。CaM信号通路是抑郁症及抗抑郁治疗机制中重要的途径,可介导多种学习记忆障碍和情绪异常。其生物学过程大致为:细胞内钙离子浓度增加,激活CaM,进一步激活CaMKⅡ,促使CREB磷酸化,调节下游基因转录,产生生物学效应[11, 12]。CaM 是神经元内最重要的Ca2+受体蛋白,广泛存在于脑组织中,并且直接参与神经元的应激和修复过程[13, 14]。CaMK 有多种系列,其中CaMKⅡ和CaMKⅣ是与CREB磷酸化关系最为密切的2种CaMK亚型,二者均能使CREB磷酸化[15, 16, 17, 18]。CaMKⅡ是一种在脑组织尤其是海马区内高度表达的蛋白激酶。活化的 CaMKⅡ 可以进一步活化谷氨酸受体、活化其他离子通道,从而改变神经元的兴奋性、活化下游的CREB以调节某些蛋白的合成,改变神经元的形态、突触的数量及结构。在突触可塑性和学习记忆中发挥着关键作用[19, 20]。
本研究结果显示:抑郁症模型组大鼠在Morris水迷宫测试中停留在平台象限的总时间、总路程以及穿越平台的次数均少于对照组,第一次穿越平台用时和登上平台前的潜伏期均长于对照组,敞箱实验中垂直水平总得分亦明显低于对照组,强迫游泳实验中的不动时间也明显长于对照组,说明大鼠在慢性应激环境下,空间学习、记忆能力明显下降,自主活动明显减少,绝望状态明显。本研究中大鼠海马组织尼氏染色结果显示:造模21d后大鼠海马CA区锥体细胞带细胞数量减少、间质水肿疏松、中断、紊乱,并可见凋亡小体,高倍显微镜镜下可见神经元胞膜溶解、破裂、尼氏小体数量减少,说明造模大鼠存在海马神经元的损害和丢失,引起神经元损伤,导致抑郁症的发生。本研究结果同时显示:模型组大鼠海马组织中CaM、CaMKⅡ蛋白及CREBmRNA表达水平低于对照组,说明这些关键分子参与了抑郁症行为学改变和神经元损伤的发生发展。
本研究结果显示:百合知母汤治疗28d后,大鼠在Morriss水迷宫平台象限的总时间、总路程、穿越平台的次数及敞箱实验总得分明显增加,同时第一次穿越平台用时、潜伏期及强迫游泳实验的不动时间也明显缩短,说明百合知母汤能增进抑郁症大鼠空间学习和记忆能力,改善活动度和绝望状态;大鼠海马CA区椎体细胞层细胞数量增加,排列较紧凑,间质水肿改善,尼氏小体数量增加,提示百合知母汤能修复受损神经元;大鼠海马组织中CaM、CaMKⅡ蛋白和CREBmRNA表达水平升高,说明百合知母汤有抗抑郁效应,其机制可能与激活海马组织中CaM信号通路中的CaM、CaMKⅡ和CREB等关键分子,改善神经元的损伤和丢失有关。
| [1] | 郭秋平,高 英,李卫民.百合有效部位对抑郁症模型大鼠脑内单胺类神经递质的影响[J].中成药,2009,31 (11):1669-1672. |
| [2] | 路明珠,张治强,伊 佳,等.知母皂苷B-Ⅱ抗抑郁作用及其机制研究[J].药学实践杂志,2010,28(7):283-287. |
| [3] | 郭秋平,高 英,李卫民.百合皂苷对抑郁症大鼠HPA轴的影响[J].中国药理学通报,2010,26(5):699-700. |
| [4] | 任利翔,罗轶凡,高 威,等.知母总皂苷对慢性温和应激小鼠的保护作用及机制研究[J].中药新药与临床药理,2011,22(4):414-417. |
| [5] | 任利翔,罗轶凡,宋少江,等.知母总皂苷抗实验性抑郁作用及其机制的初探[J].沈阳药科大学学报,2007,24(3):172-175. |
| [6] | 郑永庆.百合知母汤抗抑郁作用的理论与实验研究[D].上海:第二军医大学,2007. |
| [7] | 李海龙,高淑怡,高 英,等.百合知母总皂苷镇静催眠的药效学研究[J].北方药学,2012,10(9):34-35. |
| [8] | 李德顺,袁 丽,刘 奇,等.百合知母汤对抑郁症大鼠环磷酸腺苷信号通路的影响[J].武汉大学学报:医学版,2015,36(6):867-871. |
| [9] | 任 双,吴高峰,胡建民.慢性应激与大脑海马神经再生的关系[J].动物医学进展,2016,37(1):85-88. |
| [10] | Van Miero T J,Chung C,Foncke EM,et al.Depressive symptoms in Pakinson's disease are related to decreased hippocampus and amygdale volume [J].Mov Disor,2015,30(2):245-252. |
| [11] | 夏 猛.抗抑郁药物与细胞内信号转导机制[J].辽宁中医杂志,2012,39(7):1275-1277. |
| [12] | 卢 峻,杨秀岩,华 茜,等.cAMP反应元件结合蛋白:抗抑郁药信号转导通路的交汇点[J].生理学进展,2009,39(4):371-374. |
| [13] | 王海涛,刘 昊,徐爱军,等.慢性强迫游泳应激抑郁模型大鼠行为学及海马Ca2+/钙调蛋白依赖性激酶Ⅱ的变化[J].解剖学报,2009,40(6):881-885. |
| [14] | Lee SJ,Kim HE,Choi SE,et al.Inwolvement of Ca2+/calmodulin kinaseⅡ (CaMKⅡ) in genistein-induced potentiation of leucine/glutamine-stimulated insulin secretion[J].Mol Cells,2009,28(3):167-174. |
| [15] | Carlezon WA Jr,Duman RS,Nestler EJ.The many faces of CREB [J].Trends Neurosci,2005,28(8):436-445. |
| [16] | Li K,Zhou T,Liao L,et al. βCaMKⅡ in lateral habenula mediates core symptoms of depression[J]. Science, 2013,341(6149):1016-1020. |
| [17] | 李 坤,周 涛,胡海岚. 外侧缰核中的βCaMKⅡ介导核心抑郁症状的发生[J].中国细胞生物学学报,2013,35(12):1701-1704. |
| [18] | 唐开福,张银辉,袁建刚.CaMKⅡ 在学习和记忆中的作用[J].生物工程进展,2001,21(2):50-53. |
| [19] | Coultrap SJ,Bayer KU. CaMKⅡ regulation in information processing and storage [J].Trends Neurosci,2012,35(10):607-618. |
| [20] | Hell JW. CaMKⅡ:"Claiming center stage in positsymptic function and organization"[J].Neuron,2014,81(2):249-265. |
 2016, Vol. 42
2016, Vol. 42


