扩展功能
文章信息
- 范钰奇, 王明华, 谢东雪, 崔雪玲, 葛敬岩
- FAN Yuqi, WANG Minghua, XIE Dongxue, CUI Xueling, CUI Xueling
- 吉林大学学报(医学版), 2016, 42(04): 699-703
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 699-703
- 10.13481/j.1671-587x.20160413
-
文章历史
- 收稿日期: 2016-01-25
2. 吉林大学基础医学院遗传学系, 吉林 长春 130021
2. Department of Genetics, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
高血压的发生是多系统参与的复杂的整合过程,目前认为遗传因素、精神因素以及肾素血管紧张素系统、饮食和环境等因素均参与了高血压的形成过程[1, 2]。下丘脑室旁核(paraventricular nucleus,PVN)是自主神经反应和神经内分泌的重要整合中枢,在维持动脉压的稳态中发挥重要作用[3],但是PVN调节动脉压的分子机制尚未阐明。激活素A属于转化生长因子β(transforming growth factor,TGF-β)超家族成员,在机体正常发育过程中广泛表达[4, 5]。研究[6, 7, 8]显示:激活素A能够促进神经元释放5-羟色胺(5-HT),并具有增加神经元Na+电流的作用。激活素通过与抗激活素Ⅱ型受体(ActRⅡ)结合,再招募Ⅰ型受体(ActRⅠ)并使其磷酸化而活化,进而激活下游的Smad2/3传导细胞内信号[9]。已有研究[10, 11]显示:肺动脉高压患者及先兆子痫患者血清中激活素A水平升高,但激活素A能否通过PVN参与动脉压调节,尚未见相关报道。本研究利用WKY大鼠分析激活素A、ActRⅡ及Smads在PVN的表达及其对动脉压的影响,阐明激活素A通过PVN对动脉压的调节作用及可能机制。
1 材料与方法 1.1 动 物30只SPF级WKY大鼠由北京维通利华实验动物技术有限公司提供[SCXK(京)2011-0011],所有实验均符合吉林大学关于实验动物管理条例。
1.2 主要试剂激活素A及抗激活素ⅡA型受体(ActRⅡA)单克隆抗体由美国R&D公司提供,Neurobasal和B-27培养液购于美国G ibco公司,血管紧张素Ⅱ(angiotensin,AngⅡ)和L-多聚赖氨酸购自美国Sigma公司,一步法逆转录PCR试剂盒由宝生物工程有限公司(大连)提供。
1.3 RT-PCR法检测大鼠PVN神经元中ActRⅡ和Smads mRNA表达水平Trizol试剂提取大鼠PVN组织或体外原代培养的PVN神经元中总RNA,采用一步法RT-PCR扩增特异cDNA片段,2%琼脂糖凝胶电泳,采用凝胶成像系统分析扩增的cDNA片段,以β-actin做为内参照,以目的基因/β-actin灰度值比值表示目的基因mRNA相对表达水平。引物序列见表1。
| Gene | Forward(5'-3') | Reverse(5'-3') | Size(bp) |
| Activin A | ggatgtgcggattgcttgtga | gaccttgccatcacactccaa | 235 |
| ActRⅡA | gacagaaccaatcagactggt | tgtgtgacttccatctccggaa | 254 |
| ActRⅡB | gctgctggctagatgacttca | gatgtcggtacatccagaagg | 261 |
| Smad2 | aggtggtggagaacagaatgg | gacacctgaagacgaccatca | 270 |
| Smad3 | cggtcaagagcttggtgaaga | aaggcgaactcacagagctcc | 238 |
| β-actin | accaactgggacgatatggag | atgccagtggtacgaccagag | 224 |
大鼠麻醉处死后进行心脏灌流,断头取脑组织于4%多聚甲醛中固定24h,脑组织冠状切片,石蜡包埋PVN核团部位脑组织,常规组织切片、脱蜡、透明及水化。3%过氧化氢室温孵育30 min,再应用3%牛血清白蛋白封闭30 min,加入抗ActRⅡA单克隆抗体4°C过夜。磷酸盐缓冲液(PBS)洗3次,加入生物素标记的二抗室温孵育10 min;PBS洗3次,再加入辣根过氧化物酶标记链霉亲和素室温孵育10 min;PBS洗3次,然后加入新鲜配制的DAB液进行显色,苏木素复染,二甲苯透明,中性树胶封固,光学显微镜下观察染色情况。以同型IgG作为阴性对照,操作同抗体组。
1.5 大鼠PVN微量注射及动脉压监测3%戊巴比妥钠腹腔注射(30 mg·kg-1)麻醉大鼠,股动脉插管,PowLab监测动脉血压,将大鼠固定于脑立体定位仪,根据Paxinos和Watson的大鼠立体定位图谱,定位PVN核团三维坐标(AP:-1.78 mm,RL/LL:0.5 mm,DV:8 mm)。取100nL激活素A(20 μg·L-1)或AngⅡ(100 pmol·L-1)缓慢注射于大鼠PVN内,观察各组大鼠动脉压变化。每次实验结束后,将50 nL伊文思蓝注射于同一位置以验证PVN定位是否准确。
1.6 大鼠PVN原代神经元培养及其ActRⅡA、ActRⅡB和Smads mRNA表达水平检测新生24h内的WKY大鼠,无菌环境取脑组织,分离PVN所在部位,剪碎组织块,0.25%胰酶消化组织20 min,加入100 μLDNA酶,10%牛血清DMEM终止消化,200目钢网过滤细胞后进行离心,重悬细胞,计数,以每孔5×105个细胞接种于预先用L-多聚赖氨酸包被的24孔培养板中,4h后换神经元维持培养液(neurobasal medium+1% B27),培养7~10 d。以无血清培养液洗细胞 2次,再加入2%牛血清DMEM配置的激活素A 2.5 和5.0 μg·L-1,同时设培养液对照组,继续培养12 h,回收细胞RNA,用于RT-PCR扩增目的基因。
1.7 统计学分析采用SPSS 13.0统计软件进行统计学处理。大鼠平均动脉压及PVN中ActRⅡA、ActRⅡB和Smads mRNA表达水平以 ±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
RT-PCR法检测结果:WKY大鼠PVN中均有激活素A、ActRⅡA、ActRⅡB、Smad2和Smad3 mRNA的表达(图1)。
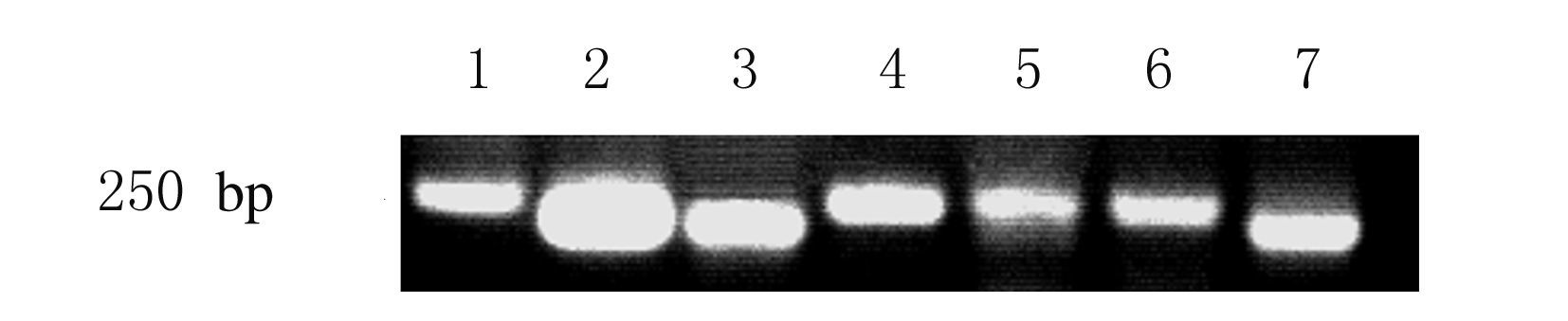
|
| Lane1:DNA marker;Lane2:β-actin;Lane 3:Activin A;Lane 4:ActRⅡA;Lane 5:ActRⅡB;Lane 6:Smad2;Lane 7:Smad3. 图1 大鼠PVN中激活素A、激活素受体及Smad2和Smad3 mRNA表达电泳图 Fig.1 Electrophoregram of expressions of activin A,ActRⅡA,ActRⅡB,Smad2,and Smad3 mRNA in PVN of rats |
采用免疫组织化学染色方法观察ActRⅡA蛋白在WKY大鼠PVN中的表达。与IgG阴性对照组比较,抗ActRⅡA抗体组神经细胞上可见棕黄色颗粒(图2,见插页二),表明ActRⅡA蛋白在大鼠PVN神经元中有表达,该结果与mRNA检测结果一致。
2.3 大鼠PVN核团微量注射激活素A后大鼠平均动脉压作为阳性对照的AngⅡ注射组,大鼠PVN注射AngⅡ后血压明显升高,平均动脉压由给药前(88.7±3.0)kPa升高到(100.0±5.3)kPa;激活素A注射组大鼠平均动脉压由给药前(86.3±3.8)kPa升高到(96.3±4.5)kPa(图3)。与给药前比较,给药后2组大鼠平均动脉压均明显升高(P<0.05)。

|
| 图3 大鼠PVN注射AngⅡ(A)和激活素A(B)后平均动脉压 Fig.3 Mean of arterial blood pressure of rats after injection of AngⅡ(A) and activin A(B) into PVN |
与对照组比较,不同浓度激活素A处理组原代培养PVN神经元中ActRⅡA和Smad3 mRNA表达水平明显升高(P<0.05),而ActRⅡB和Smad2 mRNA表达水平无明显变化(P>0.05)。见图4和5。
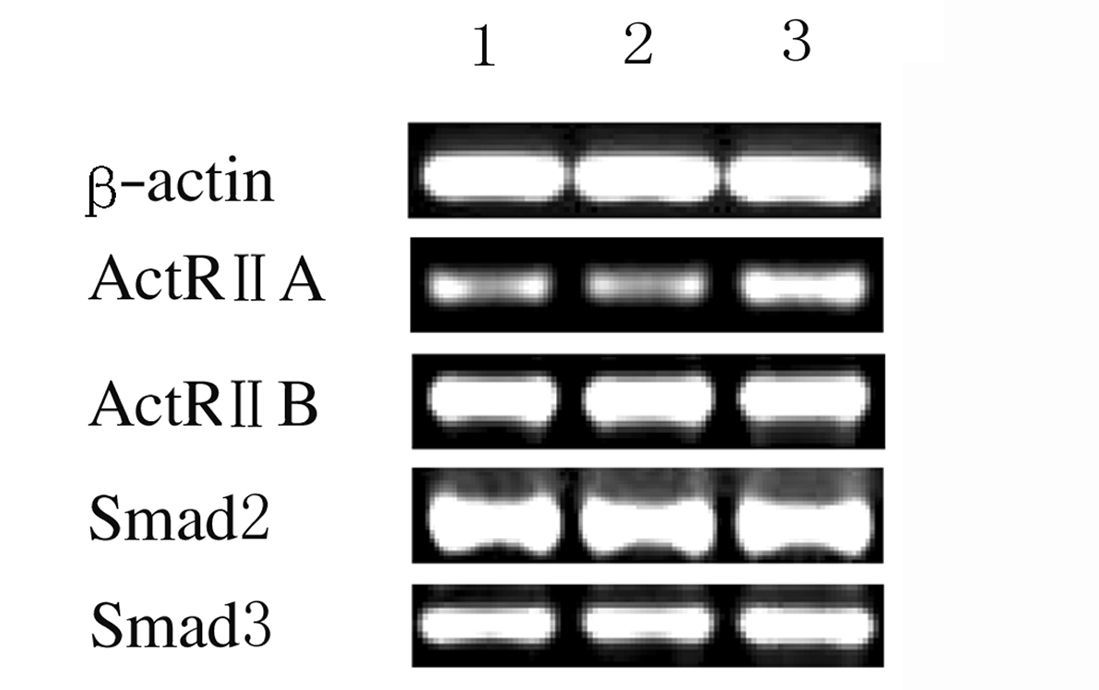
|
| Lane 1:Control group;Lane 2:Activin A 2.5 μg·L-1 group; Lane 3:Activin A 5.0 μg·L-1 group. 图4 大鼠原代培养PVN神经元中ActRⅡA、ActRⅡB、Smad2和Smad3mRNA表达电泳图 Fig.4 Electrophoregram of expressions of ActRⅡA,ActRⅡB,Smad2,and Smad3 mRNA in primary cultured PVN neurons of rats |
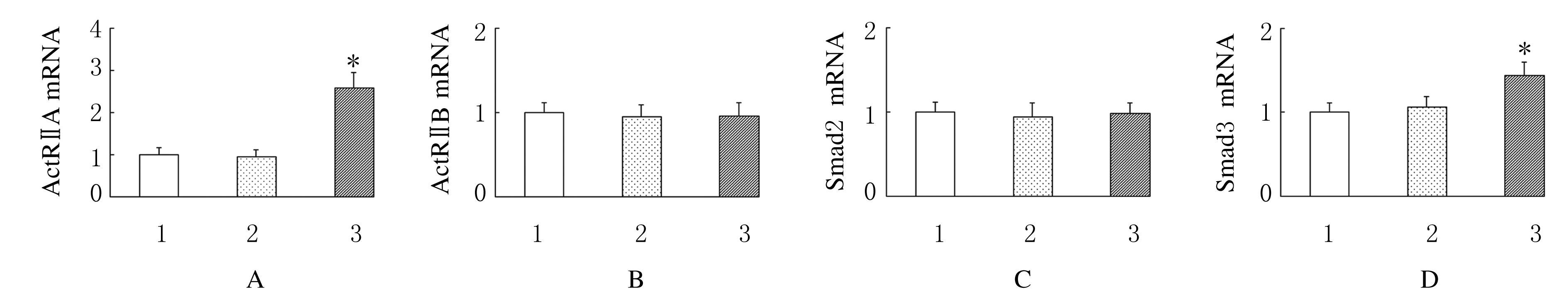
|
| 1:Control group;2:Activin A 2.5 μg·L-1 group;3:Activin A5.0 μg·L-1 group;*P<0.05 vs control group. 图5 大鼠原代培养PVN神经元中ActRⅡA(A)、ActRⅡB(B)、Smad2(C)和Smad3(D) mRNA表达水平直条图 Fig.5 Histogram of expression levels of ActRⅡA(A),ActRⅡB(B),Smad2(C),and Smad3(D) mRNA in PVN neurons of rats |
激活素A属于TGF-β超家族,在调节细胞分化、凋亡和胚胎发生过程中发挥重要作用,机体发育过程中激活素A及其信号传导异常将导致形态学缺陷和过早死亡[12, 13]。激活素A参与了多种疾病的过程,心衰、肺动脉高压和先兆子痫患者血清中激活素A水平明显升高,且升高水平与疾病的严重程度和死亡率有关联[10, 11]。有研究[14, 15]显示:TGF-β超家族中的TGF-β1水平与高血压患者的动脉血压呈正相关关系,降低TGF-β1能够降低高血压的程度。尽管大量研究表明TGF-β1参与了动脉压的调节,但TGF-β超家族的激活素A是否直接参与了动脉压的调节仍不清楚。
激活素A及其受体在脑组织中广泛表达,特别是下丘脑,提示激活素A在下丘脑对神经功能调节具有潜在性和多样性。激活素A具有神经保护作用,能够延长神经元的存活和减轻神经元损伤。激活素A还通过激活N-甲基-D-天冬氨酸受体(NMDAR)增加原代培养海马神经元Ca2+ 内流,调节突触的可塑性[16]。本课题组前期研究[7]发现:激活素A能够增加神经元Na+电流调节神经元的兴奋性,但其通过PVN对动脉压的调节作用尚不清楚。本文作者检测激活素A及其受体在WKY大鼠PVN中表达的结果显示:激活素A及其受体ActRⅡA和ActRⅡB mRNA在大鼠PVN中均有表达,同时免疫组织化学染色进一步证实ActRⅡA蛋白在大鼠PVN中表达,与mRNA的结果一致,提示激活素A可能通过自分泌/旁分泌形式参与PVN神经元功能调控。为了确定激活素A在PVN中的作用,本研究采用PVN微量注射外源性激活素A观察大鼠动脉压变化的结果显示:作为阳性对照的AngⅡ注射PVN后大鼠血压可以明显升高,同样激活素A注射PVN后大鼠血压也明显升高,提示激活素A可能通过PVN调控机体动脉压。
Smads蛋白是介导TGF-β超家族信号传导的主要蛋白,其中Smad2和Smad3负责传导激活素/ TGF-β信号,Smad1、Smad5和Smad8则负责骨形成蛋白(BMP)信号传导,而Smad4是TGF-β超家族共同的信号传导蛋白[17]。为了确定激活素A调控PVN神经元的作用是否与Smad信号传导途径有关,本研究采用RT-PCR法检测Smad2及Smad3mRNA在WKY大鼠PVN中表达的结果显示:Smad2及Smad3 mRNA在大鼠PVN中均有表达;进一步采用原代培养PVN神经元观察激活素A对其信号分子表达影响的结果显示:激活素A可以明显上调原代培养PVN神经元中ActRⅡA和Smad3 mRNA表达,而对ActRⅡB和Smad2 mRNA表达无明显影响,提示激活素A可能通过ActRⅡA-Smad3依赖途径影响PVN神经元活性,进而使大鼠血压升高。
综上所述,激活素A及其受体在PVN中表达,可能通过自分泌/旁分泌形式作用于PVN调控动脉压,其升压作用与ActRIIA-Smad3信号传导途径有关。
| [1] | Tsuda K. Renin-Angiotensin system and sympathetic neurotransmitter release in the central nervous system of hypertension[J]. Int J Hypertens,2012,2012:474870. |
| [2] | Ribeiro N,PanizzaHDN,Santos KMD,et al. Salt-induced sympathoexcitation involves vasopressin V1a receptor activation in the paraventricular nucleus of the hypothalamus[J]. Am J Physiol Regul Integr Comp Physiol,2015,309(11):R1369-1379. |
| [3] | Erdos B,Clifton RR,Liu M,et al. Novel mechanism within the paraventricular nucleus reduces both blood pressure and hypothalamic pituitary-adrenal axis responses to acute stress[J]. Am J Physiol Heart Circ Physiol,2015,309(4):H634-645. |
| [4] | Thompson TB,Cook RW,Chapman SC,et al. Beta A versus beta B:is it merely a matter of expression?[J]. Mol Cell Endocrinol,2004,225(1/2):9-17. |
| [5] | Wijayarathna R,de Kretser DM. Activins in reproductive biology and beyond[J]. Hum Reprod Update, 2016,22(3).doi:10.1093/humupd/dmv058. |
| [6] | Fang L,Wang YN,Cui XL,et al. The role and mechanism of action of activin A in neurite outgrowth of chicken embryonic dorsal root ganglia[J]. J Cell Sci,2012,125(Pt 6):1500-1507. |
| [7] | Ge J,Wang Y,Liu H,et al. Activin A maintains cerebral cortex neuronal survival and increases voltage-gated Na+ neuronal current[J]. Neural Regen Res,2010,5(19):1464-1469. |
| [8] | Liu HY,Wang YN,Ge JY,et al. Localisation and role of activin receptor-interacting protein 1 in mouse brain[J]. J Neuroendocrinol,2013,25(1):87-95. |
| [9] | Zhang Y,Shan S,Wang J,et al. Galangin inhibits hypertrophic scar formation via ALK5/Smad2/3 signaling pathway[J]. Mol Cell Biochem,2016,413(1/2):109-118. |
| [10] | Yndestad A,Larsen KO,Oie E,et al. Elevated levels of activin A in clinical and experimental pulmonary hypertension[J]. J Appl Physiol (1985), 2009,106(4):1356-1364. |
| [11] | Williamson RD,O'Keeffe GW,Kenny LC. Activin signalling and pre-eclampsia:from genetic risk to pre-symptomatic biomarker[J]. Cytokine,2015,71(2):360-365. |
| [12] | Matzuk MM,Kumar TR,Vassalli A,et al. Functional analysis of activins during mammalian development[J]. Nature,1995,374(6520):354-356. |
| [13] | Matzuk MM,Kumar TR,Bradley A. Different phenotypes for mice deficient in either activins or activin receptor type Ⅱ[J]. Nature,1995,374(6520):356-360. |
| [14] | Matsuki K,Hathaway CK,Lawrence MG,et al. The role of transforming growth factor β1 in the regulation of blood pressure[J]. Curr Hypertens Rev,2014,10(4):223-238. |
| [15] | Lavoie P,Robitaille G,Agharazii M,et al. Neutralization of transforming growth factor-beta attenuates hypertension and prevents renal injury in uremic rats[J]. J Hypertens,2005,23(10):1895-1903. |
| [16] | Kurisaki A,Inoue I,Kurisaki K,et al. Activin induces long-lasting N-methyl-D-aspartate receptor activation via scaffolding PDZ protein activin receptor interacting protein 1[J].Neuroscience,2008,151(4):1225-1235. |
| [17] | Marino FE,Risbridger G,Gold E. The therapeutic potential of blocking the activin signalling pathway[J]. Cytokine Growth Factor Rev,2013,24(5):477-484. |
 2016, Vol. 42
2016, Vol. 42


