扩展功能
文章信息
- 勾向博, 郭静, 白静
- GOU Xiangbo, GUO Jing, BAI Jing
- 吉林大学学报(医学版), 2016, 42(04): 694-698
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 694-698
- 10.13481/j.1671-587x.20160412
-
文章历史
- 收稿日期: 2015-11-29
2. 华北理工大学实验研究中心, 河北 唐山 063000
2. School of Basic Medical Sciences, North China University of Science and Technology, Tangshan 063000, China
2型糖尿病是胰岛素分泌绝对或者相对不足所引起的,其中高血糖在糖尿病的发生发展过程中起重要作用,因为血糖持续升高会导致很多不良结果,最终引起心肌纤维化和胶原沉积。心肌内基质蛋白增加会引起心室功能改变,如收缩舒张功能改变[1],最终引起心力衰竭[2]。在哺乳动物中,转化生长因子β(transforming growth factor,TGF-β)有3种亚型:TGF-β1、TGF-β2和TGF-β3,其中TGF-β1是许多致心肌纤维化的重要因素之一[3]。据研究[4]报道:心肌纤维化致心肌疾病的主要原因之一是TGF-β1表达增多。在糖尿病患者中,血糖水平升高、血管紧张素Ⅱ(angiotensin,AngⅡ)水平升高及胰岛素抵抗均可引起TGF-β1表达水平升高[5]。TGF-β1水平持续升高会通过其受体促进成纤维细胞Ⅰ型和Ⅲ型胶原以及纤维连接蛋白的合成,增加心肌组织细胞外基质(extracellular matrix,ECM)含量,同时还会降低蛋白水解酶的活性,抑制纤溶酶原和胶原酶原等酶原激活物的产生。最终,胶原降解减少以及ECM增加,促进心肌纤维化[6]。在糖尿病大鼠心肌组织中,肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活会导致AngⅡ水平升高,促进纤维细胞胶原合成,最后由蛋白激酶C(protein kinase C,PKC)通路引起TGF-β1表达增加,导致心肌纤维化[7]。
荞麦的主要成分是黄酮。本实验室前期从荞麦不同部位提取了黄酮,其药理作用结果[8, 9]显示:荞麦黄酮可以改善糖尿病症状,降低血糖并且改善肾损伤,并对糖尿病心肌病具有保护作用,但是其具体机制尚不明确。本研究旨在探讨荞麦花叶总黄酮(total flavones of buckwheat flowers and leaves TFBFL)对心肌纤维化是否具有保护作用,并阐明其作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级雄性大鼠40只,体质量(body weight,BW)(200±15)g,购自天津市山川红实验动物科技有限公司[(SCXK(津)2013-0001)],于华北理工大学实验动物中心饲养。所有大鼠均在实验动物中心屏障环境喂养,自由饮水和进食标准饲料。普通饲料和高脂饲料均由北京科奥协力饲料有限公司提供。链脲佐菌素(STZ)购自美国Sigma公司,柠檬酸三钠和柠檬酸购自北京市博爱科贸有限责任公司。电镜(日立H-7650,日本日立公司),转膜仪(DYCZ-40B,北京市六一仪器厂),电泳仪(北京君意东方电泳设备有限公司)。
1.2 TFBFL的制备按Gou等[8]的方法制备TFBFL。荞麦花叶是荞麦未结果的花叶,其经70%乙醇回流提取,提取物用水加热溶解过滤,去除沉淀。加分离剂冷却析出淡黄色结晶,离心,沉淀经70℃烤干即为TFBFL。
1.3 糖尿病动物模型制备及给药40只大鼠用普通饲料适应性喂养1周,随机取8只作为正常对照组,用正常饲料喂养,其余32只大鼠给予高脂饲料(组分:10%蔗糖,10%猪油,5%胆固醇)喂养12周后,每隔1d腹腔注射20 mg·kg-1STZ并同时给予高脂饲料,持续4周后建立2型糖尿病大鼠模型。同时正常对照组大鼠腹腔注射柠檬酸-柠檬酸钠溶液。给药结束后,空腹72 h检测大鼠空腹血糖(FBG),FBG≥10mmol·L-1作为造模成功标准。将造模成功的12只大鼠分为模型组和TFBFL组。给药方案:①正常对照组(n=8) ,10 mL·kg-1·d-1纯净水灌胃;②DM组(n=6),10 mL·kg-1·d-1纯净水灌胃;③TFBFL组(n=6),200 mL·kg-1·d-1 TFBFL灌胃。各组大鼠每天给药1次,连续8周。
1.4 大鼠心功能检测参照勾向博等[9]的方法检测各组大鼠心率(HR)、左心室收缩压(LVSP)、左心室舒张期末压(LVEDP)及左心室内压最大上升和下降速率(±dp/dtmax)。
1.5 透射电镜下观察大鼠心肌组织超微结构大鼠处死后,迅速剪开胸腔,从主动脉根部分离取出心脏,0.9%冰生理盐水灌洗心脏,剪去心脏周围血管以及结缔组织,计算心脏质量指数(heart weight index,HWI)。取左室壁心肌组织1 mm×1 mm×3 mm,迅速置于4% 戊二醛固定液中固定,固定结束后在透射电镜下观察大鼠心肌组织超微结构变化。
1.6 大鼠心肌组织Masson染色取各组大鼠左心室心尖部组织放入10%中性甲醛溶液中固定,梯度酒精脱水、浸蜡、包埋、切片,片厚4 μm,进行Masson染色,光镜下观察心肌细胞呈红色,胶原纤维呈绿色。利用病理图像分析仪,对 Masson 染色胶原定量分析。首先设定窗口面积,每组至少选8个视野,测定窗口范围内的胶原面积。
1.7 Western blotting法检测大鼠心肌组织中TGF-β1蛋白表达水平将提取的各组大鼠左心室心肌膜蛋白进行Western blotting检测,SDS-PAGE电泳分离样品蛋白,4 ℃进行免疫印迹电泳,将PAGE中的蛋白转移到PVDF膜上。孵育一抗(Abcam公司)4℃过夜,洗去一抗,孵育二抗(Beyotime公司)37 ℃、1 h,ECL显色。采用凝胶成像系统的密度分析软件Bio-1D分析样品条带,GAPDH作内参。目的蛋白的灰度值除以内参的灰度值以校正误差,所得结果代表样品的目的蛋白相对表达水平。
1.8 统计学分析采用SPSS10.0软件进行统计学处理。各组大鼠BW、FBG、HWI和心功能各项指标(HR、LVSP、LVEDP和±dp/dtmax)均以 ±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
与正常对照组比较,DM组大鼠BW明显降低(P<0.01),而HWI和FBG水平明显升高(P<0.01)。与DM组比较,TFBFL组大鼠BW和HWI差异无统计学意义(P > 0.05),但FBG水平明显降低(P<0.01)。见表1。
( ±s) ±s) | ||||
| Group | n | BW (m/g ) | HWI[wB/(mg·g-1)] | FBG[cB/(mmol·L-1)] |
| Normal control | 8 | 225.14±10.64 | 2.44±0.24 | 4.21±0.61 |
| DM | 6 | 195.00±13.87* | 4.51±0.21* | 25.92±3.34* |
| TFBFL | 6 | 194.67±18.17 | 4.46±0.21 | 14.73±1.67**△ |
| *P<0.05,** P<0.01 vs normal control group;△P<0.01 vs DM group. | ||||
与正常对照组比较,DM组大鼠LVEDP水平明显升高(P<0.01),而HR、LVSP和±dp/dtmax明显降低(P<0.05或P<0.01)。与DM组比较,TFBFL组大鼠LVEDP明显降低(P<0.01),而HR、LVSP和±dp/dtmax明显升高(P<0.05或P<0.01)。见表2。
( ±s) ±s) | ||||||
| Group | n | HR(min-1) | LVEDP(P/kPa) | LVSP(P/kPa) | +dp/dtmax(kPa·s-1) | -dp/dtmax(kPa·s-1) |
| Normal control | 8 | 480.57±31.26 | 3.51±0.91 | 121.85±4.62 | 3499.90±157.80 | 3307.86±434.52 |
| DM | 6 | 426.33±21.96* | 13.16±3.90** | 95.56±16.08* | 1720.87±72.92** | 1521.18±63.24** |
| TFBFL | 6 | 455.83±21.50△ | 6.24±2.74△△ | 105.43±10.77△ | 2348.84±327.68△△ | 2433.76±549.66△ |
| *P<0.05,** P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs DM group. | ||||||
正常对照组大鼠心肌组织细胞中含有大量排列规则的肌丝,明暗带清晰可见;线粒体呈圆形或者椭圆形,无明显胶原颗粒沉积;心肌细胞间可见闰盘连接,排列整齐。DM组大鼠心肌细胞中肌原纤维含量明显减少;肌丝排列紊乱,部分断裂;肌节长短不一,明暗带不明显;线粒体排列紊乱,部分线粒体肿胀明显,嵴变宽断裂,甚至消失;肌浆网疏松明显,可见有空泡形成。TFBFL组大鼠心肌组织细胞肌原纤维比DM组大鼠有所增加,肌丝排列较整齐,明暗带尚清晰;线粒体轻度肿胀,嵴间隙略有增宽,多数排列整齐,线粒体内空泡结构较少;肌浆网间隙组织疏松不明显,肌浆网内可见少量空泡结构。见图1。
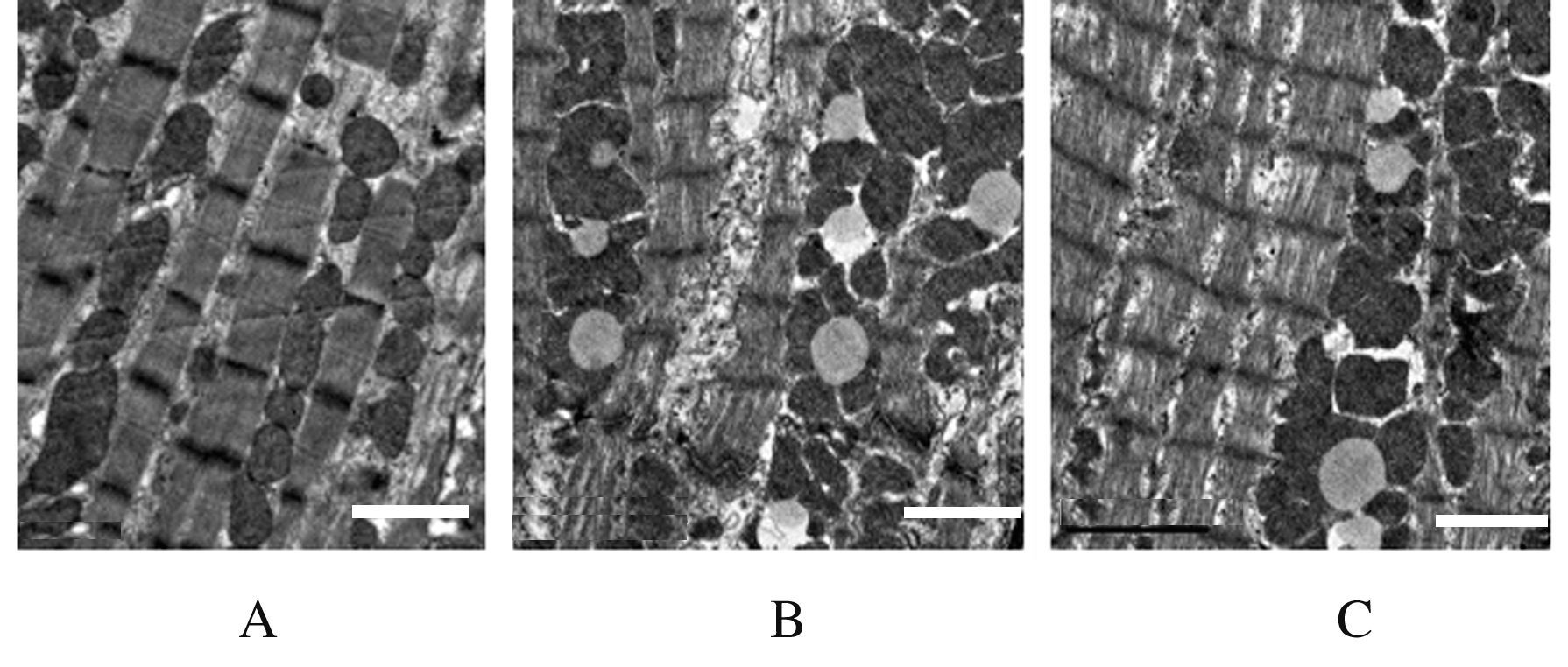
|
| 图1 各组大鼠心肌组织超微结构(bar=2 μm) Fig.1 Ultrastrutures of myocardium tissue of rats in various groups (bar=2 μm) |
正常对照组大鼠心肌组织中仅可见少量绿色斑点,表明其心肌组织中胶原较少;DM组大鼠心肌间质内可见较多胶原沉积;TFBFL组大鼠心肌组织上述改变明显改善(图2,见插页二)。正常对照组、DM组和TFBFL组大鼠心肌组织胶原纤维面积 ( μm2 ) 分别为 3.42 ±1.31、18.13±3.10和8.09 ±3.08,DM组与正常对照组比较差异有统计学意义(P<0.05),TFBFL组与DM组比较差异有统计学意义(P<0.05)。
2.5 各组大鼠心肌组织中TGF-β1蛋白表达水平与对照组比较,DM组大鼠心肌组织中TFG-β1蛋白表达水平明显升高,约为正常对照组的2倍(P<0.05)。与DM组比较,TFBFL组大鼠心肌组织中TFG-β1蛋白表达水平下降约50%(P<0.05)。见图3和4。

|
| 图3 各组大鼠心肌组织中TFG-β1蛋白表达电泳图 Fig.3 Electrophoregram of expressions of TFG-β1 protein in myocardium tissue of rats in various groups |
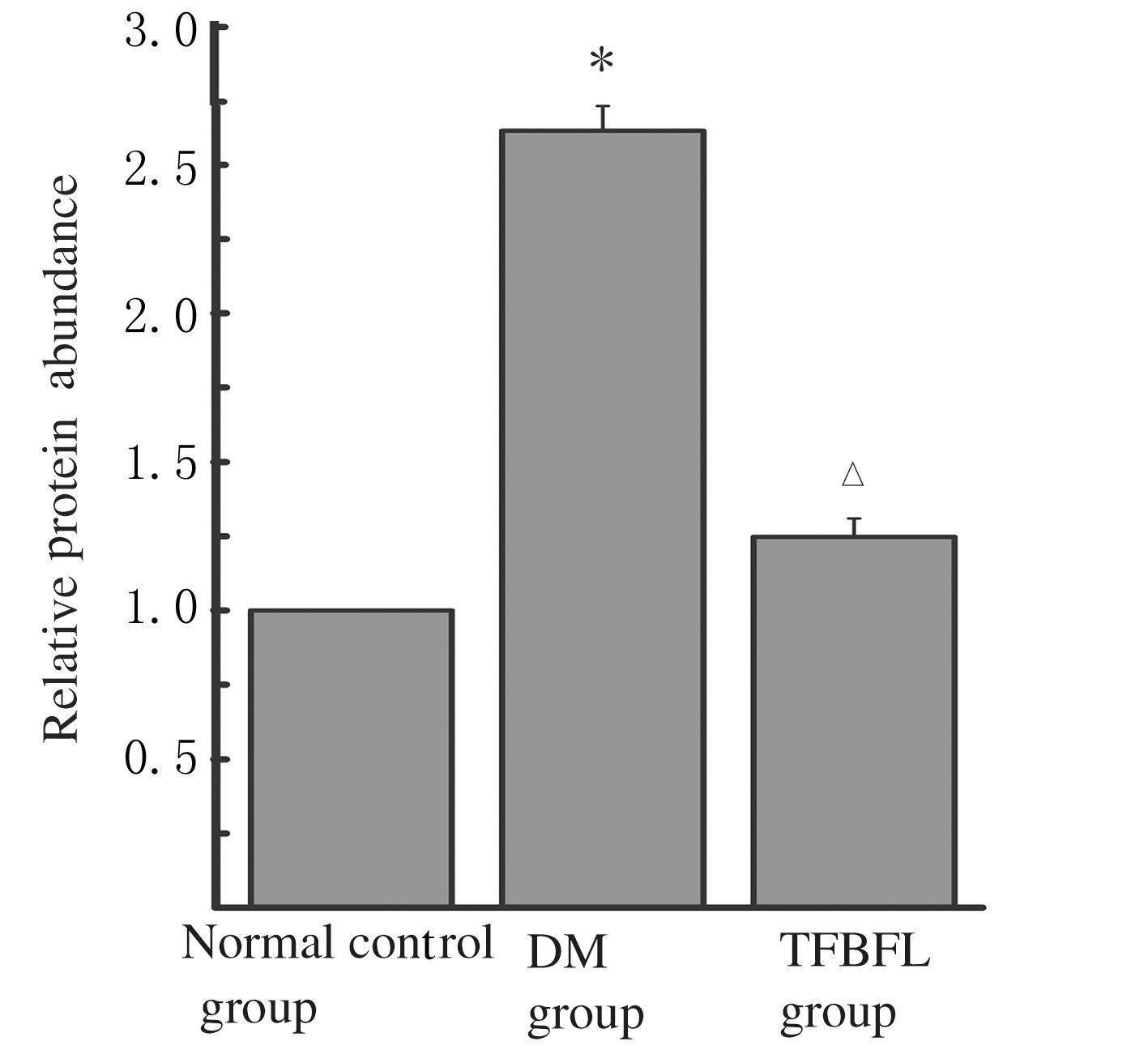
|
| 图4 各组大鼠心肌组织中TFG-β1蛋白表达水平直条图 Fig.4 Histogram of expression levels of TFG-β1 protein in myocardium tissue of rats in various groups |
本研究通过腹腔注射STZ和给予高脂饲料建立糖尿病大鼠模型,以大鼠饥饿72h后血糖大于10 mmol·L-1作为建模成功标准,采用TFBFL作为治疗药物,观察其对糖尿病导致的心肌纤维化是否具有保护作用并探讨其作用机制。本研究结果显示:2型糖尿病大鼠心功能损伤,采用Masson染色和电镜技术可观察到糖尿病大鼠心肌组织形态表现发生改变,心肌纤维化尤其明显;采用TFBFL治疗结果显示:TFBFL可改善糖尿病大鼠心功能,对心肌组织纤维化也具有一定的保护作用。但是,确定TFBFL改善糖尿病心肌纤维的作用靶点尚需要进一步研究。
心肌纤维化与一系列心肌病的发生发展有关。心肌纤维化主要由TGF-β1进行调节,TGF-β1是刺激胶原生成的主要因素。大量文献[4, 10, 11]报道:在过表达TGF-β1和敲除TGF-β1的转基因模型中,TGF-β1是引起心肌纤维化的重要因素。众所周知,在糖尿病的发生发展过程中,RAAS激活会导致AngⅡ水平升高。Wolf等[12]首次报道了肾脏疾病中AngⅡ和TGF-β1的关系。Kupfahl等[13]报道:AngⅡ通过使TGF-β1上调引起胶原合成增加,该作用不是直接作用。胡爽等[14]报道:在心肌组织中,AngⅡ拮抗剂会抑制TGF-β1表达,而且AngⅡ受体阻断剂会降低TGF-β1的表达,从而抑制心肌纤维化,所以TGF-β1是心肌纤维化治疗的靶点。以上报道均显示TGF-β1在糖尿病的发生发展过程中起重要作用,抑制TGF-β1表达会延缓心肌损伤。在临床治疗中,血管紧张素转化酶抑制剂和AngⅡ受体拮抗剂均可抑制TGF-β1表达[14, 15]。本研究结果显示:糖尿病模型组大鼠心肌组织中TGF-β1蛋白表达水平明显升高,TFBFL治疗后大鼠心肌组织中TGF-β1蛋白表达水平降低,这可能是TFBFL改善2型糖尿病大鼠心肌纤维化的一个重要原因。
本研究结果提示:TFBFL对糖尿病大鼠心肌纤维化具有保护作用。本研究结果将为TFBFL用于预防和治疗糖尿病及糖尿病所致的心肌纤维化提供理论依据。
| [1] | Zhang P,Su J,Mende U. Cross talk between cardiacmyocytes and fibroblasts:from multiscale investigative approaches to mechanisms and functional consequences [J]. Am J Physiol Heart Cire Physiol,2012,303 (12):1385-1396. |
| [2] | Udelson JE,Konstam MA. Ventricular remodeling fundamental to the progression (and regression) of hear failure [J]. J Am Coll Cardiol,2011,57(13):1477-1479. |
| [3] | Agrotis A,Kalinina N,Bobik A. Transforming growth factor-beta, Cell signaling and cardiovascular disorders [J]. Curr Vasc Pharmacol,2005,3(1):55-61. |
| [4] | Schultz Jel J,Witt SA,Glascock BJ,et al. TGF-beta1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin Ⅱ [J]. J Clin Invest,2002,109 (6):787-796. |
| [5] | Khan R,Sheppard R. Fibrosis in heart disease:understanding the role of transforming growth factor-beta in cardiomyopathy,valvular disease and arrhythmia[J]. Immunology,2006,118(1):10-24. |
| [6] | Gong W,Yan M,Chen J,et al. Chronic inhibition of cyclic guanosine monophosphate-specific phosphodiesterase 5 prevented cardiac fibrosis through inhibition of transforming growth factor β-induced Smad signaling [J]. Front Med,2014,8 (4): 445-455. |
| [7] | Xu J,Carretero OA,Lin CX,et al. Role of cardiac overexpression of ANG II in the regulation of cardiac function and remodeling postmyocardial infarction[J]. Am J Physiol Heart Circ Physiol,2007,293(3):H1900-H1907. |
| [8] | Gou XB,Han SY,Xu JM, et al. Effect of total flavones of buckwheat flowers and leaves on protein tyrosine phosphatase 1B expression in type 2 diabetic rats [J]. Latin Am J Pharm,2011,30 (7):1377-1382. |
| [9] | 勾向博,郭 静,王银环,等. 荞麦糠皮提取物对2型糖尿病大鼠心功能的改善作用[J]. 吉林大学学报:医学版,2013,39(6):1215-1219. |
| [10] | Nakajima H,Nakajima HO,Salcher O,et al. Atrial but not ventricular fibrosis in mice expressing a mutant transforming growth factor-beta(1) transgene in the heart [J]. Circ Res,2000,86 (5):571-579. |
| [11] | Rosenkranz S,Flesch M,Amann K,et al. Alterations of beta-adrenergic signaling and cardiac hypertrophy in transgenic mice overexpressing TGF-beta1 [J]. Am J Physiol Heart Circ Physiol,2002,283(3):H1253-H1262. |
| [12] | Wolf G. Link between angiotensin Ⅱ and TGF-beta in the kidney [J]. Miner Electrolyte Metab,1998,24 (2/3):174-180. |
| [13] | Kupfahl C,Pink D,Friedrich K, et al. Angiotensin Ⅱ directly increases transforming growth factor beta 1 and osteopontin and indirectly affects collagen mRNA expression in the human heart [J]. Cardiovasc Res,2000,46 (3):463-475. |
| [14] | 胡 爽,于俊民,张小波,等. 血管紧张素Ⅱ受体拮抗剂抑制心肌纤维化的研究进展[J]. 临床心血管病杂志,2014,30(12):1022-1024. |
| [15] | Laviades C,Varo N,Diez J. Transforming growth factor beta in hypertensives with cardiorenal damage [J]. Hypertension,2000,36 (4):517-522. |
 2016, Vol. 42
2016, Vol. 42


