扩展功能
文章信息
- 张云平, 李仰康, 刘晨阳, 祝加慧, 吴仁华
- ZHANG Yunping, LI Yangkang, LIU Chenyang, ZHU Jiahui, WU Renhua
- 吉林大学学报(医学版), 2016, 42(04): 690-693
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 690-693
- 10.13481/j.1671-587x.20160411
-
文章历史
- 收稿日期: 2015-11-14
2. 汕头大学医学院附属肿瘤医院放射科, 广东 汕头 515031;
3. 江苏省泰兴市人民医院核医学科, 江苏 泰兴225400;
4. 汕头大学医学院医学影像教研室, 广东 汕头 515031
2. Department of Radiology, Affiliated Tumor Hospital, College of Medical Sciences, Shantou University Shantou 515031, China;
3. Department of Nuclear Medicine, Taixing People's Hospital, Jiangsu Province, Taixing 225400, China;
4. Teaching and Research Section of Medical Imaging, College of Medical Sciences Shantou University, Shantou 515031, China
脑缺血缺氧后果严重,早期发现和诊断是治疗关键。脑缺血缺氧早期,大脑细胞形态尚未发生变化,但脑代谢物乳酸已明显变化[1]。乳酸是葡萄糖无氧酵解的中间产物,乳酸的水平变化可反映大脑缺氧及组织代谢情况,是诊断急性脑缺血缺氧的敏感指标。目前,检测乳酸的方法很多,3.0T磁共振频谱测定活体脑代谢物乳酸等已广泛用于临床,9.4 T高场磁共振频谱(9.4T 1H-MRS)等更高场强频谱测量各种代谢物也处于临床前阶段,但样本制备期间的脑代谢变化研究尚未见报道。本研究采用9.4T 1H-MRS测定急性脑缺血缺氧早期小鼠脑组织中乳酸水平,旨在提供样本制备期脑组织中乳酸水平变化的时间窗,为临床上使用9.4T 1H-MRS准确测定脑乳酸代谢水平提供数据支持。
1 材料与方法 1.1 实验动物、主要试剂和仪器昆明小白鼠(汕头大学医学院实验动物中心提供)80只,雄雌各半,体质量22~25g。0.5 mmol·L-1高氯酸 和0.5 mmol·L-1 NaOH(分析纯,美国Sigma公司),两者使用前均以双蒸水配制储存于棕色试剂瓶待用;重水(D2O)(美国CIL公司,氘代率>99.8%)。高效液相色谱仪(德国Sartorius AG公司),AM-400型超导频谱仪 [9.4T高场磁共振频谱(9.4T 1H-MRS)]( 德国Bruker公司)。
1.2 动物分组80只小鼠禁食一夜,随机分为16组,分别为缺血缺氧0、20、40、60 s和2、3、4、5、6、8、10、12、14、16、18、20 min组(以缺血缺氧0s组为对照组),每组5只。各组小鼠断头处死,将鼠头置37 ℃环境下,装入标有编号的PVP塑料袋中,按0、20、40、60 s和2、3、4、5、6、8、10、12、14、16、18、20 min时间点停留后,投入液态氮中,终止脑代谢,以备分析用。
1.3 标本处理将鼠头从液态氮中取出,置于-10 ℃环境下,用剪刀将冻鼠头从中间剪开取全脑称质量后,放入盛有0 ℃的0.5 mmol·L-1高氯酸的5 mL离心管中,按每100 mg加入1.2 mL的比例加入高氯酸,作为匀桨媒介及去蛋白剂,并将离心管置于冰水浴中,以3 000g匀浆10 min,将匀浆液转移到低温离心机,以10 000g离心10 min,上清液以0.5 mmol·L-1 KOH中和滴定至pH值6.8,上低温离心机以10 000g 离心10 min,去掉高氯酸盐,上清液-70 ℃冻存,以备分析使用。将上述去掉高氯酸盐的液体融解后,过离子交换柱(Chelex 100,Naform,50~100 目)以去掉多余离子,低温冻干恒重。取样品少许,称量取样前、后2次样品总质量求其差而得出样品质量,以备检测用。
1.4 小鼠脑组织中乳酸水平检测将准确称质量的乳酸样品溶解于5 mL重水中,再次通过离子交换树脂,调节pH值至7.3后,加入0.5 mL D2O[含化学位移的参照物3-三甲基硅丙烷磺酸钠(DSS ,10 mmol·L-1):0.00 ppm],装入5 mL MRS管中待测。频谱测定条件:观察频率400 MHz,谱宽4854 Hz,脉冲宽度9 s(900脉冲),累加次数>1 000 次,数据16 K,回波时间(TE)=300 ms。
1.5 乳酸水平计算采用Win-NMR软件分析,根据谱线位置(-ppm)认定某种代谢产物,DSS为内参照,具体数值:DSS在0.00 ppm处,乳酸在1.33 ppm处,用Win-NMR软件计算目标谱线乳酸峰积分面积(每个谱线峰积分面积测量3次,取平均值),根据乳酸峰积分面积与DSS谱线峰积分面积的比值,计算出代谢物乳酸在D2O中浓度,最终反推计算出乳酸浓度( μmol·g-1)。代谢物水平=(代谢物峰面积/DSS峰面积)×(代谢物H质子数/DSS的H质子数)×DSS;DSS分子式为C6H15NaO3SSi(H质子数:15),乳酸分子式C3H6O3(H质子数:6)[1]。
1.6 统计学分析采用SPSS 12.0软件进行统计学分析。小鼠脑组织中乳酸水平以 ±s表示,组间比较采用配对t检验。以P< 0.05为差异有统计学意义。
±s表示,组间比较采用配对t检验。以P< 0.05为差异有统计学意义。
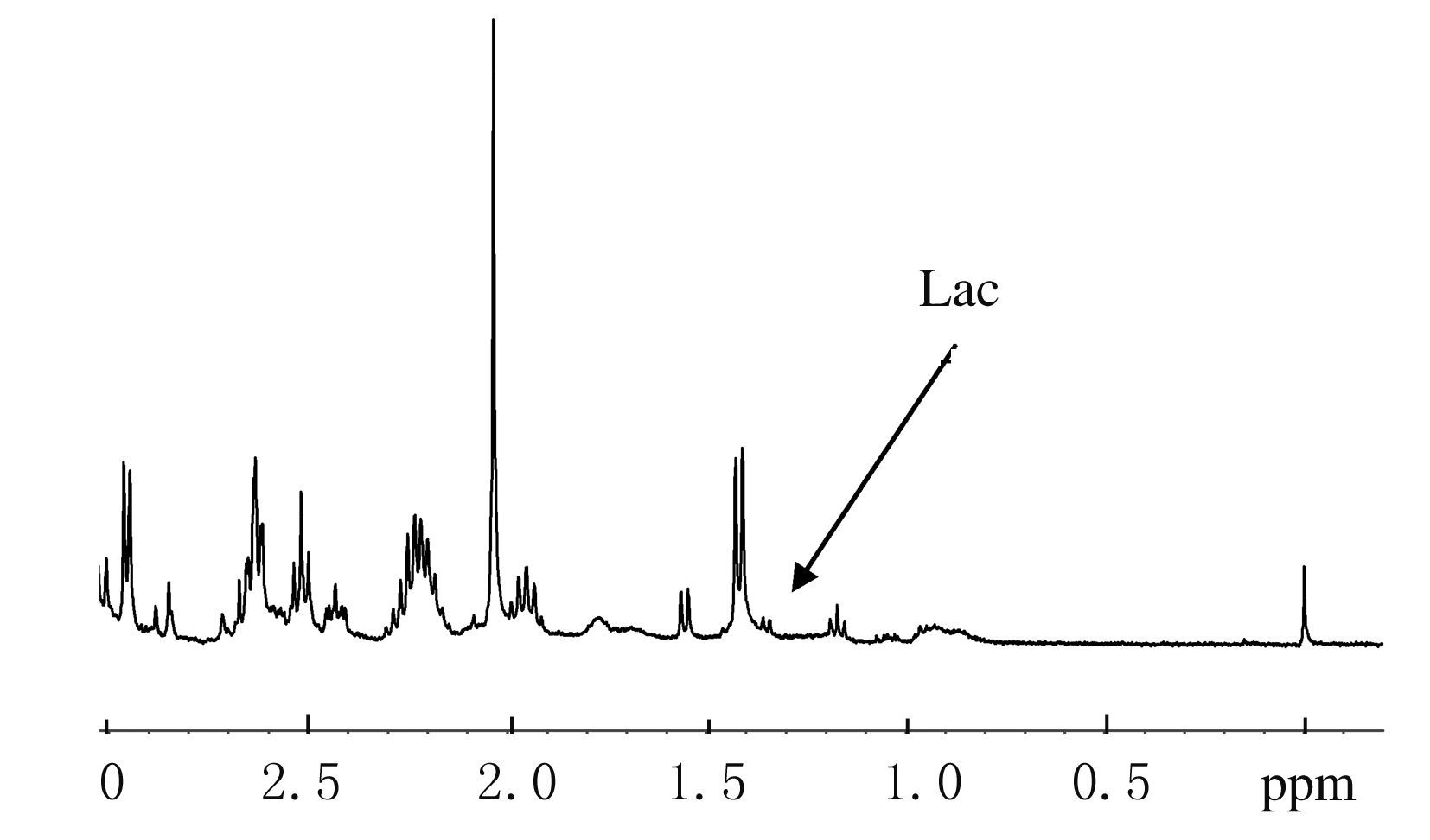
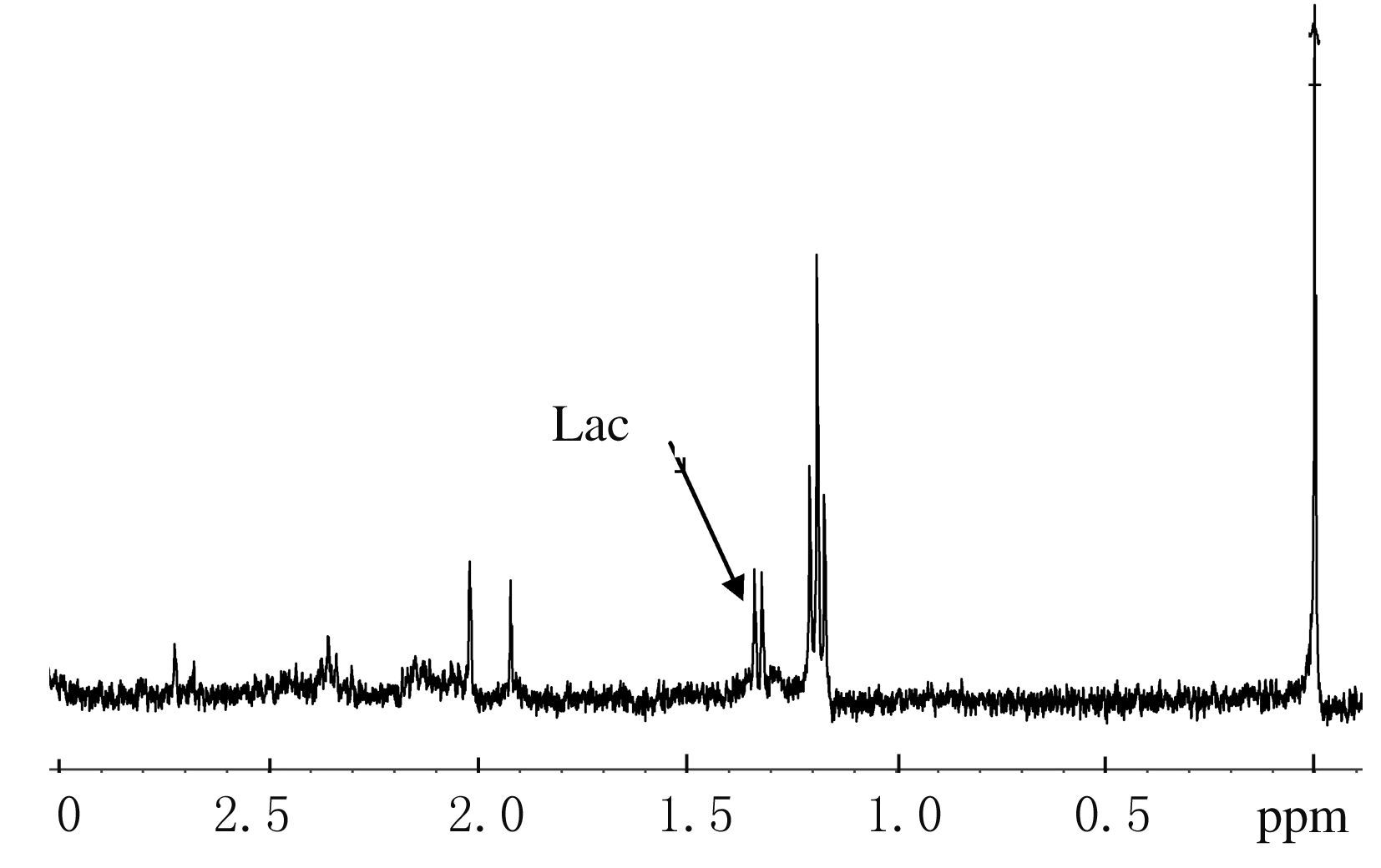
与对照组比较,各组小鼠脑组织中乳酸水平均有不同程度升高。对照组及缺血缺氧20s组小鼠脑9.4T 1H-MRS频谱图见图1和2。在9.4T 1H-MRS频谱上,检测到的主要化合物为乳酸,位置在1.33 ppm处。
|
| 图1 对照组小鼠脑组织9.4T 1H-MRS频谱图 Fig.1 Spectrum of 9.4T 1H-MRS for brain tissue of mice in control group |
|
| 图2 缺血缺氧20 s组小鼠脑组织9.4T1H-MRS频谱图 Fig.2 Spectrum of 9.4T1H-MRS for brain tissue of mice in 20s hypoxia-ischemia group |
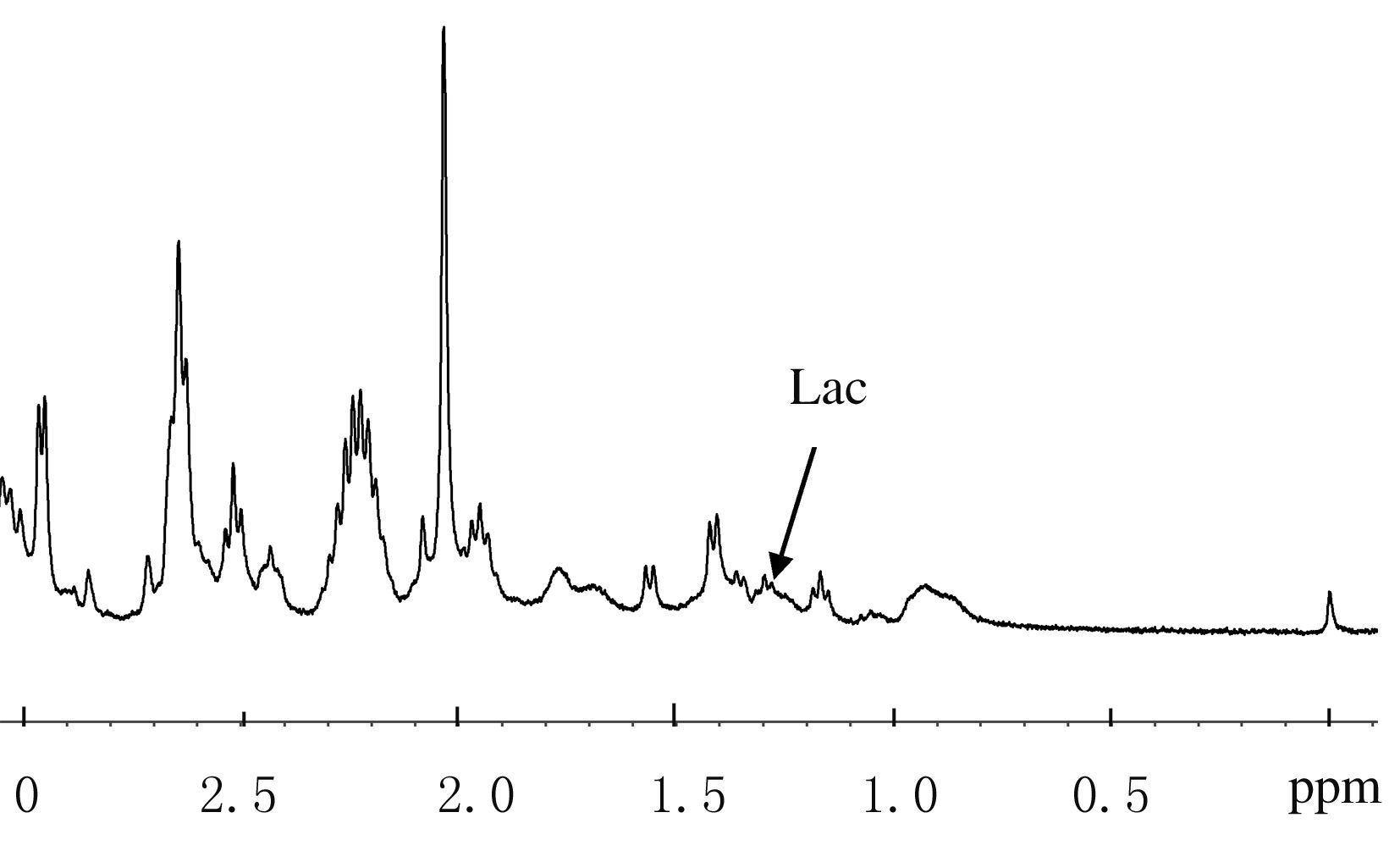
小鼠脑组织中乳酸水平在脑缺血缺氧20s时升至最高点[(6.89±0.34) μmol·g-1],缺血缺氧40s时下降至(6.88±0.56 ) μmol·g-1,缺血缺氧6min达最低点[(4.85±0.36) μmol·g-1](图3),6 min后乳酸水平下降不明显。与对照组比较,缺血缺氧不同时间组小鼠脑组织中乳酸水平差异均有统计学意义(P<0.01)。见表1。
|
| 图3 缺血缺氧6 min组小鼠脑组织9.4T 1H-MRS频谱图 Fig.3 Spectrum of 9.4T 1H-MRS for brain tissue of mice in 6 min hypoxia-ischemia group |
[n=5, ±s,mB/(μmol·g-1)] ±s,mB/(μmol·g-1)] | |
| Group | Lactate level |
| Control | 1.53±0.25 |
| Hypoxia-ischemia | |
| 20 s | 6.89±0.34* |
| 40 s | 6.88±0.56* |
| 60 s | 6.32±0.64* |
| 2 min | 6.11±0.66* |
| 3 min | 5.56±0.36* |
| 4 min | 5.23±0.58* |
| 5 min | 5.01±0.86* |
| 6 min | 4.85±0.36* |
| 8 min | 4.89±0.67* |
| 10 min | 5.12±0.32* |
| 12 mim | 5.55±0.66* |
| 14 min | 5.86±0.68* |
| 16 min | 5.68±0.36* |
| 18 min | 5.66±0.45* |
| 20 min | 5.98±0.31* |
| *P<0.01 compared with control group. | |
乳酸主要由大脑星形胶质细胞产生[2],正常生理条件下,脑内乳酸水平保持在0.8~1.1 μmol·g-1平衡状态[3],在急性脑缺血缺氧超早期,乳酸水平变化最早出现[4]。大脑缺血缺氧的首发事件是能量ATP缺少,ATP/ADP比值降低,激活糖无氧酵解的关键酶——磷酸果糖激酶(PFK),糖原无氧酵解产生ATP和乳酸。本研究结果显示:缺血缺氧20s时小鼠脑组织中乳酸水平就会升到峰值。国外学者[5]发现:乳酸开始上升的时间最短可能小于10 s,是迄今为止在所有类型细胞中记录到的最迅速的葡萄糖转运,这种作用的短时性适于星形胶质细胞快速地释放葡萄糖代谢中间产物乳酸为神经元提供能源。分析乳酸峰值时间差距的存在可能与实验动物的不同和实验方法不同有关。本研究中缺血缺氧小鼠脑组织中乳酸峰值为(6.89±0.34) μmol·g-1 ,而国外有学者[6]证实脑缺血缺氧可导致脑组织中乳酸水平升高至20~25 μmol·g-1 。分析可能与如下因素有关:1完全缺血缺氧,大脑的糖原储备很少,无持续的糖元供应;2乳酸堆积,使pH值降低而抑制了乳酸脱氢酶(LDH)的活性。本研究同时显示:缺血缺氧40s后乳酸开始下降,6 min出现低水平延长而不是持续的升高,本文作者认为是由于乳酸再次被神经元利用进一步产能。乳酸在无氧的条件下作为神经元的能量底物已经有一些报道,但要具备一定的条件:要有Na+,K+-ATPase、LDH同工酶和单碳酸转运体2(MCT2 )[7]存在,而大脑神经元具备上述条件[8]。乳酸由星形胶质细胞产生而被神经元氧化利用,可能大脑通过这样一种机制来保护急性缺血缺氧时的神经元损伤。有研究[9, 10]证明:急性缺血缺氧的条件下,在急性缺血缺氧早期细胞外液中观察不到乳酸,而在外循环中存在乳酸,可见神经元可以利用乳酸作为能量的底物,说明细胞外液中的乳酸已经被利用。同样Schurr 等[11]也证实:细胞外液堆积的乳酸可被缺氧条件下的细胞利用。以乳酸为单一的能量底物来培养大脑海马细胞的切片,持续数小时未见到异常改变[12]。已知脑组织中广泛存在LDH及其同功酶,有实验及临床观察证明脑缺血时脑组织LDH释放增加[13]。相反,将这些培养的大脑切片混以葡萄糖阻断剂(iodoacetic acid)时,有乳酸支持的突触功能未受影响,说明乳酸可以直接进入三羧酸循环被利用而产能,乳酸可被神经元利用[14]。但是,当缺血缺氧持续,能量代谢进一步发生障碍时,则乳酸的利用也出现停止。本研究结果表明:急性脑缺血缺氧40s可能是小鼠脑神经细胞开始利用乳酸的时间阈。本研究结果为使用9.4T1H-MRS研究脑组织乳酸代谢提供了准确的时间窗。
| [1] | Serres S,Bezancon E,Franconi JM,et al. Exvivo analysis of lactate and glucose metabolism in the rat brain under different states of depressed activity[J]. Biol Chem,2004,279(46):47881-47889. |
| [2] | Ainscow EK,Mirshamsi S,Tang T,et al. Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones:evidence for ATP-independent control of ATP-sensitive K+ Channels[J]. J Physiol(Lond),2002,544(Pt 2): 429-445. |
| [3] | Farooqui AA,Haun SE,Horrocks LA. Ischemia and hypoxia[A]. Basic Neurochemistry[M]. New York:Raven Press,1993:867-883. |
| [4] | 章 桃,聂婷婷,贾岩龙,等. 超急性脑卒中血脑屏障和相关脑代谢物变化的研究[J].磁共振成像,2014,5(6):473-478. |
| [5] | Loaiza A,Porras OH,Barros LF. Glutamate triggers rapid glucose transport stimulation in astrocytes as evidenced by real-time confocal microscopy[J]. J Neurosci,2003,23(19):7337-7342. |
| [6] | Nordström CH,Siesjö BK. Effects of phenobarbital in cerebral ischemia PartⅠ:cerebral energy metabolism during pronounced incomplete ischemia[J].Stroke,1978,9:327-335. |
| [7] | Pellerin L,Pellegri G,Martin JL,et al. Expression of monocarboxylate transporter mRNAs in mouse brain:Support for a distinct role of lactate as an energy substrate for the neonatal vs. adult brain[J]. Proc Natl Acad Sci U S A,1998,95 (7):3990-3995. |
| [8] | Pellerin L, Pellegri G,Bittar G,et al. Evidence supporting the existence of an activity-dependent astrocyte-neuron lactate shuttle[J]. Dev Neurosci,1998,20(4):291-299. |
| [9] | Pigula FA,Siewers RD,Nemoto EM,et al. Nemoto,Hypothermic cardiopulmonary bypass alters oxygen/glucose uptake in the pediatric brain[J]. J Thorac Cardiovasc Surg,2001,121(2):366-373. |
| [10] | Siesjö BK. Brain energy metabolism and catecholaminergic activity in hypoxia,hypercapnia and ischemia[J]. J Neural Transm Suppl,1978(14):17-22. |
| [11] | Schurr A,Miller JJ,Payne1 RS,et al. An increase in lactate output by brain tissue serves to meet the energy needs of glutamate-activated neurons[J].J Neurosci,1999,19(1):34-39. |
| [12] | Schurr A,West CA,Rigor BM. Lactate-supported synaptic function in the rat hippocampal slice preparation[J]. Science,1988,240(4857):1326-1328. |
| [13] | Lesiuk H,Suther LG,Pelling J.Effect of 740067 on brain ischemia in rats[J]. Stroke,1991,22(5):896-897. |
| [14] | Ohtsuki T,Ruetzler CA,Tasaki K,et al. Interleukin-1 mediates induction of tolerance to global ischemia in gerbil hippocampal CA1 neurons[J].J Cereb Blood Flow Metab,1996,16(6):1137-1142. |
 2016, Vol. 42
2016, Vol. 42


