扩展功能
文章信息
- 宋志强, 沈海山, 沈俊, 吴建臣, 张明, 李然伟, 张继珍, 李胜文
- SONG Zhiqiang, SHEN Haishan, SHEN Jun, WU Jianchen, ZHANG Ming, LI Ranwei, ZHANG Jizhen, LI Shengwen
- 吉林大学学报(医学版), 2016, 42(04): 685-689
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 685-689
- 10.13481/j.1671-587x.20160410
-
文章历史
- 收稿日期: 2015-12-12
2. 清华大学第一附属医院泌尿外科, 北京 100016;
3. 吉林大学 第二医院泌尿外科, 吉林 长春 130041
2. Department of Urology, First Hospital of Tsinghua University, Beijing 100016, China;
3. Department of Urology, Second Hospital, Jilin University, Changchun 130041, China
膀胱癌是泌尿生殖系统最常见的恶性肿瘤之一,据美国国家癌症研究所[1]统计:2016年美国膀胱癌估计新发病例在所有肿瘤中居第5位,在男性患者中居第4位。建立理想的膀胱癌动物模型能够较好地再现疾病,对研究膀胱肿瘤发病机制、病理生理过程、诊断及筛选治疗药物和评价治疗效果等都具有非常重要的意义。动物疾病模型建立是进一步研究的基础,因此模型的鉴定决定着后续实验结果的真实性和准确性。有创检查容易干扰动物模型,影响后续实验结果,而对于动物模型的无创检查,国内外的报道较少。本研究采用N-甲基亚硝基脲(N-methyl-nitrosourea,MNU)作为诱癌剂建立大鼠原位膀胱癌模型,并通过磁共振成像技术(magnetic resonance imaging,MRI)对模型进行体外无创鉴定,探讨大鼠原位膀胱癌动物模型的建立及模型无创鉴定方法,以期为膀胱肿瘤的深入研究提供良好的动物模型,并对后续实验结果的评价和指导提供有效方法。
1 材料与方法 1.1 主要试剂和仪器MNU购于美国Sigma公司,枸橼酸、水合氯醛购于国药集团化学试剂有限公司,氢氧化钠、浓盐酸购于北京化学试剂公司。 MNU溶液配制:实验前分装MNU,用0.1mmol·L-1枸橼酸缓冲液(pH 6.0)20mL溶解MNU,配制成终浓度为10g·L-1的MNU溶液。 CKX-41倒置显微镜购于日本O lympus 公司,Philips Achieva 3.0T TX磁共振成像系统由清华大学生物医学影像研究中心提供,镊子、剪刀、手术刀柄和刀片购自上海医疗器械公司。 自制大鼠导尿管:选择F3-1型(1.0mm)一次性硬膜外麻醉导管(购于常州迈创医疗器械有限公司),头端保留同时裁剪至10.0cm,尾端连接导管接头。
1.2 实验动物与分组SPF级雌性SD大鼠60只,7~8周龄,体质量(200.0±5.2)g,由清华大学实验动物中心提供,合格证号:SCXK(京)2009-0011,动物处理过程在屏障动物实验室进行。大鼠分为实验组45只和对照组15只,用染色法标记。饲养条件:SPF级动物实验室,常规饮食,12h昼夜节律,湿度50%~60%,温度24~26℃。实验过程按照实验动物3R原则给予大鼠人道关怀。
1.3 MNU法制备大鼠原位膀胱癌模型10%水合氯醛(3.0mL·100g-1)腹腔注射麻醉,起效后大鼠仰卧固定,1‰新洁尔灭消毒会阴部2次。确认并上提尿道外口,用蘸有石蜡油的自制导尿管从尿道外口沿后壁缓慢插入,插入约1 cm时可有阻力感,此时暂停插入,向鼠尾压导尿管并调整导尿管插入方向与鼠尾平行,再缓慢插入膀胱。插入导尿管3~4 cm后可有明显的阻碍感,此时导尿管已位于膀胱内,抽净尿液,实验组大鼠 每只 注射MNU溶液0.2 mL,对照组大鼠注射生理盐水每只0.2 mL。每2周灌注1次,共计4次,灌注完毕后撤出导尿管,轻柔夹闭尿道外口约15 min。
1.4 MRI扫描使用3.0T TX磁共振成像系统,扫描层厚1.0 mm,于实验第14周末,对2组大鼠麻醉后进行腹腔MRI扫描,观察扫描图像。
1.5 标本制备MRI扫描后大鼠行CO2吸入处死,解剖大鼠,观察大鼠泌尿系统有无病变,取新鲜膀胱组织浸于10%甲醛中固定24 h,常规石蜡包埋,切片厚4~5 μm,切片经脱蜡、梯度乙醇脱水后,苏木素染色5min,盐酸乙醇分化30s,水洗返蓝后伊红染色2 min,常规脱水、透明、封片,在光镜下观察膀胱组织病理表现。
1.6 统计学分析采用SPSS 18.0统计软件进行统计学分析。各组大鼠成瘤率和死亡率以百分率表示,组间比较采用四格表χ2检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组大鼠一般情况观察结果SD大鼠麻醉起效时间为3~5min,麻醉后约2h开始苏醒,4h完全恢复正常活动。实验过程中,实验组大鼠死亡2只(1只于实验第7天死亡,尸体解剖见腹腔肠管严重黏连,部分肠管闭塞;1只于实验第15天死亡,尸体解剖见大鼠气道内大量黏液瘀滞)。对照组大鼠死亡1只(因麻醉药过量死亡)。
2.2 大鼠原位膀胱癌模型建立结果第14周末,实验组大鼠成瘤率100%(43/43),存活率95.6%,死亡率4.4%(2/45);对照组大鼠成瘤率0%(0/14),存活率93.3%,死亡率6.7%(1/15)。2组大鼠成瘤率比较差异有统计学意义(P<0.05),死亡率比较差异无统计学意义(P>0.05)。MRI扫描大鼠膀胱癌模型成瘤率及浸润深度的结果与病理组织学检查结果一致,符合率为100%。
2.3 各组大鼠膀胱MRI检测结果对照组大鼠膀胱充盈良好,膀胱壁厚度均匀,未见异常信号影(图1A 和图1D)。实验组大鼠膀胱内有不同程度的异常信号,表现为单发或多发的乳头状或菜花状肿物凸向膀胱腔内,局部膀胱壁不规则增厚;病变T1WI呈软组织信号(等信号)(图1B 和图1C),T2WI病变呈等信号,在高信号的尿液中病变常呈稍低信号或被覆盖,正常膀胱壁低信号带欠完整(图1E 和图1F)。其中1只大鼠可见膀胱腔内有多个结石影及双侧输尿管明显扩张(图1C 和图1F)。
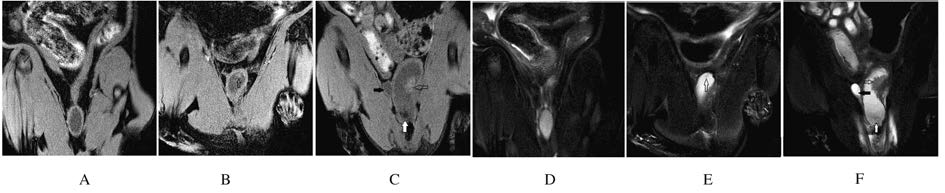
|
| A-C:T1WI;D-F:T2WI;A,D:Control group;B,C,E,F:Experiment group;Hollow arrow:Bladder cancer;Solid black arrow:Dilated ureter;Solid white arrow:Bladder stone. 图1 各组大鼠膀胱MRI扫描结果 Fig.1 MRI scaning results of bladder of rats in various groups |
大体观察结果:对照组14只大鼠膀胱壁厚度均匀,黏膜光滑,未见肿块或新生物等(图2A,见插页二);实验组43只大鼠膀胱黏膜均出现异常,可见菜花样肿块或米粒样新生物(图2 B,见插页二),其中 9只出现局部黏膜不规则增厚,1只出现双侧输尿管扩张积水伴膀胱结石(图2 C,见插页二)。
光镜下观察:对照组大鼠膀胱壁黏膜上皮由2~3层移行上皮细胞组成,细胞扁平,大小均匀,排列规则,核圆,细胞核浆比例1∶4~1∶6,由内向外依次为黏膜层、固有层、肌层和浆肌层;实验组大鼠膀胱黏膜上皮表现为黏膜细胞大小不一致,移行上皮细胞层数明显增加,排列紊乱,极像消失,核大不规则,核染色质为颗粒状,分布不均,核膜增厚,核仁肥大,核质比例增大,核分裂相明显。见图3 (插页二)。
3 讨 论膀胱癌是我国泌尿生殖系统最常见的恶性肿瘤,但其发病机制尚不清楚,目前认为膀胱癌的发生发展是多因素联合作用导致的[2]。构建膀胱癌动物模型,对研究膀胱癌的病因、诊断、治疗及预防等具有重要意义。膀胱癌动物模型构建方法有很多种,皮下移植瘤建立动物模型在肿瘤研究中较常用,有诱癌周期短、观察方便等优点[3],但该方法建立的肿瘤模型易出现动物免疫排斥反应,对动物损伤大,易造成种植性转移[4],从而导致建模失败;另外,该模型肿瘤的生物学行为亦不同于原位生长的肿瘤[5],限制了其在研究中的应用。原位膀胱癌模型能更好地反映临床肿瘤的特点,另外由于膀胱通过尿道与外界相通的特点,使得原位膀胱癌动物模型在膀胱癌腔内灌注治疗研究中具有重要意义。
自1972年Hicks等[6]首次报道利用MNU快速诱导建立大鼠膀胱癌模型以来,化学诱癌剂诱发法得到了大力推崇。常用的化学诱癌剂主要有MNU、N-正丁基-N-(4-羟基-丁基)亚硝胺(BBN)等。MNU为直接致癌剂,经膀胱灌注诱发肿瘤;BBN为间接致癌剂,经口投入。膀胱中致癌物的持续刺激是膀胱癌的发生和复发的重要因素之一[3],与经胃肠给药比较,膀胱灌注给药剂量控制更精确,药物局限于膀胱内可最大程度地减小对大鼠其他器官的损害,因此本研究选择MNU法构建大鼠原位膀胱癌模型。本研究实验组45只大鼠中,43只大鼠在实验期间生存良好,无明显异常症状,经MRI扫描检测及病理组织学检查确定成瘤,非肿瘤因素死亡2只,成瘤率与张祥等[7]和Li等[8]实验结果相似;对照组除1只大鼠因麻醉引起窒息死亡外,14只大鼠经检查无肿瘤形成;2组大鼠成瘤率比较差异有统计学意义,而死亡率比较差异无统计学意义。本研究中病理组织学检查结果显示:MNU法诱导的膀胱肿瘤为移行上皮细胞癌,其形态学和病理学特征与人膀胱癌相似,与吴志平等[9]报道的结果一致。理想的原位膀胱癌模型应持人道和科学的态度对待实验动物,遵循“替代”、“减少”、“优化”的“3R”原则[10],维护实验动物的福利与伦理。有研究[7]结果显示:MNU法构建大鼠原位膀胱癌模型较BBN法成瘤率更高,而动物死亡率更低。因此MNU诱导大鼠原位膀胱癌模型方法简单、高效,是一种理想的膀胱癌建模方法。
尽管MNU法建立大鼠原位膀胱癌模型简单、高效,但仍有不足[11],反复经尿道膀胱灌注药物可能引起尿道损伤、继发尿路感染和产生膀胱结石。本研究结果显示:实验组大鼠经MRI检查及解剖观察确定,1例大鼠出现双侧输尿管扩张及膀胱内结石生成。提高建模成功率同时减少并发症发生应注意以下几点:①MNU在pH为6.0时其半衰期最长[12],因此本实验使用pH6.0的枸橼酸缓冲液进行MNU溶液配制,现用现配,确保MNU诱癌的作用时间;②导尿管的选择。利用长约10cm的一次性硬膜外麻醉导管制成自制导尿管,此种导尿管头端圆钝,插入过程中能减少对尿道的损伤,同时导尿管上自带刻度,可根据导尿管进入长度预估插管位置,及时改变插入方向等;③实验前自制导尿管严格消毒,同时消毒大鼠会阴部,尽量减少大鼠继发尿路感染及膀胱结石的产生;④插入导尿管后,应尽量回吸并排空尿液,以保证膀胱内药物浓度,拔除导尿管后,应间断夹闭尿道外口约15 min,保证灌注药物与膀胱黏膜充分接触。
模型鉴定在膀胱癌动物模型构建及基于动物模型的后续实验中有重要意义。病理组织学检查是鉴定模型的金标准,但病理取材需处死动物,无法进行基于动物模型的药物活体研究。解剖观察再缝合膀胱可以观察建模效果,但模型动物常因感染、肿瘤种植转移而出现应激反应甚至死亡,严重影响基于动物模型的后续实验的进行。Asanuma等[13]采用0.75 mm超细膀胱镜可发现直径约1mm的肿瘤,但易造成模型动物尿道损伤、感染,并且由于使用的器械特殊等不足,限制了其在大鼠膀胱癌模型鉴定中的应用。超声[7]、CT[14]检查也可对大鼠模型进行鉴定,但超声对肿瘤空间定位能力差,存在肿瘤重复检测的可能;CT的放射性可能改变肿瘤的生物学行为,影响基于模型的后续实验结果,因此在大鼠模型鉴定中应用较少。也有学者通过生物发光技术鉴定模型 [15],但该技术尚不成熟,化学发光剂是否影响肿瘤生物学行为还有待进一步研究。MRI可通过横切面、矢状面和冠状面扫描发现早期肿瘤并精确定位,同时可以观察肿瘤浸润深度。本研究以在有效鉴定大鼠原位膀胱癌模型的同时尽量避免或减小检测技术对肿瘤及动物造成不良干预为标准,选择MRI对大鼠进行肿瘤建模的鉴定,结果显示:实验组43只大鼠膀胱内均可见肿瘤生成,对照组14只大鼠未见肿瘤,与病理检查结果一致,确诊率达100%。Xiao等[5]采用MRI检测能够发现直径2.0mm的肿瘤,随着MRI技术与设备的不断革新,新的MRI能够检测更微小的病灶。本研究使用3.0T MRI扫描层厚1.0mm,可以清晰地观察到膀胱壁上直径大于1.0mm的肿物。MRI检测耗时较长,为减少检测时间,降低检测成本,本研究以第一只大鼠扫描结果为参照设定参数,后续大鼠扫描参数进行微调,检测时间由每只(30.0±3.8) min降至每只(15.0±2.3) min。应用MRI监测肿瘤模型可发现早期浅表性肿瘤[16],还可用于筛除与后续实验要求不符的肿瘤模型,这为肿瘤模型后续研究的顺利进行提供了支持与保障。
综上所述,MNU法制备大鼠原位膀胱癌模型,方法简单,成瘤率高,对动物损伤小,在保证后续实验基础上可极大减少动物使用量。利用MRI扫描检测建模效果对动物无创,对后续实验无干扰,避免了因模型鉴定处死动物而增加的动物使用量,还可对模型肿瘤进行动态监测,筛除不符合条件的模型动物。MRI是一种理想的模型鉴定及监测方法。
| [1] | Sieqel RL,Miller KD,Jemal A. Cancer statistics,2016[J]. CA Cancer J Clin,2016,66(1):7-30. |
| [2] | 刘中阳,闫泽晨,郑 豪,等.膀胱癌相关基因的研究现状与展望[J]. 医学与哲学,2015,36(4):67-69. |
| [3] | Zhang N,Li D,Shao J,et al. Animal models for bladder cancer:The model establishment and evaluation (Review)[J]. Oncol Lett,2015,9(4):1515-1519. |
| [4] | 李 涛,杨 立,王志平. 鼠膀胱癌原位模型建立的研究进展[J]. 现代泌尿生殖肿瘤杂志,2013,5(1):51-53. |
| [5] | Xiao Z,McCallum TJ,Brown KM,et al. Characterization of a novel transplantable orthotopic rat bladder transitional cell tumour model[J]. Br J Cancer,1999,81(4):638-646. |
| [6] | Hicks RM,Wakefield JS. Rapid induction of bladder cancer in rats with N-methyl-N-nitrosourea.Ⅰ.Histology[J]. Chem Biol Interact,1972,5(2):139-152. |
| [7] | 张 祥,许天源,夏磊磊,等. 原位膀胱癌大鼠建模方法比较及超声鉴定方法[J]. 现代泌尿生殖肿瘤杂志,2015,7(2):99-103. |
| [8] | Li J,Qu W,Cheng Y,et al. The inhibitory effect of intravesical fisetin against bladder cancer by induction of p53 and down-regulation of NF-kappa B pathways in a rat bladder carcinogenesis model[J]. Basic Clin Pharmacol Toxicol,2014,115(4):321-329. |
| [9] | 吴志平,石家齐,由慧娟,等. N-甲基亚硝基脲诱导大鼠膀胱肿瘤动物模型的实验研究[J]. 贵州医学,2012,36(3):205-208. |
| [10] | 杨劲松. 实验动物的福利伦理与"3R"原则[J]. 河南医学研究,2015,24(8):64-65. |
| [11] | 颜汝平,王剑松,徐鸿毅. 膀胱癌的动物实验模型[J]. 国外医学:泌尿系统分册,2005,25(4):446-449. |
| [12] | 丁 鸿,钱立新. 大鼠膀胱癌模型建立的实验研究[J]. 实验动物与比较医学,2007,27(1):32-36. |
| [13] | Asanuma H,Arai T,Seguchi K,et al. Successful diagnosis of orthotopic rat superficial bladder tumor model by ultrathin cystoscopy[J]. J Urol,2003,169(2):718-720. |
| [14] | 潘春武,胡明明,唐小莹,等. 大鼠原位膀胱癌模型的建立及CT鉴定方法[J]. 现代泌尿生殖肿瘤杂志,2011,3(1):29-33. |
| [15] | 郝钢跃,张维东,田 野,等. 浅表性膀胱癌模型的建立及其活体荧光成像[J]. 中华肿瘤防治杂志,2009,16(24):1932-1934. |
| [16] | Kikuchi E,Xu S,Ohori M,et al. Detection and quantitative analysis of early stage orthotopic murine bladder tumor using in vivo magnetic resonance imaging[J]. J Urol,2003,170(4Pt1):1375-1378. |
 2016, Vol. 42
2016, Vol. 42


