扩展功能
文章信息
- 任丽伟, 魏培, 杨晓菲, 杨璐, 邓春艳, 齐晖, 李富荣
- REN Liwei, WEI Pei, YANG Xiaofei, YANG Lu, DENG Chunyan, QI Hui, LI Furong
- 吉林大学学报(医学版), 2016, 42(04): 676-680
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 676-680
- 10.13481/j.1671-587x.20160408
-
文章历史
- 收稿日期: 2015-10-12
Evans等[1]第一次从小鼠囊胚的内细胞团中分离培养出多潜能性的胚胎干细胞(embryonic stem cells,ESCs),随后根据其分化的全能性展开了各项研究。研究[2, 3]显示:ESCs可分化成具有神经细胞、心肌细胞和胰岛β细胞等具有功能的体细胞,为阿尔茨海默症、心肌梗死和糖尿病等疾病的细胞治疗提供了新的思路,但是伦理学争议成为其应用于临床的最大障碍。2006 年,Takahashi等[4]通过导入外源基因将小鼠成纤维细胞重新编程为多能干细胞,称为诱导多能干细胞(induced pluripotent stem cells,iPSCs) ,从此开辟了干细胞研究新领域,一系列研究证实iPSCs具有与 ESCs一样的分化全能性。iPSCs避开了早期胚胎环节而不存在伦理学问题,所以iPSCs很有可能成为ESCs临床应用的替代品。
经典的iPSCs诱导常采用病毒载体来进行,如逆转录病毒载体(retroviral vector) 、慢病毒载体(lentiviral vector) 、腺病毒载体(adenoviral vector) 及质粒[5, 6]。另外有研究[7, 8]结果显示:利用多蛋白表达系统、化学小分子、合成性 mRNA和microRNA 也可以将小鼠和人的成体细胞重编程为iPSCs。但上述病毒载体有致瘤风险,质粒载体诱导效率很低,利用多蛋白表达系统、化学小分子、合成性 mRNA和microRNA 制备iPSCs不仅操作过程繁琐,且效率低。最近,利用 piggyBac 转座子已成功获得 iPSCs[9, 10],该方法不但转染效率高,操作简单,同时又可利用转座子piggyBac 编码的转座酶将外源基因准确切除,使iPSCs临床应用的风险大大降低。本研究利用piggyBac转座子携带鼠源4个转录因子Oct4、Sox2、Klf4 和c-Myc,重编程Oct4-GFP来源胎鼠成纤维细胞(MEFs)获得正常核型的iPSCs,观察iPSCs克隆形成的过程,解决iPSCs存在的安全性问题,为iPSCs的构建提供新的策略。
1 材料与方法 1.1 动物、主要试剂和仪器Oct4-GFP转基因小鼠、plat-E细胞及携带 Oct4、cMyc、Klf4和Sox2的 piggyBac 转座子(美国霍华德休斯医学研究所Craig教授惠赠)。NOD-SCID 免疫缺陷小鼠[SCXK(京) 2009-0015]12只,购自北京维通利华实验动物技术有限公司。所有动物实验经过本单位伦理委员会批准,对动物的处置方法符合动物伦理学要求 。 6孔培养板、12孔培养板、24孔培养板、 96孔培养板、15 mL离心管和50 mL离心管等培养耗材均购自美国BD Falcon公司。胎牛血清、DMEM/F12、DMEM/H、Trypsin、L-Glutamine和β巯基乙醇均购自美国Gibco公司,丝裂霉素C购自瑞士Roche公司,LipofectamineTM 2000和总RNA提取试剂Trizol购自美国Invitrogen公司,人白血病抑制因子(LIF)和碱性磷酸酶试剂盒购自美国Chemicon公司。倒置荧光显微镜购自日本Olympus公司,流式细胞仪购自美国BD公司。
1.2 MEFs和iPSCs的培养MEFs采用DMEM/H培养基(含10%胎牛血清+ 1%双抗工作液+ 1%L-Glutamine)培养,小鼠iPSCs采用DMEM/F12培养基(含20%胎牛血清+ 1%双抗工作液+ 1%L-Glutamine+1%非必需氨基酸+ 1%β巯基乙醇+1000U LIF)培养。
1.3 MEFs的分离培养和观察无菌环境下取怀孕13.5d的Oct4-GFP转基因小鼠的胎鼠,剪去胎鼠头、四肢及内脏部分后,用无菌PBS溶液冲洗3次。将胎鼠剩余部分剪碎,添加适当体积的0.25%Trypsin-EDTA,37℃消化20 min,加入足够体积的MEFs培养基中止消化,反复吹打后900 r·min-1离心。弃上清,加入MEFs培养基重悬细胞,按照1个胚胎种植于1个直径为10cm培养皿的密度进行接种,培养过夜后,第2天按照1∶4~1∶5进行传代,连续传代培养。收集第3代细胞,采用倒置荧光显微镜观察细胞微丝骨架。
1.4 制备饲养层细胞取第3~5代的MEFs进行饲养层细胞的制备;取融合度达到80%~ 90%的MEFs,弃去培养基,加入质量浓度为 10mg·L-1的丝裂霉素C溶液,37℃、5% CO2条件下培养2~3h。同时准备0.1%明胶包被的培养皿,37℃、5% CO2处理30 min后弃去即可。弃去丝裂霉素C溶液后,用无菌PBS溶液冲洗5次,消化后,将细胞的终浓度调整为3×105~4×105 mL-1,接种于3.5cm明胶包被的培养皿上,37℃、5% CO2条件下培养过夜,细胞贴壁后即可使用。制备好的饲养层细胞应在1周内使用,使用前更换为小鼠iPSCs的培养基。
1.5 piggyBac 转染MEFs待MEFs生长到 80%的汇合度,消化收集细胞,用LipofectamineTM 2000脂质体转染试剂对MEFs细胞进行转染,piggyBac 转座子 2 μg,转染完毕将细胞接种到预先准备好的MEF饲养层细胞上,采用小鼠iPSCs培养液培养。
1.6 小鼠iPSCs的碱性磷酸酶染色将小鼠iPSCs进行传代培养,对传代后大约3d的小鼠iPSCs进行碱性磷酸酶的检测,按照试剂盒说明操作。向细胞中加入4%多聚甲醛固定2 min;加入新鲜配制的fast red violet溶液、奈酚AS-BI磷酸盐溶液和ddH2O的混合液,避光室温孵育15 min,用洗涤液洗涤3次,每次5 min,显微镜下观察拍照。
1.7 小鼠 iPSCs 的染色体 G 带分析取处于对数生长期的不同代次 iPSCs,参考Zhang等[11]的方法进行秋水仙素处理,最后用 5% Giemsa 染色10 min,漂洗,载玻片自然干燥,光学显微镜下观察细胞染色 体,采 用 染 色 体 核 型 分 析 工 作 站 CytoVisionKaryotyper 进行染色体分析配对。
1.8 流式细胞术检测小鼠iPSCs中SSEA-1和Nanog的表达收集不同的细胞,弃去上清,用PBS溶液重悬细胞,加入相应比例稀释的一抗(SSEA-1和Nanog的抗体),避光4℃孵育30 min,加入相应比例稀释的荧光二抗室温孵育,PBS洗涤2次,细胞重悬,进行流式细胞术检测,分析iPSCs克隆中SSEA-1和Nanog表达比例。同时设置同型对照管。
1.9 免疫荧光法检测小鼠iPSCs中SSEA-1和Nanog的表达收集的细胞中加入4%多聚甲醛固定10 min;弃去多聚甲醛,用PBS溶液洗涤3次,每次5 min;用免疫荧光封闭液进行封闭,室温孵育30 min;分别加入相应比例稀释一抗(SSEA-1和Nanog抗体),避光、4℃孵育过夜;弃去染色液,用PBS溶液洗涤,加入相应比例稀释的荧光二抗,室温孵育60 min;加入1∶200稀释的DAPI溶液,室温孵育5 min;加入抗淬灭剂进行封片,进行共聚焦荧光检测和拍照。
1.10 RT-PCR法检测小鼠iPSCs中ESCs干性相关基因的表达收集iPSCs,用无菌DEPC水配制预冷的PBS溶液洗涤2次。加入Trizol试剂提取总RNA。按照Prime ScriptTM RT reagen Kit (Perfect Real Time)说明书将RNA反转录为cDNA,进行PCR扩增,将扩增的DNA加样到配制好的2%琼脂糖凝胶中,进行电泳。电泳结束后,取出凝胶拍照。引物序列,Oct4- forward:5′-CAGATCACTCACATCGCCAATC-3′,Oct4-reverse:5′-CCTGTAGCCTCATACTCTTCTCGT-T-3′;Nanog-forward:5′-ATCCCTTCCCTCGCCATCA-3′,Nanog-reverse:5′-ACCGCTTGCA-CTTCATCCTTTG -3′;FGF4-forward:5′- GTGGTGAGCATCTTCGGAGTGG -3′,FGF4-reverse :5′-GCCTAGGATTCGTAGGCGTTGT-3′; GAPDH-forward:5′-GGCACAGTCAAGGCTGAGA-ATG-3′ ,GAPDH-reverse :5′-ATGGTGGTGAA-GACGCCAGTA-3′。
1.11 小鼠iPSCs畸胎瘤实验小鼠iPSCs传代培养4~5d,将细胞消化离心后并用PBS溶液洗涤,收集细胞,用不含LIF的小鼠iPSCs培养基重悬,将2×106个细胞接种到NOD-SCID小鼠的腹股沟,大约4周后如发现有肿块出现,麻醉后处死小鼠取出肿块,制备组织切片,HE染色,显微镜下观察组织分化情况。
2 结 果 2.1 小鼠MEFs的分离和培养从怀孕13.5 d的Oct4-GFP胎鼠中分离MEFs。MEFs对消化液较为敏感,通过控制胰酶消化的时间,将MEFs纯化,连续传代至第3代获得纯度较高的MEFs。免疫荧光显微镜下观察MEFs的细胞骨架,细胞微丝的排列规则,应力纤维丰富且清晰可见,见图1(插页一)。
2.2 iPSCs克隆的形态表现分离出的原代MEFs中杂细胞较多,以成纤维样细胞为主,少数细胞呈现多边形或者不规则形(图2A,见插页一)。经过连续3次传代后的MEFs,纯度较高,形态较为均一(图2B,见插页一)。转染后荧光显微镜下连续观察:在3周左右出现发绿色荧光的细胞团;随着诱导时间的增加,细胞克隆逐渐明显,变圆或椭圆,克隆的边界清晰,呈现鸟巢样结构,集落内部的细胞很小,折光性很强,呈ESCs样结构(图2C,见插页一),克隆表现为Oct4-GFP阳性(图2D,见插页一)。
2.3 小鼠iPSCs染色体核型分析piggyBac转座子载体转染MEFs后获得iPSCs克隆,选取不同代次的多个小鼠iPSCs克隆,染色体分析均为20对染色体(图3),表明不同代次的小鼠iPSCs核型均无无明显异常。
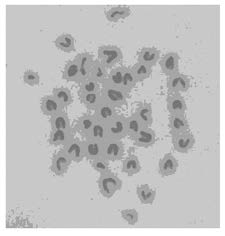
|
| 图3 不同代数的iPSCs染色体核型 Fig.3 Karyotypes of iPSCs at different generations |
iPSCs克隆经碱性磷酸酶染色后,克隆中细胞几乎均呈紫红色,阳性率在90%以上(图4,见插页二)。重编程的小鼠iPSCs中均表达小鼠ESCs相关蛋白,包括Oct4、Nanog和SSEA-1(图5,见插页二)。经流式细胞术检测,小鼠iPSCs均能表达SSEA-1和Nanog(图6)。

|
| A,B:Expressions of SSEA-1 and Nanog in resuspended iPSCs; C:Double-labeled staining in resuspended iPSCs. 图6 流式细胞术检测小鼠iPSCs中SSEA-1和Nanog阳性细胞百分比 Fig.6 Percentages of SSEA and Nanog positive cells in iPSCs detected by flow cytometry |
Trizol法提取小鼠iPSCs的总RNA后,逆转录反应后得到cDNA,经PCR后扩增内参GAPDH和与ESCs相关的基因(Oct4、Nanog和FGF4)。重编程小鼠iPSCs中表达小鼠ESCs的相关基因,且随着代数的增加表达量依然稳定;未感染的MEFs则不表达上述基因(图7)。
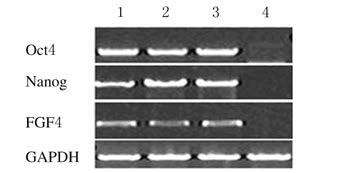
|
| Lane 1:IPSCs-P10;Lane 2:IPSCs-P15;Lane 3:IPSCs-20; Lane 4:MEFs. 图7 重编程iPSCs中Oct4、Nanog和FGF4 mRNA表达电泳图 Fig.7 Electrophoregram of expressions of Oct4,Nanog,and FGF4 mRNA in reprogrammed iPSCs |
将重编程的小鼠iPSCs移植到NOD-SCID小鼠腹股沟内,约4周可形成畸胎瘤 。HE染色:畸胎瘤组织具有外胚层(神经组织)、内胚层(上皮组织)和中胚层(软骨组织)3个胚层不同组织来源(图8A~C,见插页二)。免疫荧光染色:畸胎瘤组织具有3个不同胚层的特定蛋白表达,分别为SM-Actin(中胚层来源的平滑肌)、AFP(内胚层来源的肝细胞)和Nestin(外胚层来源的神经细胞)(图8D~F,见插页二)。
3 讨 论ESCs由于具有分化的全能性,可成为治疗疾病的种子细胞。重编程iPSCs也具有同样分化的全能性,并且无伦理学争议,很可能成为ESCs的替代细胞,安全有效的iPSCs重编程技术显得尤为重要[12, 13, 14]。本研究利用piggyBac转座子携带的Oct4、Sox2、c-Myc和Klf4转录因子导入MEFs,获得了重编程的iPSCs克隆。piggyBac转座子是转座效率较高的转座子,其最大的特点是可精确恢复受体细胞在转座前的状态,而避免外源基因的插入,可明显提高iPSCs的安全性[15]。本研究中重编程的iPSCs在不同代次均具有正常的小鼠染色体核型也证明其具有较好的安全性。饲养层细胞能够促进小鼠ESCs的增殖,并抑制ESCs的分化。本研究将分离出的MEFs作为饲养层细胞[16],其在小鼠iPSCs诱导和稳定培养过程中起重要作用。在本实验过程中,为了能够简单直观地识别iPSCs,选择了携带Oct4-GFP的转基因小鼠进行MEFs分离和诱导:导入4个不同的MEFs转录因子启动重编程过程,内源性的Oct4基因逐步被激活表达,随后启动靶细胞内绿色荧光的表达;通过报告蛋白GFP监测Oct4基因的启动与表达,观察绿色荧光的表达时间、强度和克隆的形状变化,记录细胞重编程的过程。本研究结果显示:转染后细胞的形态逐渐发生变化,变为圆形或椭圆形,边界清晰,类似鸟巢的立体结构,且表达Oct4-GFP。随后,对重编程的细胞克隆进行了相关基因和蛋白检测结果显示:iPSCs克隆中Oct4、SSEA-1和Nanog基因和蛋白均为高表达,碱性磷酸酶染色也为阳性。为了观察iPSCs分化能力,将iPSCs移植到小鼠腹股沟,形成的畸胎瘤具有3个胚层组织细胞,证明重编程的iPSCs具有3个胚层分化能力。
综上所述,本研究成功分离出高活性的MEFs,并通过piggyBac转座子重编程了具有正常核型的小鼠iPSCs,克隆的形态表现、碱性磷酸酶染色、PCR检测、免疫荧光检测和畸胎瘤实验均证实其具有类似ESCs的多能性。本研究结果为iPSCs的临床研究奠定了基础。
| [1] | Evans MJ,Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156. |
| [2] | Hannes T,Wolff M,Doss MX,et al. Electrophysiological characteristics of embryonic stem cell-derived cardiomyocytes are cell line-dependent[J]. Cell Physiol Biochem,2015,35(1):305-314. |
| [3] | Zhu W,Yao X,Liang Y,et al. Mediator Med23 deficiency enhances neural differentiation of murine embryonic stem cells through modulating BMP signaling[J]. Development,2015,142(3):465-476. |
| [4] | Takahashi K,Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell,2006,126(4):663-676. |
| [5] | Ono M,Hamada Y,Horiuchi Y,et al.Generation of induced pluripotent stem cells from human nasal epithelial cells using a sendai virus vector[J].PLoS One,2012,7(8):e42855. |
| [6] | Ruan W,Han J,Li P,et al.A novel strategy to derive iPS cells from porcine fibroblasts[J]. Sci China Life Sci, 2011,54(6):553-559. |
| [7] | Judson RL,Babiarz JE,Venere M,et al.Embryonic stem cell-specific microRNAs promote induced pluripotency[J]. Nat Biotechnol,2009,27(5):459-461. |
| [8] | Miyoshi N,Ishii H,Nagano H,et al. Reprogramming of mouse and human cells to pluripotency using mature microRNAs[J]. Cell Stem Cell,2011,8(6):633-638. |
| [9] | Wang W,Yang J,Liu H,et al.Rapid and efficient reprogramming of somatic cells to induced pluripotent stem cells by retinoic acid receptor gamma and liver receptor homolog 1[J]. Proc Natl Acad Sci U S A,2011,108(45):18283-18288. |
| [10] | Woltjen K,Michael IP,Mohseni P,et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells[J]. Nature,2009,458(7239):766-770. |
| [11] | Zhang J,Zhao L,Wu B,et al. Mouse Induced pluripotent stem cells generated by piggyBac[J]. Sci Sin Vitae,2012,42(7):553. |
| [12] | Yamanaka S.Induced pluripotent stem cells:past,present,and future[J]. Cell Stem Cell,2012,10(6):678-684. |
| [13] | Planello AC,Ji J,Sharma V,et al. Aberrant DNA methylation reprogramming during induced pluripotent stem cell generation is dependent on the choice of reprogramming factors[J]. Cell Regen (Lond),2014,3(1):4. |
| [14] | 康 康,王蔼明,尹善德,等.子宫结合带干细胞的培养与鉴定[J].解放军医学杂志,2015,40(3):173-177. |
| [15] | Meir YJ,Lin A,Huang MF,et al. A versatile,highly efficient,and potentially safer piggyBac transposon system for mammalian genome manipulations[J]. FASEB J, 2013,27(11):4429-4443. |
| [16] | Firas J,Liu X,Nefzger CM,et al. GM-CSF and MEF-conditioned media support feeder-free reprogramming of mouse granulocytes to iPS cells[J]. Differentiation,2014,87(5):193-199. |
 2016, Vol. 42
2016, Vol. 42


