扩展功能
文章信息
- 刘楠, 冯春生, 朴美花, 刘明, 孙宇田
- LIU Nan, FENG Chunsheng, PIAO Meihua, LIU Ming, SUN Yutian
- 吉林大学学报(医学版), 2016, 42(04): 665-670
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 665-670
- 10.13481/j.1671-587x.20160406
-
文章历史
- 收稿日期: 2015-11-30
2. 吉林省前卫医院神经外科, 吉林 长春 130012;
3. 吉林大学中日联谊医院药学部, 吉林 长春 130033
2. Department of Neurosurgery, Qianwei Hospital, Jilin Province, Changchun 130012, China;
3. Department of Pharmacy, China-Japan Union Hospital, Jilin University, Changchun 130033, China
阿尔茨海默病(Alzheimer’ s disease,AD)又称老年性痴呆,自1906年被首次发现至今,AD已成为最常见的老年神经系统变性疾病之一[1, 2, 3]。AD以大脑皮质以及海马CA-1区的老年斑和神经元纤维缠结为主要特征,其病因尚不十分清楚,发病机制复杂,目前尚无有效治疗措施。相关研究[4]表明:全身麻醉能够降低AD的发病年龄并增加其发病率。异氟醚是临床常用的全身麻醉药物之一,异氟醚能够诱导神经元变性和凋亡,进而加剧AD进程[5, 6]。近年来,海藻糖因其性质稳定、天然无毒害以及独特的细胞保护作用而成为国内外医药领域研究的热点。相关动物实验研究[7, 8]表明:海藻糖能够改善转基因AD鼠行为学方面的缺陷程度,减少脑组织内磷酸化tau蛋白和 β-淀粉样蛋白(amyloid β-protein,Aβ)的聚集。本研究采用转淀粉样蛋白前体(APP)基因的小鼠作为AD动物模型,观察异氟醚对转APP基因小鼠脑内海马神经元蛋白质损伤和蛋白聚集的影响,并探讨海藻糖对异氟醚诱导的神经毒性的干预作用。
1 材料与方法 1.1 实验动物12月龄APP转基因小鼠60只购于吉林大学白求恩医学院动物实验中心,体质量(25±3)g,雌雄各半,于18~25℃室温下饲养。
1.2 实验药品及主要试剂海藻糖和二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)(美国Sigma公司),异氟醚(中国上海雅培公司),磷酸缓冲液(PBS)(美国Gibco公司),聚偏二氟乙烯膜(PVDF)(美国Millipore公司),小鼠单克隆抗β肌动蛋白抗体(β-actin)、抗Aβ1-42抗体、抗DNP抗体和抗Nitrotyrosin抗体(美国Abcam公司),辣根过氧化物酶标记的抗鼠抗兔抗体(美国Cell Signaling Technology公司),原位末端转移酶标记法TUNEL试剂盒(美国Roche公司)。
1.3 动物分组及模型制备方法60只小鼠随机分为对照组、异氟醚组(Iso组)和海藻糖组(Tre组),每组20只。对照组小鼠不给予任何药物,置于持续通入2 L·min-1氧气的麻醉箱中2 h;Iso组小鼠于麻醉前30 min腹腔注射生理盐水2 mL,置于吸入麻醉药异氟醚浓度为1.4%的麻醉箱中麻醉2 h(实验期间监测小鼠呼吸、心率和血氧饱和度),最后在纯氧环境中自然苏醒;Tre组小鼠于麻醉前30 min腹腔注射海藻糖(400 μg·kg-1)2 mL,于麻醉箱中同样接受1.4%异氟醚麻醉2 h,在纯氧条件下自然苏醒。
1.4 DCFH-DA法检测小鼠海马组织中活性氧(ROS)水平小鼠吸入麻醉后6 h,每组随机抽取6只小鼠,处死后取海马组织,部分组织按1∶10比例加入预冷的匀浆缓冲液,离心后取上清液,待测;部分组织用于后续实验,制备切片。DCFH-DA粉末溶解为浓度10 μmol·L-1的工作液,与小鼠海马组织匀浆混合,置于5% CO2、37℃的培养箱中,20 min后用PBS液冲洗3次,离心5 min去上清液。用荧光光度计检测细胞中DCFH-DA荧光的强度,代表海马组织中ROS水平。
1.5 免疫组织化学法检测小鼠海马组织中氧化蛋白羰基化合物、硝基化酪氨酸和Aβ1-42蛋白表达水平小鼠吸入麻醉后24 h,各组随机抽取6只小鼠,处死后分离海马,制作冰冻切片。切片经常规脱蜡复水,浸于0.01 mol·L-1枸橼酸酸缓冲液中,经微波修复后自然冷却至室温,PBS液冲洗,加入5% BSA去除多余液体,滴加一抗(抗Aβ1-42抗体、抗DNP抗体和抗Nitrotyrosin抗体),将标本置于4℃冰箱中孵育过夜,经PBS液冲洗后滴加二抗(辣根过氧化物酶标记的抗鼠抗兔抗体),37℃湿盒中孵育30 min,PBS液冲洗,滴加SABC,37℃孵育30 min,PBS液冲洗,滴加配置好的DAB显色,约5 min后冲洗切片并过蒸馏水,苏木素复染,脱水封片后待观察。
1.6 Western blotting法检测小鼠海马组织中氧化蛋白羰基化合物、硝基化酪氨酸和Aβ1-42蛋白表达水平小鼠吸入麻醉后24 h,各组随机抽取6只小鼠取海马组织,加入细胞裂解液,提取总蛋白,依据试剂盒说明书采用BCA法进行蛋白质定量,确定上样量后进行SDS-PAGE电泳,转膜,应用5%脱脂奶粉封闭1.5 h后分别加入一抗(稀释的小鼠抗β-actin抗体、抗Aβ1-42抗体、抗DNP抗体和抗Nitrotyrosin抗体),孵育过夜,常规洗膜后加入经辣根过氧化物酶标记的二抗(抗鼠抗兔抗体),室温孵育1 h后洗膜,将PVDF膜经发光显色处理后压片成像。以样本目的条带吸光度(A)值/β-actin A值表示目的蛋白表达水平。
1.7 透射电镜观察小鼠海马神经元中的蛋白聚集情况小鼠吸入麻醉后24 h,各组随机抽取6只小鼠,杀鼠后取脑组织,浸于2.5%戊二醛中固定过夜,经0.1 mol·L-1磷酸漂洗液漂洗后浸于1%锇酸固定液中再次固定2 h,用0.1 mol·L-1磷酸漂洗液漂洗,乙醇逐级脱水,包埋固化后切片,3%醋酸铀-枸橼酸铅双染色后透射电镜下观察。
1.8 TUNEL染色法检测小鼠海马组织中神经元凋亡率小鼠吸入麻醉后6 h,每组随机抽取6只小鼠,取脑制成冰冻切片。切片于室温下经过氧化氢处理及PBS液冲洗,常规脱蜡水合,加入蛋白酶K,再于37℃湿盒中孵育30 min,经PBS液冲洗后加入TUNEL反应混合液50 μL(TdT酶5 μL+荧光素标记的dUTP 45 μL),孵育60 min后PBS液冲洗,加入POD 50 μL,孵育30 min,最后将切片标本于二氨基联苯胺中显色后,苏木素复染,脱水封片后待观察。于400倍显微镜下观察标本中细胞情况,以凋亡小体的出现作为细胞凋亡的判定依据。以随机选取的5个视野中的凋亡细胞总数与计数的总细胞数的百分比代表神经元凋亡率。
1.9 统计学分析
采用SPSS17.0统计软件进行统计学分析。小鼠海马组织中ROS水平、Aβ1-42蛋白、氧化蛋白羰基化合物、硝基化酪氨酸蛋白表达水平和神经元凋亡率以 ±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
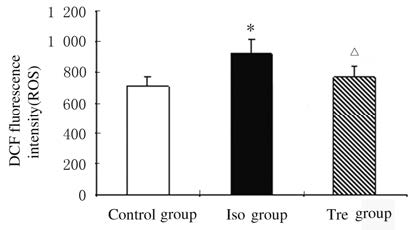
与对照组比较,Iso组小鼠海马组织中ROS水平明显升高(P<0.05);与Iso组比较,Tre组小鼠海马组织中ROS水平明显降低(P <0.05)。见图1。
|
| * P<0.05 compared with control group;△P<0.05 compared with Iso group. 图1 各组小鼠海马组织中ROS水平直条图 Fig.1 Histogram of ROS levelsin hippocampus tissue of mice in various groups |
与对照组比较,Iso组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白表达水平均明显增加(P<0.01);与Iso组比较,Tre组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白表达水平均明显降低(P<0.01)。见表1。
(n=6, ±s) ±s) | ||
| Group | Oxidative protein carbonyl compounds | Nitrotyrosine |
| Control | 32.1±6.3 | 17.2±3.9 |
| Iso | 115.6±12.5 * | 60.5±8.4 * |
| Tre | 73.4±9.8 * △ | 28.1±6.2 * △ |
| * P<0.01 compared with control group; △ P<0.01 compared with Iso group. | ||
与对照组比较,Iso组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白染色强度均明显增加;与Iso组比较,Tre组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白染色强度均明显降低。见图2(插页一)。
2.4 各组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白的Western blotting检测结果与对照组比较,Iso组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白表达水平均明显升高;与Iso组比较,Tre组小鼠海马组织中氧化蛋白羰基化合物和硝基化酪氨酸蛋白表达水平均明显降低。见图3。
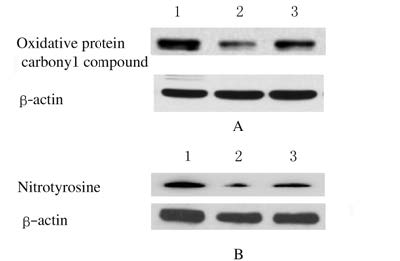
|
| Lane 1:Iso group;Lane 2:Control group;Lane 3:Tre group. 图3 各组小鼠海马组织中氧化蛋白羰基化合物(A)和硝基化酪氨酸(B)蛋白表达电泳图 Fig.3 Electrophoregram of expressions of oxidative protein carbonyl compounds (A) and nitrotyrosine (B) in hippocampus tissue of mice in various groups |
与对照组比较,Iso组小鼠海马神经元中可见大量蛋白聚集;与Iso组比较,Tre组小鼠海马神经元中蛋白聚集量减少。见图4。
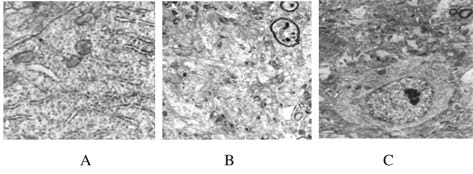
|
| A: Control group; B: Iso group; C: Tre group. 图4 各组小鼠海马神经元中蛋白聚集电镜观察结果(bar=500 nm) Fig.4 Results of TEM of protein aggregation in hippocampal neurons of APP transgenic mice in various groups (bar=500 nm ) |
与对照组比较,Iso组小鼠海马组织CA1区Aβ1-42蛋白表达水平升高(P<0.01);与Iso组比较,Tre组小鼠海马组织CA1区Aβ1-42蛋白表达水平降低(P<0.05)。见图5(插页一)和图6。
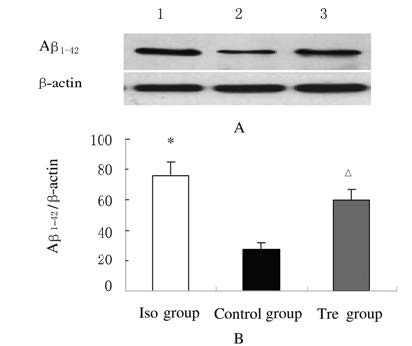
|
| Lane 1:ISO group;Lane 2:Control group;Lane 3:Tre group.* P<0.01 compared with control group; △ P<0.05 compared with Iso group. 图6 各组小鼠海马组织CA1区Aβ1-42蛋白表达电泳图(A)和直条图(B) Fig.6 Electrophoregram(A) and histogram(B) of expressions of Aβ1-42 protein in hippocampus tissue CA1 of mice in various groups |
与对照组(2.84%±0.41%) 比较,Iso组小鼠海马组织中神经元凋亡率(14.29%±2.34%)明显增加( P<0.05);与Iso组比较,Tre组小鼠海马组织中神经元凋亡率(7.72%±1.26%)明显降低 (P<0.05)。见图7(插页一)。
3 讨 论随着医疗技术水平的提高和世界老龄化进程的加剧,接受全身麻醉进行手术治疗的AD患者数量逐年增加,因此全身麻醉药物对AD发病机制的影响及其防治的相关研究已成为近年来国内外麻醉学领域的研究热点,也是亟待解决的临床课题之一。
ROS是细胞正常代谢过程中产生的副产物,具有高度的氧化活性。生理情况下,机体内ROS生成系统与抗氧化清除系统之间互相平衡,而病理状态下,二者之间的平衡关系被破坏,ROS异常增多,引起氧化应激。氧化应激损伤包括蛋白质氧化、脂质过氧化和DNA损伤等。相关研究 [9, 10] 表明:氧化应激与AD有密切关系。在AD患者中,蛋白质氧化损伤主要包含蛋白羰基化和硝基化。蛋白羰基化是一种不可逆的羰基修饰,改变了蛋白质的固有功能,机体内存在多种性质活泼的羰基化合物,主要是细胞内脂质以及核糖核酸等生物大分子生化副反应的产物[11]。蛋白羰基化合物的检测已成为判定蛋白质氧化损伤、衰老和AD的主要方法。蛋白硝基化酪氨酸改变了蛋白质的结构,进而影响蛋白质相应的生理功能:一部分蛋白质获得了某些功能,活性增强;一部分蛋白质未受到影响;大部分蛋白质的功能被抑制,活性降低甚至失活[12]。在AD患者中,蛋白质的硝基化明显增加,因此硝基化酪氨酸蛋白水平的检测也是一种判定AD的方法。
蛋白聚集是伴随AD患者神经元变性过程的一个主要病理特征,AD患者脑内存在大量 Aβ聚集而形成的老年斑[13, 14]。Aβ是一种由APP经蛋白酶水解代谢生成的多肽,主要包含Aβ40和Aβ42 2种亚型,前者更为常见,而后者的聚集性更强,Aβ42的聚集与AD发病机制密切相关。Aβ聚集能够引起氧化应激反应并直接造成线粒体的损伤,线粒体损伤后ROS水平异常升高,细胞内蛋白质发生羰基化和硝基化等氧化反应,蛋白质结构和功能发生改变致使其相互之间易于聚集,同时,蛋白质在发生聚集的过程中亦产生ROS,导致氧化应激反应进一步加重,最终形成恶性循环[15, 16, 17]。本研究结果显示:异氟醚能够增加转APP基因小鼠海马组织中ROS水平、Aβ1-42蛋白、氧化蛋白羰基化合物和硝基化酪氨酸蛋白的表达水平,表明异氟醚能诱导AD患者神经元蛋白质损伤和蛋白聚集,通过加剧氧化应激反应,增加脑内海马神经元凋亡率,影响AD病理过程。
海藻糖是一种广泛存在于多种生物体内的天然二糖,近年来已广泛应用于食品领域,同时海藻糖还是一种有效的抗氧化剂,具有稳定蛋白质结构并保护其生物活性,抑制蛋白聚集的特性[7, 8, 18],进而增强细胞对各种应激反应的抵抗能力,降低细胞功能障碍的发生[19]。本研究结果显示: 与Iso组比较, Tre组转APP基因小鼠海马组织中神经元凋亡率、ROS水平及Aβ1-42蛋白、氧化蛋白羰基化合物和硝基化酪氨酸蛋白表达水平均明显降低,提示海藻糖能够抑制异氟醚诱导的蛋白质损伤和蛋白聚集,拮抗其所导致的神经毒性,这与其他相关动物研究结果[7, 8]相一致。本研究进一步明确了海藻糖对异氟醚诱导的神经元内蛋白质损伤和蛋白聚集的保护作用,提示海藻糖应用于神经退行性疾病领域的良好前景,为AD等疾病的临床治疗提供了理论依据。
| [1] | Alzheimer A.Uber eine eigenartige Erkrankung der Hirnrinde [J].Allg Z Psychiat Psych-Gericht Med,1907,64:146-148. |
| [2] | Jack CR Jr,Albert MS,Knopman DS,et al.Introduction to the recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J].Alzheimers Dement,2011,7(3):257-262. |
| [3] | Ballard C,Gauthier S,Corbett A,et al.Alzheimer's disease [J]. Lancet,2011,377(9770):1019-1031. |
| [4] | Bohnen N,Warner MA,Kokmen E,et al. Early and midlife exposure to anesthesia and age of onset of Alzheimer's disease[J]. Int J Neurosci,1994,77(3/4):181-185. |
| [5] | Wang Q,Liang G,Yang H,et al. The common inhaled anesthetic isoflurane increases aggregation of huntingtin and alters calcium homeostasis in a cell model of Huntington's disease[J]. Toxicol Appl Pharmacol,2011,250(3):291-298. |
| [6] | Bianchi SL,Tran T,Liu C, et al. Brain and behavior changes in 12-month old Tg2576 and nontransgenic mice exposed to anesthetics[J]. Neurobiol Aging,2008,29(7):1002-1010. |
| [7] | Perucho J,Casarejos MJ,Gomez A,et al. Trehalose protects from aggravation of amyloid pathology induced by isoflurane anesthesia in APP (swe) mutant mice [J].Curt Alzheimer Res,2012,9(3):334-343. |
| [8] | Jing Du,Yu Liang,Feng Xu,et al. Trehalose rescues Alzheimer's disease phenotypes in APP/PS1 transgenic mice [J]. J Pharm Pharmacol,2013,65(12):1753-1756. |
| [9] | Rönnbäck A,Pavlov PF,Mansory M,et al. Mitochondrial dysfunction in a transgenic mouse model expressing human amyloid precursor protein (APP) with the Arctic mutation [J]. J Neurochem,2016,136(3):497-502. |
| [10] | Borza LR.A review on the cause-effect relationship between oxidative stress and toxic proteins in the pathogenesis of neurodegenerative diseases [J]. Rev Med Chir Soc Med Nat Iasi,2014,118 (1):19-27. |
| [11] | Li F,Yang Z,Lu Y,et al. Malondialdehyde suppresses cerebral function by breaking homeostasis between excitation and inhibition in turtle Trachemys scripta [J]. PLoS One,2010,5(12):e15325. |
| [12] | Guix FX,Ill-Raga G,Bravo R,et al. Amyloid dependent triosephosphate isomerase nitrotyrosination induces glycation and tau fibrillation [J]. Brain,2009,132(5):1335-1345. |
| [13] | Butterfield DA. The 2013 SFRBM discovery award:selected discoveries from the butterfield laboratory of oxidative stress and its sequela in brain in cognitive disorders exemplified by Alzheimer disease and chemotherapy induced cognitive Impairment [J]. Free Radic Biol Med,2014,74(1):157-174. |
| [14] | Gu X,Sun J,Li S,et al. Oxidative stress induces DNA demethylation and histone acetylation in SH-SY5Y cells:potential epigenetic mechanisms in gene transcription in Aβ Production [J]. Neurobiol Aging,2013,34(4):1069-1079. |
| [15] | Zuo L,Hemmelgarn BT,Chuang CC,et al. The role of oxidative stress induced epigenetic alterations in amyloid-β production in Alzheimer's disease [J]. Oxid Med Cell Longev,2015,2015:1-13. |
| [16] | Szarka A. The role of β-amyloid and mitochondrial dysfunction inthe pathogenesis of Alzheimer's disease [J]. Ideggyogy Sz,2015,68(7/8):222-228. |
| [17] | 梁春荣,刘雨辉,王叶冉,等.阿尔茨海默病患者外周血炎症因子水平与认知功能的相关性研究[J].解放军医学杂志,2014,39(2):133-137. |
| [18] | Emanuele E. Can trehalose prevent neurodegeneration? Insights from experimental studies [J]. Curr Drug Targets,2014,15(5):551-557. |
| [19] | Luyckx J,Baudouin C. Trehalose:an intriguing disaccharide with potential for medical application in ophthalmology [J]. Clin Ophthalmol,2011,5:577-581. |
 2016, Vol. 42
2016, Vol. 42


