扩展功能
文章信息
- 郑全辉, 王娜, 宋天姣, 曹倩文, 田雨, 郝小惠, 张爱红
- ZHENG Quanhui, WANG Na, SONG Tianjiao, CAO Qianwen, TIAN Yu, HAO Xiaohui, ZHANG Aihong
- 吉林大学学报(医学版), 2016, 42(04): 659-664
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 659-664
- 10.13481/j.1671-587x.20160405
-
文章历史
- 收稿日期: 2016-01-02
肺癌是目前世界范围内发病率和死亡率最高的肿瘤之一,其发生发展的病理机制尚不完全清楚。机体固有免疫应答和适应性免疫应答在抗肿瘤免疫中均发挥重要作用。调节性T细胞(regulatory T cells,Treg)是一群细胞表面高表达IL-2受体α链(CD25)、细胞质中表达Foxp3转录因子的CD4+T细胞亚群,主要功能是通过细胞间直接接触或分泌转化生长因子β(TGF-β)、白细胞介素10(IL-10)等细胞因子抑制T细胞的活化与增殖,发挥对细胞免疫应答的负调节作用[1]。自然杀伤细胞(natural killer cells,NK)属于固有免疫细胞,主要分布于外周血和脾脏,其细胞表面特征性标志为TCR-CD56+(小鼠为NK1.1+)。NK细胞可通过释放穿孔素、颗粒酶和肿瘤坏死因子α(TNF-α)等生物活性分子直接杀伤肿瘤和病毒感染的靶细胞[2]。本课题组前期研究[3]显示:肺癌小鼠CD4+T细胞、CD8+T细胞数量减少,细胞免疫应答减弱。但CD4+T细胞亚群在肺癌患者和小鼠体内的变化并不一致,已有研究[4, 5, 6]表明:肺癌患者和小鼠体内 Th2、17型细胞和滤泡辅助性T细胞(follicular helper T cell,Tfh)增加。Treg细胞在肺癌患者外周血中数量的变化已有较多报道[7, 8, 9],但其在外周免疫器官和肿瘤组织中数量的变化,以及其特异转录因子Foxp3的蛋白表达水平变化则报道较少。另外,NK细胞作为一类重要的抗肿瘤免疫细胞,在肺癌患者体内数量的变化报道不一[10, 11]。在本研究中,以肺癌模型小鼠为研究对象,进一步观察和比较CD4+CD25+T细胞和CD4+CD25+Foxp3+Treg细胞在肺癌小鼠脾脏、淋巴结和肿瘤组织中的比例和数量变化以及脾脏组织中NK细胞比例和数量的变化,以期为深入研究肺癌患者的整体免疫功能状态提供新的线索。
1 材料与方法 1.1 细胞株小鼠Lewis肺癌细胞系(Lewis lung carcinoma,LLC)由北京北纳创联生物技术研究院提供,在含10% 胎牛血清及双抗(青霉素100U·mL-1,链霉素100mg·L-1)的DMEM培养液中培养,培养条件:饱和湿度、37℃、5%CO2,2~3 d更换1次培养液 。细胞总数达到95% 融合时用0.25%胰酶-0.02%EDTA消化、传代培养。
1.2 实验动物20只C57BL/6小鼠,6~8周龄,由中国食品药品检定研究院提供,许可证号:SCXK(京)2009-0017,SPF级环境培养。
1.3 主要试剂和仪器DMEM细胞培养液购自美国 Gibco公司,红细胞裂解液、Fc受体阻断剂(2.4G2)、PerCP标记大鼠抗小鼠CD4(RM-4.5)、FITC 标记大鼠抗小鼠CD25(7D4)、PE标记小鼠抗小鼠NK1.1(PK136)和FITC 标记大鼠抗小鼠TCR-β(H57-597)均购自美国BD公司。PE标记大鼠抗小鼠Foxp3抗体(FJK-16S)和Foxp3细胞内染色试剂盒购自美国eBioscience公司。低温冷冻离心机为德国Beckman 公司产品,流式细胞仪FACS Calibur为美国BD公司产品。
1.4 肺癌小鼠模型的制备消化、收集LLC细胞,离心去上清,用无菌生理盐水洗涤2次,将细胞悬浮于生理盐水中,台盼蓝染色观察到细胞活力大于95%时进行细胞计数,调整细胞浓度为1×107mL-1,小鼠腋窝皮下注射。取6~8周龄小鼠20只,雌雄各半,随机分为正常对照组和LLC注射组,每组10只;LLC注射组小鼠皮肤酒精消毒后注射LLC细胞100 μL(1×106/只),正常对照组小鼠注射等量生理盐水。 小鼠自由饮食饮水饲养,每天观察肿瘤形成情况。肿瘤模型成功判定标准:在LLC注射后5~7 d内小鼠腋下可触及米粒大小肿块,并随时间延长出现明显可见的肿瘤团块。
1.5 免疫细胞表面分子染色于肿瘤形成后约2周处死小鼠。分离脾脏、淋巴结和肿瘤组织细胞,制成单细胞悬液。调整细胞悬液浓度为1×107mL-1,各取100 μL加入流式管中,加入Fc受体阻断剂,4℃封闭10 min,然后直接加入10 μL(1∶10~1∶100稀释)荧光素标记的抗细胞表面分子抗体,4℃避光染色30 min。细胞染色缓冲液离心洗涤2次(每次1000 r·min-1、 5 min)后上机检测。抗CD4和CD25抗体染色双阳性细胞为CD4+CD25+T细胞,抗TCRβ抗体染色阴性而NK1.1抗体染色阳性细胞为NK细胞。采用 CellQuest软件分析 CD4+CD25+T细胞、CD4+CD25+Foxp3+Treg和NK细胞占小鼠脾脏细胞、肿瘤组织或CD4+T细胞比例,CD4+CD25+T细胞和CD4+CD25+Foxp3+Treg数量= 细胞相应比例×小鼠脾脏细胞总数。
1.6 Foxp3+细胞内染色取以上各组织细胞悬液,首先按以上步骤进行淋巴细胞CD4、CD25表面分子染色。细胞染色缓冲液离心洗涤2次后收集细胞,每管加入100 μL细胞固定/打孔液,充分混匀后4℃避光放置20 min。用1×打孔/洗涤缓冲液,每管1 mL离心洗涤2次(每次1000r·min-1离心5 min)后收集细胞,每管用 1×打孔/洗涤缓冲液100 μL重悬,加入适量稀释的Foxp3抗体,4℃避光染色30 min。用1×打孔/洗涤缓冲液,每管1 mL离心洗涤2次后上机检测。数据分析采用CellQuest分析软件 。抗CD4、CD25和Foxp3抗体染色三阳性细胞为CD4+CD25+Foxp3+Treg细胞。
1.7 统计学分析
采用Microsoft Excel统计软件进行统计学分析。CD4+CD25+T细胞 、NK细胞和CD4+CD25+Foxp3+Treg细胞在不同组织和细胞中的比例及细胞数量以 ±s表示,组间比较采用双尾Student’st 检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用双尾Student’st 检验。以P<0.05为差异有统计学意义。
与正常对照组比较,LLC注射组小鼠1周后腋窝可触及肿瘤生成,成瘤率达100%(10/10),2周后肿瘤体积明显增大,肿瘤质量可达(2.75±0.82)g。见图1(插页一)。
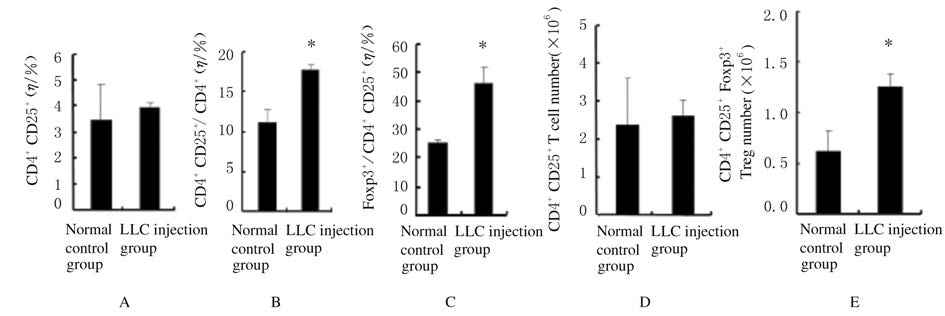
2.2 各组小鼠脾脏组织中Treg细胞比例和数量与正常对照组比较,LLC注射组小鼠CD4+CD25+T细胞占脾细胞比例无明显变化(P>0.05),但CD4+CD25+T细胞占脾脏CD4+T细胞比例和数量明显升高(P<0.05)。与正常对照组比较,LLC注射组小鼠CD4+CD25+Foxp3+Treg细胞占脾脏CD4+ CD25+T细胞比例和数量也明显升高(P<0.05或P<0.01)。见图2和图3。
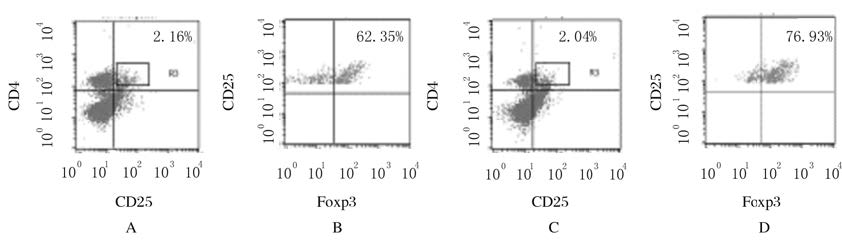
|
| A,B:Normal control group;C,D:LLC injection group. 图2 流式细胞术检测各组小鼠脾脏组织中Treg细胞表达水平 Fig.2 Expression levels of Treg cells in spleen tissue of mice in various groups |

|
| A:Ratio of CD4+CD25+ T cells in spleen tissue;B:Ratio of CD4+CD25+ T cells to CD4+T cells;C:Ratio of Foxp3+ to CD4+CD25+ T cells;D:Number of CD4+CD25+T cells;E:Number of Treg in spleen tissue. * P<0.05,** P<0.01 compared with normal control group. 图3 各组小鼠脾脏组织中Treg细胞比例和数量 Fig.3 Ratios and number of Treg cells in spleen tissue of mice in various groups |
与正常对照组比较,LLC注射组小鼠淋巴结CD4+CD25+T细胞比例无明显变化(P>0.05),但CD4+CD25+T细胞占CD4+T细胞比例明显升高(P<0.05)。与正常对照组比较,LLC注射组小鼠CD4+CD25+Foxp3+ Treg细胞占淋巴结组织中CD4+CD25+T细胞比例和数量明显升高(P<0.05)。见图4和图5。
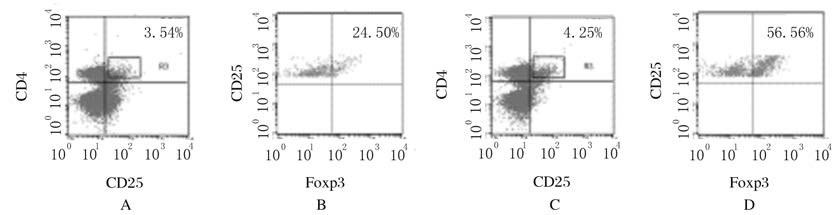
|
| A,B:Normal control group;C,D:LLC injection group. 图4 流式细胞术检测各组小鼠淋巴结组织中Treg细胞表达水平 Fig.4 Expression levels of Treg cells in lymph node tissue of mice in various groups |
|
| A:Ratio of CD4+CD25+ T cells in lymph nodes;B:Ratios of CD4+CD25+ T cells to CD4+T cells;C:Ratio of Foxp3+ to CD4+CD25+ T cells;D:Number of CD4+CD25+ in lymph nodes;E:Number of CD4+CD25+Foxp3+ T cells in lymph nodes. * P<0.05 compared with normal control group. 图5 各组小鼠淋巴结组织中Treg细胞比例和数量 Fig.5 Ratios and number of Treg cells in lymph node tissue of mice in various groups |
LLC注射组小鼠肿瘤组织中CD4+CD25+T细胞占1.09%±0.38%,CD4+CD25+T细胞占 CD4+T细胞比例为45.1%±14.2%,CD4+CD25+Foxp3+Treg细胞占CD4+CD25+T细胞的比例为97.72%±1.37%。与LLC注射组小鼠脾脏和淋巴结的相应细胞所占比例比较,肿瘤组织中CD4+CD25+T细胞占CD4+T细胞比例和CD4+CD25+Foxp3+Treg细胞占CD4+CD25+T细胞比例均明显升高(P<0.05)。见图6。

|
| 图6 LLC注射组小鼠不同组织中Treg细胞比例 Fig.6 Ratios of Treg cells in different tissues of mice in LLC injection group |
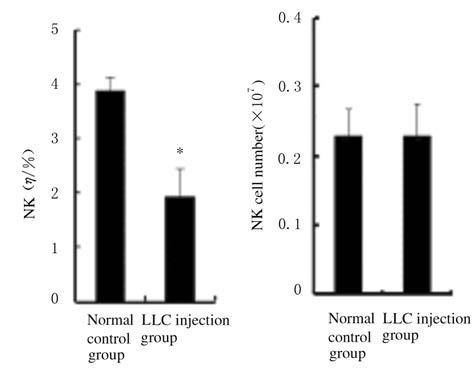
与正常对照组比较,LLC注射组小鼠脾脏组织中NK细胞比例明显降低(P<0.05),但NK细胞数量无明显变化(P>0.05)。见图7和图8。
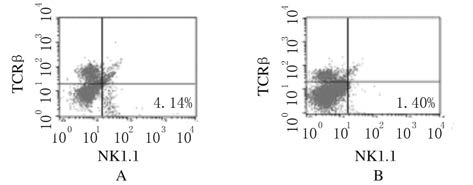
|
| A:Normal control group;B:LLC injection group. 图7 流式细胞术检测各组小鼠脾脏组织中NK细胞比例 Fig.7 Ratios of NK cells in spleen tissue of mice in various groups |
|
| 图8 各组小鼠脾脏组织中NK细胞比例和数量 Fig.8 Ratios and number of NK cells in spleen tissue of mice in various groups |
肺癌在组织学上分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)2种类型,其中非小细胞肺癌约占肺癌患者的80%,NSCLC可进一步分为鳞癌、腺癌和大细胞癌3种亚型[12]。LLC为小鼠肺腺癌细胞,与以往研究结果相似,本文作者观察到LLC细胞皮下接种C57BL/6小鼠1周左右可出现肿瘤,且成瘤率高,肿瘤生长迅速。因此,LLC细胞皮下接种小鼠是目前研究NSCLC发病机制和疗效评价较为理想的动物模型,被国内外研究者 [13]广泛采用。
肿瘤的免疫逃逸不仅与肿瘤细胞本身因素如肿瘤抗原调变、主要组织相容性复合体(major histocompatibility complex,MHC)分子和共刺激分子表达降低有关,也与肿瘤引起的机体免疫功能异常关系密切。本课题组前期实验[3]结果表明:LLC细胞接种诱导的肺癌小鼠CD4+和CD8+T细胞数量降低而骨髓源性抑制细胞(myeloid-derived suppressor cells,MDSC)数量增加。本研究结果显示:肺癌小鼠外周免疫器官和肿瘤组织中CD4+ CD25+Foxp3+Treg细胞比例均明显升高,但NK细胞比例明显降低。由于MDSC和Treg细胞均是发挥免疫抑制功能的细胞群,阻碍机体免疫系统对肿瘤细胞的清除,并促进肿瘤的生长[14]。而效应CD4+和CD8+T细胞和NK细胞在抗肿瘤免疫中发挥主要作用。本研究结果提示:肺癌小鼠肿瘤发展过程中机体免疫系统发生从抗肿瘤免疫到促进肿瘤发展的转变。
有关Treg细胞在肺癌患者中的变化国内外已有较多报道。Duan等[7]发现:NSCLC患者外周血CD4+CD25+T细胞比例较对照组人群明显升高,同时伴有患者血清TGF-β1 和IL-10 浓度的升高;邹静等[8]检测肺癌患者外周血T淋巴细胞变化发现:肺癌患者总T细胞比例有所降低,但Treg细胞比例有所升高,提示肺癌患者处于免疫抑制状态。张瑞萍等[9]对晚期NSCLC患者外周血的检测结果显示:肿瘤分化越差,分期越高,Treg细胞数量越多。在本实验中,本文作者观察到:与正常对照组比较,LLC注射组小鼠脾脏和淋巴结中CD4+CD25+T细胞所占CD4+T细胞比例明显升高。CD25是IL-2的受体,在炎症反应、移植排斥反应等诱发的活化T细胞中表达增加,CD4+CD25+中表达转录因子Foxp3则使其具有免疫抑制功能,成为典型的Treg细胞[15, 16, 17]。本研究结果显示:与正常对照组比较,LLC注射组小鼠脾脏、淋巴结和肿瘤组织中CD4+CD25+Foxp3+Treg细胞比例明显升高,但肿瘤组织中Treg细胞所占比例明显高于脾脏和淋巴结,表明肿瘤本身具有更强的促进Treg产生和/或积聚Treg功能。这可能是肿瘤逃避机体免疫监视功能的重要手段之一,也进一步提示了肿瘤原位免疫治疗的重要性[18]。
NK细胞属于固有免疫细胞,主要分布在外周血和脾脏。NK细胞杀伤靶细胞无需提前致敏也无MHC限制性,可在活化后迅速产生穿孔素和颗粒酶直接杀伤肿瘤细胞,也可通过表达TNF家族成员如FasL和TRAIL诱导肿瘤细胞凋亡[2]。赵霞[10]等报道:与健康人比较,晚期肺癌患者外周静脉血中NK细胞比例明显降低;而侯玉森等[11]报道:肺癌患者外周血中NK细胞与健康对照组比较无明显差异。本研究中肺癌小鼠模型实验结果与前者相似,即 肺癌小鼠脾脏组织中 NK细胞比例明显降低,尽管由于脾脏细胞总数的增加NK细胞数量无明显变化,但仍表现出明显的下降趋势,表明肺癌小鼠肿瘤发展过程中伴随机体固有免疫功能的下降。
综上所述,本研究结果表明:肿瘤形成和发展促进了具有免疫抑制功能细胞的产生和增殖,同时对具有抗肿瘤作用的固有免疫和适应性免疫效应细胞产生明显抑制效果。如何有效减少或清除肿瘤形成和发展过程中产生免疫抑制细胞如Treg和MDSC,从而增强免疫效应细胞的数量和抗瘤活性将是抗肿瘤免疫治疗的关键。
| [1] | Campbell DJ,Koch MA. Phenotypic and functional specialization of FOXP3+regulatory T cells[J].Nat Rev Immunol,2011,11(2):119-130. |
| [2] | Cheng M,Chen Y,Xiao W,et al. NK cell-based immunotherapy for malignant diseases[J]. Cell Mol Immunol,2013,10(3):230-252. |
| [3] | 郑全辉,刘英文,张雪梅. 肺癌小鼠MDSC和T细胞变化[J].中国免疫学杂志,2015,31(5):595-599. |
| [4] | Patel S,Vetale S,Teli P,et al.IL-10 production in non-small cell lung carcinoma patients is regulated by ERK,P38 and COX-2[J]. J Cell Mol Med,2012,16(3):531-544. |
| [5] | Shi W,Li X,Cha Z,et al.Dysregulation of circulating follicular helper T cells in nonsmall cell lung cancer[J]. DNA Cell Biol,2014,33(6):355-360. |
| [6] | Reppert S,Boross I,Koslowski M,et al.A role for T-bet-mediated tumour immune surveillance in anti-IL-17A treatment of lung cancer[J].Nat Commun,2011,2:600. |
| [7] | Duan MC,Han W,Jin PW,et al. Disturbed Th17/Treg balance in patients with non-small cell lung cancer[J]. Inflammation,2015,38(6):2156-2165. |
| [8] | 邹 静,刘 斌,陈雪华,等.肺癌患者外周血T淋巴细胞亚群变化特点及其临床意义[J].中国免疫学杂志,2010,26(11):1016-1020. |
| [9] | 张瑞萍,徐冰心,王社论,等. 晚期非小细胞肺癌调节性T细胞与预后的关系[J]. 现代肿瘤医学, 2013,21(3):521-524. |
| [10] | 赵 霞,韩福才,苏 文,等. 晚期肺癌患者外周血Treg细胞与NK细胞及其活化受体检测临床意义的探讨[J].中华肿瘤防治杂志,2011,18(13):1009-1012. |
| [11] | 侯玉森,苏 文,王艳峰,等.肺癌患者调节性T细胞与NK细胞活化受体NKG2D的相关性及其临床意义[J]. 肿瘤研究与临床,2012,24(9):597-599. |
| [12] | Zhang Q,Furukawa K,Chen HH,et al. Metastatic potential of mouse Lewis lung cancer cells is regulated via ganglioside GM1 by modulating the matrix metalloprotease-9 localization in lipid rafts[J]. J Biol Chem,2006,281(26):18145-18155. |
| [13] | Wang P,An F,Zhuang X,et al. Chronopharmacology and mechanism of antitumor effect of erlotinib in Lewis tumor-bearing mice[J].PLoS One,2014,9(7):e101720. |
| [14] | Lindau D,Gielen P, Kroesen M,et al. The immunosuppressive tumour network:myeloid-derived suppressor cells,regulatory T cells and natural killer T cells[J].Immunology,2013,138(2):105-115. |
| [15] | Hall BM,Verma ND,Tran GT,et al. Distinct regulatory CD4+T cell subsets;differences between naïve and antigen specific T regulatory cells[J]. Curr Opin Immunol,2011,23(5):641-647. |
| [16] | Wieland E,Shipkova M. Lymphocyte surface molecules as immune activation biomarkers[J].Clin Biochem,2016,49(4/5):347-354. |
| [17] | Feng LL,Wang X. Targeting foxp3+ regulatory T cells-related immunosuppression for cancer immunotherapy[J].Chin Med J (Engl),2010,123(22):3334-3342. |
| [18] | Makkouk A,Weiner GJ. Cancer immunotherapy and breaking immune tolerance:new approaches to an old challenge[J]. Cancer Res,2015,75(1):5-10. |
 2016, Vol. 42
2016, Vol. 42


