扩展功能
文章信息
- 韦艳红, 刘晓冬, 刘艳, 陆丽娟
- WEI Yanhong, LIU Xiaodong, LIU Yan, LU Lijuan
- 吉林大学学报(医学版), 2016, 42(04): 648-652
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 648-652
- 10.13481/j.1671-587x.20160403
-
文章历史
- 收稿日期: 2016-01-26
2. 吉林大学公共卫生学院 卫生部放射生物学重点实验室, 吉林 长春 130021
2. Key Laboratory of Radiobiology, Ministry of Health, School of Public Health, Jilin University, Changchun 130021, China
心肌缺血预适应(ischemic preconditioning,IPC)是缺血再灌注 (ischemia reperfusion,I/R) 损伤的重要内源性保护机制,终末效应是降低细胞内氧自由基的水平,从而减轻线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的开放程度,进而抑制细胞凋亡[1]。磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol-3 kinase-protein kinase B,PI3K-Akt)信号通路是调控I/R的关键通路之一,在成年动物IPC和缺血后适应模型中均可通过调节丝/苏氨酸磷酸化发挥抗凋亡作用[2]。然而,在老年动物I/R模型中IPC效应存在一定争议[3],其原因是IPC同时启动多条信号通路,其中PI3K-Akt信号通路的效应器尚不明确。本研究拟通过建立老年大鼠心肌IPC模型,通过调节PI3K-Akt活性,观察其对mPTP的作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器21~23月龄老年雄性Wistar大鼠(清洁级)35只,购自齐齐哈尔医学院动物实验中心,许可证号:SYXK(黑)2016001。PI3K特异性抑制剂Wortmannin(Wort)购自美国Sigma公司,兔抗大鼠Akt和磷酸化Akt(p-Akt)抗体购自英国Abcam公司,GAPDH抗体、山羊抗兔IgG二抗购自北京中杉金桥生物科技公司,超氧化物检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、BCA蛋白定量试剂盒和组织线粒体分离试剂盒均购自广州碧云天生物科技公司,其他试剂为国产分析纯。动物呼吸机(瑞沃德生命科技有限公司,深圳),电泳仪、转膜仪(天能公司,上海),酶标仪(Bio-Rad imark公司,美国)。
1.2 I/R及IPC动物模型建立大鼠腹腔注射10%水合氯醛(0.3 mL·kg-1)麻醉后,仰卧位固定于操作台,沿颈部正中线纵行切开皮肤暴露气管,做气管“T”型切口行机械通气,吸气∶呼气=1.5∶1.0,潮气量30 mL·kg-1。沿胸骨左缘剪断3~5肋骨,分离暴露肺动脉圆锥及左心耳,于左心耳下方约0.3 cm处用5-0缝线绕钩冠状动脉左前降支,打一活结阻断血流5 min后恢复血流5 min,重复3次后结扎左前降支阻断血流,缺血30 min后剪断缝线再灌注120 min,建立IPC模型。 直接结扎大鼠左前降支30 min,再灌注120 min,造成I/R损伤,建立I/R模型。
1.3 实验分组35只大鼠按随机数字表分为I/R组、I/R+Wort组、IPC组、IPC+Wort组和假手术组,每组7只。I/R+Wort和IPC+Wort组大鼠在30 min缺血末期,120 min再灌注开始前尾静脉注射Wort(0.6 mg·kg-1)。120 min再灌注结束后,取大鼠左室前壁心肌组织,-80℃保存用于Western blotting检测。取大鼠心尖部组织,根据组织线粒体分离试剂盒说明,制备组织匀浆,差速离心法600g离心5 min,取上清,11000g离心10 min,弃上清加入线粒体保存液备用。假手术组大鼠单纯切开暴露心脏,提取心肌组织进行检测。
1.4 Western blotting法检测大鼠心肌组织中Akt和p-Akt蛋白相对表达水平大鼠心肌组织中加入蛋白裂解液,冰上裂解30 min,12000 g离心30 min,取上清,根据BCA试剂盒说明测定总蛋白相对表达水平。 加入上样缓冲液后行聚丙烯酰胺凝胶电泳,转膜后室温封闭1h,加入兔抗大鼠Akt(1∶1 000)、p-Akt(1∶1 000)和GAPDH(1∶2 000)一抗,4℃过夜。第2天洗膜后加入山羊抗兔IgG二抗 (1∶8 000),室温孵育1h,洗膜后显色。根据Image J 2.1软件分析条带灰度值,以GAPDH为内参,Akt蛋白相对表达水平=Akt灰度值/GAPDH灰度值,p-Akt蛋白相对表达水平=p-Akt灰度值/Akt灰度值。
1.5 大鼠心肌线粒体超氧化物水平和SOD活性检测BCA法测定线粒体保存液蛋白表达水平。调整蛋白表达水平至0.5g·L-1,各组分别取200 μL悬液,离心后弃上清,留取沉淀备用。根据超氧化物检测试剂盒说明,配制超氧化物检测工作液,用工作液重悬线粒体沉淀,加入到96孔板中,酶标仪测定各孔在450 nm处的吸光度(A)值,超氧化物水平=样本A值-空白对照孔A值。根据SOD检测试剂盒说明书配置反应启动工作液,重悬线粒体后,加入到96孔板中,酶标仪测定各孔在450 nm处的 A值,样本A值与对照孔A值的差为SOD抑制率,酶活力单位=SOD抑制率/(1-SOD抑制率)。
1.6 大鼠心肌mPTP开放程度检测每组取200 μL线粒体悬液(0.5g·L-1),加入96孔板中,立即应用酶标仪测定540 nm处A值,作为初始A值。而后每组分别加入CaCl2溶液,使CaCl2终浓度为200 μmol·L-1。每2min测定各孔A值,连续测量20 min,以初始A值与各时间点A值的比值作为评价mPTP开放程度的指标[4],比值越高则表示开放程度越低。开放程度=初始A值/各时间点A值×100%。从提取心肌线粒体到测定结束,均需在4℃条件下进行,并且在1h内完成。
1.7 统计学分析
采用SPSS20.0统计学软件进行统计学处理。大鼠心肌组织中Akt和p-Akt蛋白相对表达水平、大鼠心肌线粒体超氧化物水平和SOD活性及大鼠心肌mPTP开放程度均以 ±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
各组大鼠心肌组织中Akt蛋白相对表达水平比较差异无统计学意义(P>0.05)。与I/R组比较,I/R+Wort组大鼠心肌组织中p-Akt蛋白相对表达水平明显降低(P<0.01),IPC组大鼠心肌组织中p-Akt蛋白相对表达水平明显升高(P<0.05);与IPC组比较,IPC+Wort组大鼠心肌组织中p-Akt蛋白相对表达水平明显降低(P<0.01)。见图1和表1。
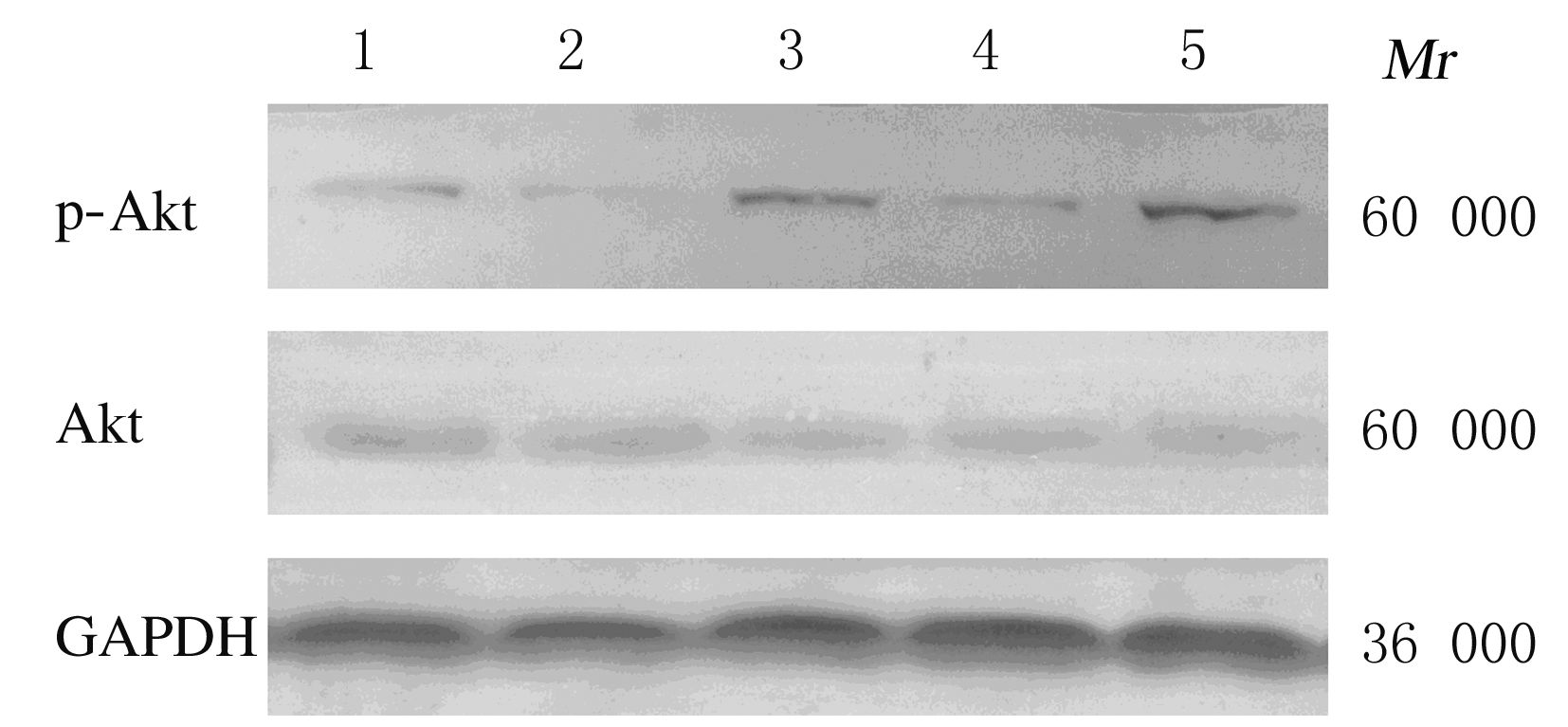
|
| Lane 1:I/R group;Lane 2:I/R+Wort group;Lane 3:IPC group; Lane 4:IPC+Wort group;Lane 5:Sham group. 图1 Western blotting法检测各组大鼠心肌组织中Akt和p-Akt蛋白表达电泳图 Fig.1 Electrophoretogram of expressions of Akt and p-Akt proteins in myocardium tissue of rats in various groups detected by Western blotting method |
(n=7, ±s) ±s) | ||
| Group | Akt | p-Akt |
| Sham | 0.819±0.104 | 0.472±0.097 |
| I/R | 0.811±0.065 | 0.288±0.071 * |
| I/R+Wort | 0.831±0.068 | 0.044±0.010 △△ |
| IPC | 0.823±0.078 | 0.346±0.051 △ |
| IPC+Wort | 0.830±0.055 | 0.035±0.013 △△# |
| *P<0.05 compared with sham group; △ P<0.05, △△ P<0.01 compared with I/R group; # P<0.01 compared with IPC group. | ||
与I/R组比较,IPC组大鼠心肌线粒体超氧化物水平降低(P<0.05),SOD活性升高(P<0.05),I/R+Wort组超氧化物水平和SOD活性均无明显变化(P>0.05);与IPC组 比较,IPC+Wort组大鼠心肌线粒体超氧化物水平和SOD活性差异均无统计学意义(P>0.05)。见表2。
(n=7, ±s) ±s) | ||
| Group | Superoxide | SOD |
| Sham | 0.172±0.038 * | 1.31±0.32 |
| I/R | 0.216±0.024 | 1.15±0.15 * |
| I/R+Wort | 0.218±0.029 | 1.17±0.21 |
| IPC | 0.187±0.022 * | 1.39±0.14 △ |
| IPC+Wort | 0.188±0.023 * | 1.42±0.14 △ |
| *P<0.05 compared with sham group; △ P<0.05 compared with I/R group. | ||
在6~20min时,与I/R组比较,I/R+Wort组大鼠心肌mPTP开放程度无明显变化(P>0.05),IPC组大鼠心肌mPTP开放程度降低(P<0.05);与IPC组比较,IPC+Wort组大鼠心肌mPTP开放程度明显增加(P<0.05)。见表3。
(n=7, ±s) ±s) | |||||
| Group | Openness degree of mPTP | ||||
| (t/min) 2 | 4 | 6 | 8 | 10 | |
| Sham | 98.79±4.36 | 94.17±5.42 | 93.65±5.13 | 90.49±4.57 | 88.07±5.04 |
| I/R | 97.46±3.18 | 93.25±3.67 | 89.87±3.26 * | 85.23±3.78 * | 80.67±4.60 * |
| I/R+Wort | 97.32±3.92 | 92.58±3.94 | 88.46±3.49 | 84.84±4.65 | 79.02±4.82 |
| IPC | 98.01±4.23 | 93.61±4.14 | 92.76±4.62 △ | 89.41±3.73 △ | 86.28±3.47 △ |
| IPC+Wort | 97.66±3.74 | 92.83±5.09 | 87.95±4.76 # | 84.61±4.02 # | 81.05±2.99 # |
| Group | Openness degree of mPTP | ||||
| 12 | 14 | 16 | 18 | 20 | |
| Sham | 84.21±4.03 | 79.02±3.25 | 76.32±4.56 | 73.53±5.17 | 69.75±4.98 |
| I/R | 73.14±4.53 * | 69.98±4.26 * | 66.36±3.25 * | 63.07±4.20 * | 60.28±3.61 * |
| I/R+Wort | 73.48±4.26 | 70.51±3.49 | 65.86±4.74 | 62.85±3.28 | 59.72±3.88 |
| IPC | 82.09±4.59 △ | 76.54±5.11 △ | 72.05±5.62 △ | 68.57±3.49 △ | 64.52±4.15 △ |
| IPC+Wort | 74.55±3.92 # | 70.84±4.31 # | 67.04±4.97 # | 62.22±3.86 # | 59.20±2.86 # |
| *P<0.05 compared with sham group; △ P<0.05 compared with I/R group; # P<0.05 compared with IPC group. | |||||
IPC可以有效地降低成年动物I/R灌注后的组织损伤,但在老年动物模型中IPC效果存在一定争议,其原因是由于I/R同时启动多条信号凋亡通路,而老年动物对IPC反应性降低,使IPC产生的抗凋亡作用减弱。然而,IPC仍可通过激活部分抗凋亡通路拮抗老年心肌I/R损伤,其中具有代表 性的是PI3K-Akt通路[5]。当胞外信号通过G蛋白偶联受体或酪氨酸 激酶受体激活PI3K后,PI3K的p85亚基与p110亚基结合激活Akt,活化的Akt将信号传递至下游细胞器,通过磷酸化丝/苏氨酸残基发挥效应[6]。但在老年心肌IPC模型中,PI3K-Akt通路对线粒体的调控作用尚不明确,为此本研究通过调控该通路活性,明确其对线粒体的作用效果。
Akt是细胞内的固有蛋白,其通过磷酸化形成p-Akt发挥作用[7]。本研究结果显示:IPC组大鼠心肌组织中p-Akt表达水平明显高于I/R组,说明老年大鼠心肌缺血预处理可以激活PI3K-Akt通路,从而发挥抗凋亡作用;但I/R组和IPC组大鼠心肌组织中p-Akt表达水平均较低,说明在老年大鼠心肌组织中该通路的敏感性已降低,这一结果与国外研究结论[8, 9]相符,也解释了老年动物模型对IPC反应降低的原因。
线粒体是细胞内产生自由基的重要场所[10]。I/R后,自由基的大量生成超过了线粒体固有的清除能力,使自由基大量堆积,进而诱导mPTP开放,自由基进入胞浆启动凋亡程序[11]。本研究结果显示:IPC组大鼠心肌mPTP开放程度明显低于I/R组,且IPC对mPTP的保护作用可被Wort抑制,说明IPC-PI3K-Akt通路可以抑制mPTP的开放;但Wort抑制剂对I/R或IPC后大鼠心肌线粒体内超氧化物水平和SOD活性无明显影响,说明PI3K-Akt通路对氧自由基的产生无明显调控作用。综合上述结果可以推断:PI3K-Akt通路激活后可能直接作用于构成mPTP的分子蛋白,使丝/苏氨酸残基发生磷酸化,进而改变mPTP构象,抑制其开放。目前,关于mPTP的分子构成尚存在争议[12, 13, 14],多数学者认为mPTP是由外膜的电压依赖性阴离子通道(VDAC)、内膜的腺嘌呤核苷转位酶(ANT)和亲环素D构成[15],但PI3K-Akt通路的具体作用位点尚需进一步研究。
综上所述,老年大鼠IPC可通过激活PI3K-Akt通路抑制mPTP的开放,减轻I/R损伤。
| [1] | 宋丽华,张晓一,来丽娜,等.白藜芦醇对心肌缺血再灌注过程中线粒体的保护[J].中国医院药学杂志,2015,35(10):907-911. |
| [2] | Fullmer TM,Pei S,Zhu Y,et al. Insulin suppresses ischemic preconditioning-mediatedcardioprotection through Akt-dependent mechanisms[J]. J Mol Cell Cardiol,2013,64(11):20-29. |
| [3] | 韩劲松,王辉山,韩宏光,等.心肌缺血预适应作用对老年大鼠心肌的影响及其机制的研究[J].中国循环杂志,2014,29(8):624-628. |
| [4] | 韦艳红,刘 艳,康晓新,等.依达拉奉对老年大鼠心肌缺血再灌注后线粒体功能的保护作用[J].中国老年学杂志,2015,35(15):4159-4161. |
| [5] | Yang C,Talukder MA,Varadharaj S,et al. Early ischaemic preconditioning requires Akt- and PKA-mediated activation of eNOS via serine1176 phosphorylation[J]. Cardiovasc Res,2013,97(1):33-43. |
| [6] | Rajala RV,Ranjo-Bishop M,Wang Y,et al. The p110α isoform of phosphoinositide 3-kinase is essential for cone photoreceptor survival[J]. Biochimie,2015,112(5):35-40. |
| [7] | 刘 祥,景桂霞,白 娟,等.舒芬太尼预处理对大鼠心肌缺血再灌注时PI3K/Akt的影响[J].南方医科大学学报,2014,34(3):335-340. |
| [8] | Calviño E,Estañ MC,Sánchez-Martín C,et al. Regulation of death induction and chemosensitizing action of 3-bromopyruvate in myeloid leukemia cells:energy depletion,oxidative stress,and protein kinase activity modulation[J]. J Pharmacol Exp Ther,2014,348(2):324-335. |
| [9] | Peart JN,Pepe S,Reichelt ME,et al. Dysfunctional survival-signaling and stress-intolerance in aged murine and human myocardium[J]. Exp Gerontol,2014,50(2):72-81. |
| [10] | 牛宇杰,赵 炜,刘新光,等.活性氧与衰老的研究进展[J].国际老年医学杂志,2014,35(1):33-38. |
| [11] | Zuo L,Pannell BK,Re AT,et al. Po2 cycling protects diaphragm function during reoxygenation via ROS,Akt,ERK,and mitochondrial channels[J]. Am J Physiol Cell Physiol,2015,309(11):759-766. |
| [12] | Rao VK,Carlson EA,Yan SS. Mitochondrial permeability transition pore is a potential drug target for neurodegeneration[J]. Biochim Biophys Acta,2014,1842(8):1267-1272. |
| [13] | 李 冬,史大卓,刘秀华,等.线粒体功能障碍与心肌缺血再灌注损伤[J].中华老年心脑血管病杂志,2014,16(3):318-321. |
| [14] | Taliani S,Pugliesi I,Da Settimo F. Structural requirements to obtain highly potent and selective 18 kDa translocator protein (TSPO) ligands[J]. Curr Top Med Chem,2011,11(7):860-886. |
| [15] | Javadov S,Karmazyn M,Escobales N. Mitochondrial permeability transition pore opening as a promising therapeutic target in cardiac diseases[J]. J Pharmacol Exp Ther,2009,330(3):670-678. |
 2016, Vol. 42
2016, Vol. 42


