扩展功能
文章信息
- 刘微, 姚杨, 马萧萧, 邓裕宣, 梅迪, 刘磊, 王会岩
- LIU Wei, YAO Yang, MA Xiaoxiao, DENG Yuxuan, MEI Di, LIU Lei, WANG Huiyan
- 吉林大学学报(医学版), 2016, 42(04): 642-647
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 642-647
- 10.13481/j.1671-587x.20160402
-
文章历史
- 收稿日期: 2015-12-31
小泛素相关修饰物 (small ubiquitin-like modifier,SUMO)是由约100个氨基酸组成的保守多肽家族,作为融合标签和分子伴侣可提高重组蛋白的可溶性和稳定性[1],有利于重组蛋白的正确折叠。SUMO化修饰(simulation)是一种与泛素化修饰类似的蛋白质翻译后修饰方式,在调控蛋白质结构和功能方面发挥重要作用[2, 3, 4],为蛋白质纯化奠定了良好的基础。成纤维细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4)是一种跨膜酪氨酸激酶受体,通过与FGF1-2、 FGF4、FGF6、FGF8-9和FGF16-19结合,介导信号传递[5, 6]。FGFR4 的功能是参与细胞增殖、血管生成、脂质代谢和组织分化等生理活动,在成人肝实质细胞和肿瘤组织中表达水平较高[7, 8]。目前对FGFR4 的研究结果表明:FGFR4可能是一种肿瘤生长的驱动基因,参与多种恶性肿瘤的发生,因此FGFR4可能成为癌前诊断和预后治疗的有效位点[9]。 本研究旨在构建pET22b-SUMO-FGFR4重组载体并将其转入BL21感受态细胞中,将SUMO-FGFR4基因表达进行优化,分析所获得的目的蛋白的可溶性,以期为后续研究FGFR4胞外区蛋白奠定基础。
1 材料与方法 1.1 菌株、质粒及主要试剂E.coliDH5α、BL21(DE3)、pET3C-SUMO、pET28a-FGFR4和原核表达载体pET22b为本室保存。引物合成和基因测序均由上海生工生物工程有限公司完成。FGFR4一抗购自美国Santa公司,Pfu酶、 NdeⅠ、BamHⅠ和T4 DNA连接酶购自日本TaKaRa公司,PCR产物回收试剂盒、DNA凝胶回收试剂盒和质粒小量提取试剂盒购自北京天根生化科技有限公司。
1.2 FGFR4-SUMO融合基因的扩增以pET3C-SUMO和pET28a-FGFR4为模板,设计SUMO-FGFR4融合基因上游引物、Linker和下游引物。上游引物: 5′-CCATATGCATCATCATCATCATCACG-3′,下游引物:5′-CCGCTCGAGCAGAGTCATCAGGCCG-3′,Linker:5′-GGAA-ATGGACTC CTTAAGATTCTTGTACGACGGTATTAG-3′。利用Overlap PCR扩增SUMO-FGFR4片段。取10 μL扩增产物,于1%琼脂糖凝胶进行电泳检测,并将产物按PCR产物回收试剂盒进行回收,低温保存。
1.3 pET22b-SUMO-FGFR4重组载体的构建用NdeⅠ和BamHⅠ双酶切pET22b载体和SUMO-FGFR4片段,胶回收后用T4 DNA连接酶进行连接,连接后转入DH5ɑ感受态细胞中,在氨苄青霉素抗性培养板筛选阳性重组克隆pET22b-SUMO-FGFR4,小提质粒,经PCR和酶切鉴定后,进行测序。
1.4 表达菌株的筛选将测序正确的pET22b-SUMO-FGFR4转入BL21(DE3)感受态细胞,倒置培养后挑取单菌落于37℃震荡培养过夜,之后将菌液按照1∶20的比例转接入含有5mL新鲜的 LB培养基试管(含100 mg·L-1氨苄青霉素)中,37℃、180 r·min-1培养,当A(600)=0.6~0.8时,加入异丙基硫代半乳糖苷(IPTG)诱导,4 h后离心收集菌体,通过SDS-PAGE电泳和Western blotting法鉴定重组蛋白表达情况。取高表达的菌株过夜培养,加入甘油后于-20℃保存。
1.5 乳糖诱导最佳条件的确定及可溶性分析将保存的菌种按照1∶100的比例接种于含有5 mL新鲜LB液体培养基(含100 mg·L-1氨苄青霉素)中,37 ℃、180 r·min-1 培养过夜,再按1∶100接种量将活化菌种接种到含100 mg·L-1 氨苄青霉素的培养基中,于37 ℃、180 r· min-1震荡培养。当菌液A(600)达0.6~0.8 时添加20%乳糖至各试管中,使终浓度分别达到0.5、1.0、2.0、5.0、8.0和10.0 g·L-1,37℃诱导3 h后用空白LB培养基将菌液A值调至与诱导前相同,通过SDS-PAGE电泳检测SUMO-FGFR4融合蛋白表达量,确定最佳乳糖诱导浓度。在菌体生长至A(600)为0.6~0.8 时,用上述最佳乳糖诱导浓度进行诱导,分别于诱导1、2、3、4、5和6 h 检测菌液融合蛋白表达量,确定乳糖最佳诱导时间。菌液接种于不同试管中,使其A(600)分别达到0.4、0.6、0.8、1.0和1.2时,加入上述最佳乳糖诱导浓度进行诱导表达,3h后收集菌体,SDS-PAGE电泳鉴定,确定最佳乳糖诱导时机,即A(600)值。在菌体培养至A(600)为 0.6~0.8 时,使用上述最佳诱导浓度乳糖,分别在25、30、33和37℃的条件下进行震荡培养, SDS-PAGE电泳鉴定融合蛋白表达量,确定乳糖诱导的最佳温度。当菌体生长到最佳诱导时机时,一次性加入乳糖和分2次(间隔1.5 h)添加乳糖至最佳诱导浓度,通过SDS-PAGE电泳确定乳糖的最佳添加方式,并比较乳糖和IPTG诱导蛋白表达的不同。以上SDS-PAGE电泳结果均采用 Gel DOCTM凝胶成像系统分析各样品中重组蛋白表达量占菌体总蛋白量的百分比。选取高表达的菌株接种到含有氨苄青霉素(100 mg·L-1)的LB培养基中,37℃、180 r·min-1培养至菌体密度A(600)为0.6~0.8时,加入最佳诱导浓度的乳糖诱导3h后称质量。然后加入8倍体积的细胞裂解液,超声破碎后, 10 000 r·min-1离心30 min,将上清和沉淀分别进行表达量分析,SDS-PAGE鉴定。
2 结 果 2.1 SUMO-FGFR4 扩增以质粒为模板,利用SUMO-FGFR4引物和Linker扩增目的片段。产物经1%琼脂糖凝胶电泳鉴定,得到约918 bp的DNA片段(图1),与预期结果一致,表明已成功构建SUMO-FGFR4融合基因。
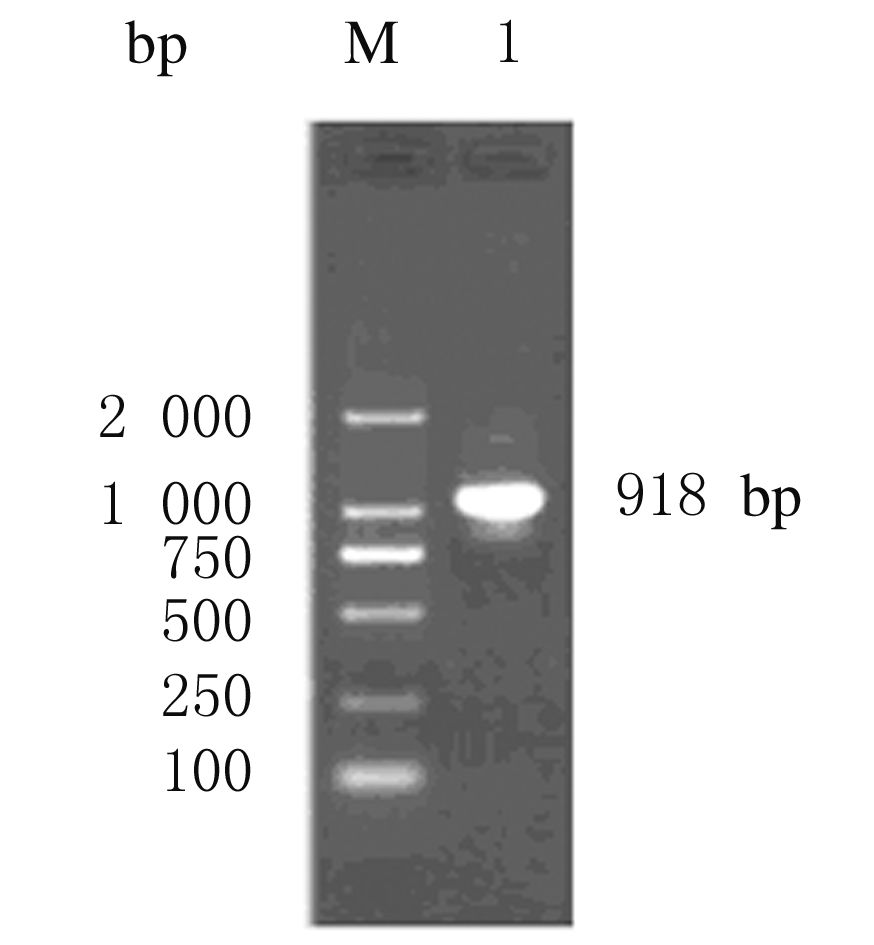
|
| M:DL 2000 DNAmarker; Lane 1:SUMO-FGFR4 product. 图1 SUMO-FGFR4 融合基因PCR扩增电泳图 Fig.1 Electrophoregram of PCR amplification of SUMO-FGFR4 fusion gene |
将SUMO-FGFR4构建至pET22b载体中,获得重组表达载体pET22b-SUMO-FGFR4,经NdeⅠ和BamHⅠ双酶切后,在900 bp处可见1条明显条带(图2),与SUMO-FGFR4基因的理论预期值(918 bp)基本一致,表明已成功构建重组表达载体,测序结果与理论值一致。将重组质粒pET22b-SUMO-FGFR4转化至大肠杆菌BL21(DE3)中诱导表达,SDS-PAGE凝胶电泳分析:在相对分子质量40000处可见目的蛋白条带(图3),与理论预期值相符合。Western blotting检测:该重组蛋白可以与FGFR4一抗特异性结合(图4)。
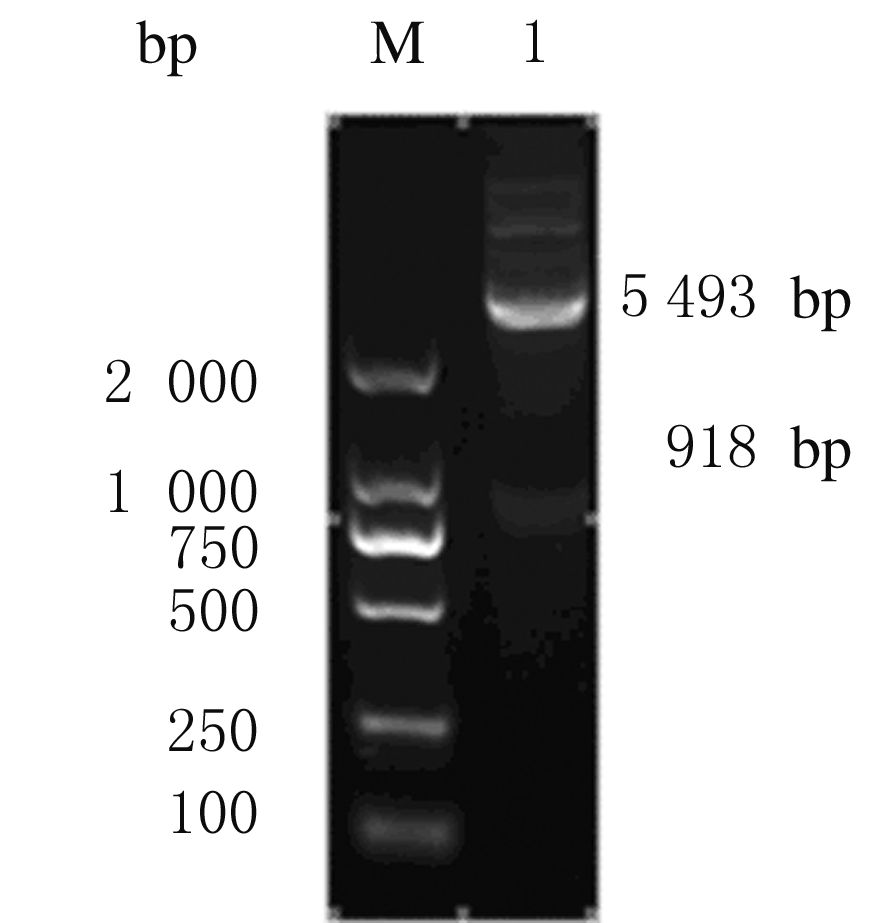
|
| M:DL2000 DNAmarker; Lane 1:Restriction product of pET22b-SUMO-FGFR4(NdeⅠand BamHⅠ). 图2 重组表达载体pET22b-SUMO-FGFR4的双酶切电泳图 Fig.2 Electrophoregram of double digestion of recombinant expression vector pET22b-SUMO-FGFR4 |
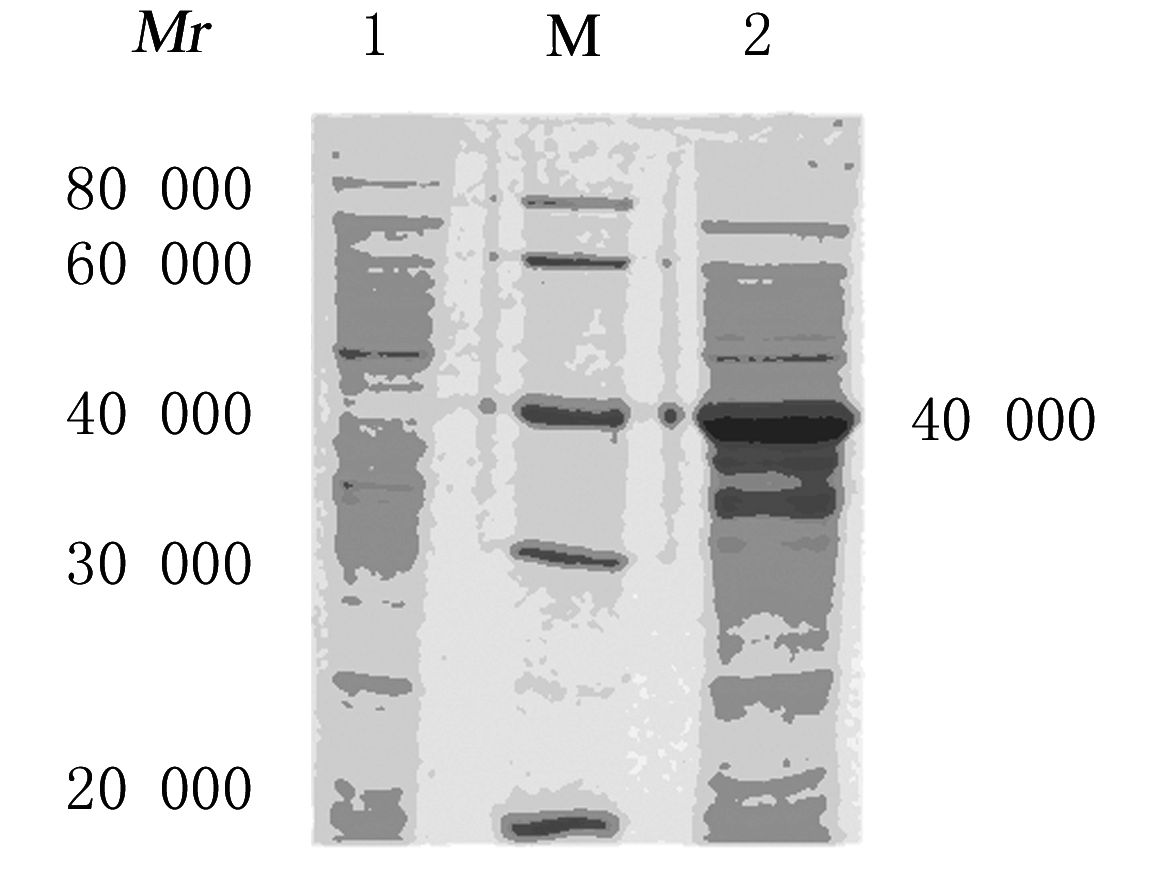
|
| M:Protein marker;Lane 1:Control;Lane 2:SUMO-FGFR4 protein. 图3 SUMO-FGFR4蛋白的SDS-PAGE凝胶电泳图 Fig.3 SDS-PAGE gel electrophoregram of SUMO-FGFR4 protein |

|
| Lane 1:SUMO-FGFR4 protein;Lane 2: Negative control. 图4 SUMO-FGFR4蛋白免疫印迹分析电泳图 Fig.4 Electrophoregram of SUMO-FGFR4 protein detected by Western blotting analysis |
不同浓度乳糖对外源蛋白的表达均有一定作用。 在质量浓度分别为0.5、1.0、2.0、5.0、8.0和10.0g·L-1乳糖诱导作用下,目标蛋白表达量分别占菌体总蛋白表达量的35.5%、38.2%、35.8%、35.1%、34.2%和30.6%(图5),乳糖的最佳诱导浓度为1.0 g·L-1。

|
| M:Protein marker;Lane 1:Before induction;Lane 2-7:0.5,1.0,2.0,5.0, 8.0,and 10.0 g·L-1. 图5 不同浓度乳糖诱导重组蛋白表达电泳图 Fig.5 Electrophoregram of recombinant protein expressions induced by different concentrations of lactose |
菌液培养至A(600)为0.6~0.8时,以上述最佳乳糖浓度(1.0 g·L-1)诱导SUMO-FGFR4表达,诱导时间为1~6 h,每隔1 h取1 mL菌液,进行全菌液SDS-PAGE电泳。不同诱导时间目标蛋白表达量分别占菌体总蛋白表达量的21.1%、37.1%、37.6%、35.2%、34.1%和35.1%(图6),乳糖的最佳诱导时间为3 h。

|
| M:Protein marker; Lane 1:Before induction; Lane 2-7:1,2,3,4,5,and 6 h. 图6 不同诱导时间重组蛋白表达电泳图 Fig.6 Electrophoregram of recombinant protein expressions at different induction time |
将活化的菌种分别在A(600)为0.4、0.6、0.8、1.0和1.2时加入乳糖至终浓度为0.5 g·L-1,诱导3 h,目标蛋白表达量分别占菌体总蛋白表达量的19.7%、27.2%、34.6%、28.1%和33.1% (图7), 乳糖的最佳诱导时机为A(600)=0.8。
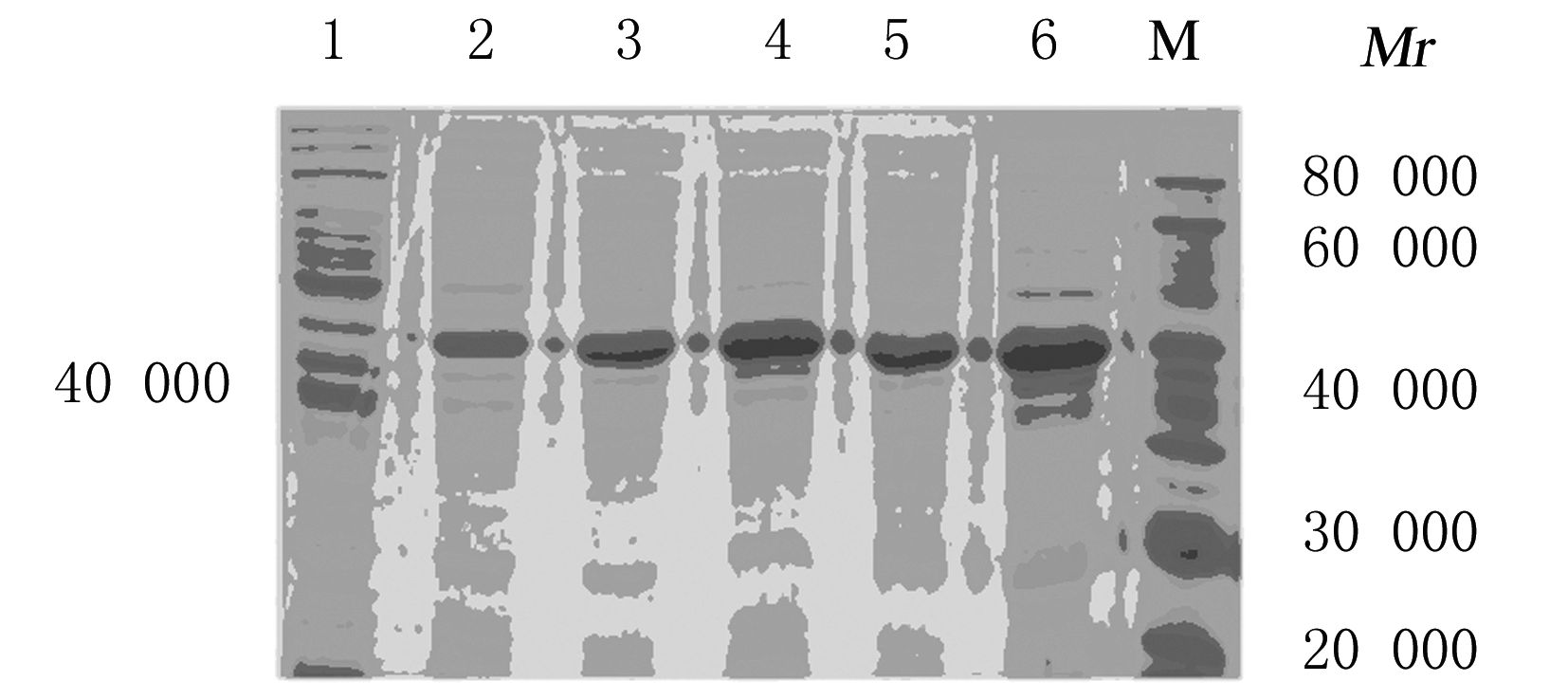
|
| M:Protein marker;Lane 1:Before induction; Lane 2-6:A(600)=0.4,0.6,0.8,1.0,and 1.2. 图7 不同诱导时机重组蛋白表达电泳图 Fig.7 Electrophoregram of recombinant protein expressions at different induction time points |
在温度为25、30 、33和37℃条件下诱导融合蛋白表达,诱导3 h后收取菌体,目标蛋白表达量分别占菌体总蛋白表达量的 12.7%、15.2%、17.3%和30.4% (图8),乳糖的最佳诱导温度为37℃。

|
| M:Protein marker;Lane 1:Before induction;Lane 2-5: 25,30,33,and 37℃. 图8 不同诱导温度重组蛋白表达电泳图 Fig.8 Electrophoregram of recombinant protein expressions at different induction temperatures |
一次性加入乳糖至最佳浓度和分2次(间隔1.5h)加入乳糖至最佳浓度,目标蛋白表达量分别占菌体总蛋白表达量的34.7%和34.2%(图9),2种添加乳糖的方式对蛋白的表达量无明显影响。
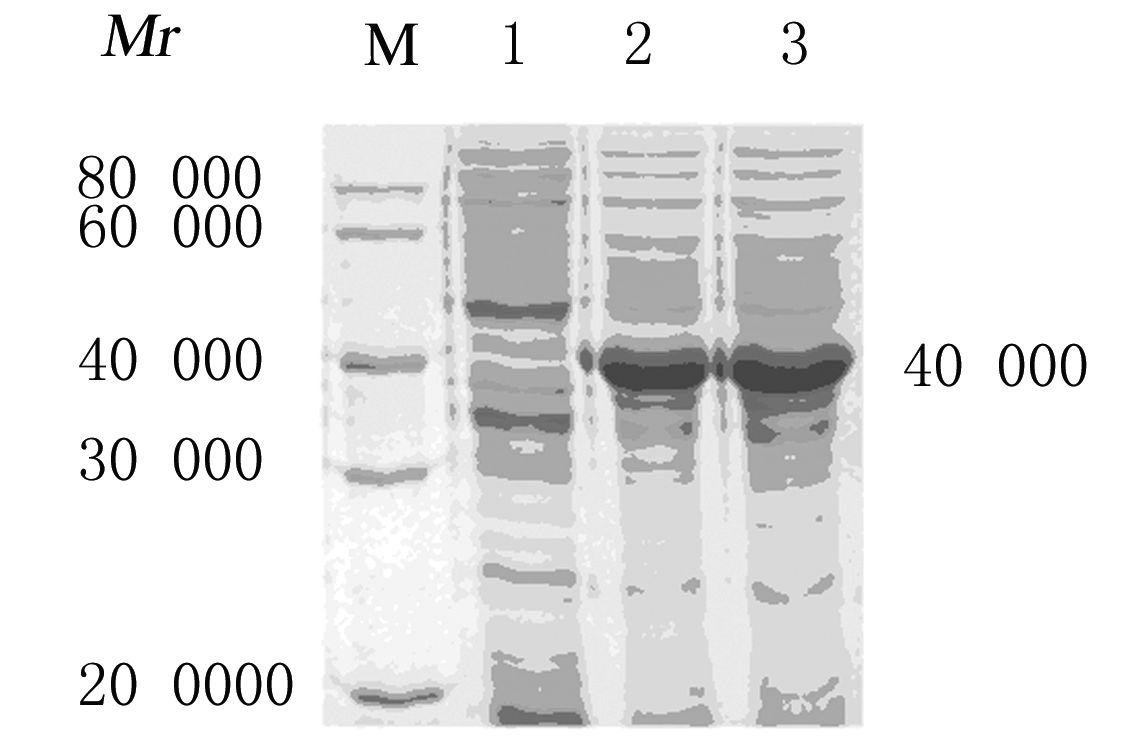
|
| M:Protein marker;Lane 1:Before induction;Lane 2:Adding lactose for one time;Lane 3:Adding lactose for two times. 图9 不同乳糖添加方式重组蛋白表达电泳图 Fig.9 Electrophoregram of recombinant protein expressions under different adding modes of lactose |
当菌体培养至A(600)为0.6~0.8时,分别加入最佳浓度的乳糖和IPTG,在相同的条件下,诱导3 h后收集1mL菌液行SDS-PAGE电泳,目标蛋白表达量分别占菌体总蛋白表达量的31.2%和23.7% (图10),乳糖做为诱导剂优于传统诱导剂IPTG。

|
| M:Protein marker;Lane 1:Before induction;Lane 2:IPTG induction;Lane 3:Lactose induction. 图10 乳糖和IPTG诱导重组蛋白表达电泳图 Fig.10 Electrophoregram of recombinant protein expressions induced by lactose and IPTG |
将收集的菌体在水浴下超声破碎后,离心收集上清液及沉淀,SDS-PAGE电泳结果:目标蛋白主要存在于沉淀当中,表明以乳糖作为诱导剂得到的SUMO-FGFR4融合蛋白以包涵体形式存在(图11)。

|
| M:Protein marker;Lane 1:Supernatant after ultrasound; Lane 2:Precipitation after ultrasound. 图11 SUMO-FGFR4 融合蛋白的可溶性分析电泳图 Fig.11 Electrophoregram of solubility analysis of SUMO-FGFR4 recombinant protein |
FGF-FGFR信号系统通过调节细胞生长、分化和迁移等过程在组织器官发育和修复过程中发挥重要作用。研究[10, 11, 12, 13]显示:FGFR基因过表达、突变、易位和缺失与肿瘤发生有密切关联,包括乳腺癌、胃癌、前列腺癌、鼻咽癌和结肠癌。目前有关FGFR4与癌症诱发的机制研究较少,但已有部分研究[14, 15]证实:FGFR4基因在非小细胞肺癌中高表达或发生突变,也可能通过抗调亡作用引起胃癌。因此体外大量表达FGFR4重组蛋白的研究,为将来研究其结构与功能提供了材料基础,对揭示其在肿瘤发生发展中的作用具有重要意义。
本研究以SUMO作为融合标签和分子伴侣,与FGFR4融合表达,使FGFR4重组蛋白能够在原核表达系统中正确折叠,进而提高蛋白可溶性。通过Overlap PCR方法获得SUMO-FGFR4融合基因,构建重组表达载体pET22b-SUMO-FGFR4,经SDS-PAGE和Western blotting法鉴定,证实SUMO-FGFR4蛋白成功表达。
本研究还观察了以乳糖作为诱导物时,不同诱导条件对重组蛋白表达量的影响,包括诱导温度、诱导时间、诱导时机、诱导浓度和乳糖添加方式等因素,以寻求增加目标蛋白表达量的最佳条件,结果表明:当菌体密度A(600)为0.8时,加入20%的乳糖至终浓度为1.0 g·L-1,在37℃的条件下诱导3 h得到的融合蛋白的表达量最高,经蛋白的可溶性分析,目标蛋白主要以包涵体形式存在。本实验将SUMO和FGFR4基因融合,而SUMO可以和Ni+结合,为蛋白通过Ni金属亲和层析纯化带来便利,从而获得较纯的FGFR4蛋白。乳糖作为天然的操纵子诱导物,与IPTG比较具备无毒、价廉且诱导效率高的优点,因此其更适合作为诱导剂大规模生产FGFR4重组蛋白[16, 17]。本研究 结果为今后融合蛋白的工业化生产提供了可靠的依据,为今后FGFR4蛋白在乳腺癌和肝癌等恶性肿瘤治疗方面的应用研究奠定了基础。
| [1] | 杜彩萍,王 梅, 段富刚,等.活化型及失活型SUMO1真核表达载体的构建及鉴定 [J].生物技术,2014,24(5): 12-16. |
| [2] | Ankara J,Sistonen L. SUMO:Getting iton [J]. Biochemist Sock Trans,2007,35(6):1409-1413. |
| [3] | Li R,Wei J,Jiang C,et al. Act SUMO elation regulates cell proliferation and tumor genesis [J]. Cancer Res,2013,73(18):5742-5753. |
| [4] | Wang W,Chen Y,Wang S,et al. PIASxα ligase enhances SUMO1:Modification of PTEN protein as a SUMO E3 ligase [J]. J Boil Chem,2014,289(6):3217-3230. |
| [5] | Jouanneau J,Moens G,Thiery JP. The community effect in FGF-1 mediated tumor progression of a rat bladder carcinoma does not involve a direct paracrine signaling [J]. Oncogene,1999,18(2):327-333. |
| [6] | 孔祥鑫,王会岩,李校堃. 成纤维细胞生长因子受体4的研究 [J]. 生命的化学,2010,30 (5):717-722. |
| [7] | 李 祥,吕建新,彭 颖,等. 脊椎动物成纤维细胞生长因子及其受体 [J]. 解剖科学进展,2008,14(3): 337-340. |
| [8] | Tanuma J, Izumo T,Hirano M,et al. FGFR4 polymorphism,TP53 mutation,and their combinations are prognostic factors for oral squamous cell carcinoma [J]. Oncol Rep,2010,23(3):739-744. |
| [9] | Fitzgerald LM,Karlis E,Karyadi DM,et al. Association of FGFR4 genetic polymorphisms with prostate cancer risk and prognosis [J]. Prostate Cancer Prostatic Dis,2009,12(2):192-197 |
| [10] | Murase H, Inokuchi M,Takagi Y,et al. Prognostic significance of the co-overexpression of fibroblast growth factor receptors 1,2 and 4 in gastric cancer [J]. Mol Clin Oncol,2014,2(4):509-517. |
| [11] | Shi S,Li X,You B,et al. High Expression of FGFR4 Enhances Tumor Growth and Metastasis in Nasopharyngeal Carcinoma [J]. J Cancer,2015,6(12):1245-1254. |
| [12] | Bai YP,Shang K,Chen H,et al. FGF-1/-3/FGFR4 signaling in cancer-associated fibroblasts promotes tumor progression in colon cancer through Erk and MMP-7 [J]. Cancer Sci,2015,106(10):1278-1287. |
| [13] | Ulaganathan VK,Sperl B,Rapp UR,et al. Germline variant FGFR4 p.G388R exposes a membrane-proximal STAT3 binding site [J]. Nature,2015,528(7583):570-574. |
| [14] | Huang HP,Feng H,Qiao HB,et al. The prognostic significance of fibroblast growth factor receptor 4 in non-small-cell lung cancer [J]. Onco Targets Ther,2015,8:1157-1164. |
| [15] | Ye YW,Zhou Y,Yuan L,et al. Fibroblast growth factor receptor 4 regulates proliferation and antiapoptosis during gastric cancer progression [J]. Cancer,2011,117(23):5304-5313. |
| [16] | 田海山,唐 禄,王晓杰,等. 乳糖诱导角质细胞生长因子2在大肠杆菌中的表达 [J]. 吉林大学学报: 医学版,2010,36(2):262-266. |
| [17] | 曹文媛,叶 青,李晓峰,等.携带脑组织特异性microRNA靶序列的重组日本脑炎病毒的构建与鉴定[J]. 解放军医学杂志,2014,39(6):429-432. |
 2016, Vol. 42
2016, Vol. 42


