扩展功能
文章信息
- 田晶, 齐玲, 纪朋艳, 沈楠, 崔万丽, 王春艳
- TIAN Jing, QI Ling, JI Pengyan, SHEN Nan, CUI Wanli, WANG Chunyan
- NPPB对人脑胶质瘤SHG-44细胞凋亡的诱导作用及其机制
- Induction effect of NPPB on apoptosis of human glioma SHG-44 cells and its mechanism
- 吉林大学学报(医学版), 2016, 42(04): 637-641
- Journal of Jilin University (Medicine Edition), 2016, 42(04): 637-641
- 10.13481/j.1671-587x.20160401
-
文章历史
- 收稿日期: 2015-07-07
2. 吉林医药学院病理学教研室, 吉林 吉林 132013;
3. 吉林医药学院实验中心, 吉林 吉林 132013
2. Department of Pathology, Jilin Medical College, Jilin 132013, China;
3. Experimental Center, Jilin Medical College, Jilin 132013, China
5-硝基-2-(3-苯丙胺)苯甲酸[5-nitro-2-(3-phenylpropylamino)-benzoic acid,NPPB]为常用的氯通道阻断剂,能够阻断囊性纤维跨膜电导调节体、容量调节性氯通道和钙激活的氯通道 [1]。研究[2, 3, 4]显示:肿瘤细胞和多种其他细胞在应用NPPB后,可以抑制细胞增殖并能阻断部分药物引起的细胞凋亡。也有研究[5, 6]显示:NPPB可以增加某些化疗药物的促凋亡作用。关于NPPB单独应用对脑胶质瘤细胞的作用及其机制尚未见报道。本研究通过观察NPPB对脑胶质瘤细胞凋亡的作用,旨在为脑胶质瘤的治疗及NPPB的研究开发提供依据。
1 材料与方法 1.1 细胞株和主要试剂人脑胶质瘤SHG-44细胞株由吉林大学基础医学院提供。NPPB、噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司; NPPB用DMSO配制成0.1 mol·L-1溶液,4℃保存备用。 β-actin、Bax、Bcl-2和caspase-3抗体均购自北京中杉公司, RPMI-1640培养基购自美国Hyclone公司。
1.2 人脑胶质瘤SHG-44细胞的培养SHG-44细胞复苏后放入含10%小牛血清的RPMI-1640培养基中,置于细胞培养箱中,37℃、5%CO2及饱和湿度条件下进行培养,隔日换液1次,按1∶3进行传代。
1.3 MTT法检测SHG-44细胞活力将对数生长期的SHG-44细胞以每孔5×103个接种于96孔板中,24 h 后加入NPPB(终浓度分别为50、 100和200 μmol · L-1),分别为50、100和200 μmol · L-1NPPB组 ,同时设对照组,每个浓度设5个复孔,分别培养3、24和48h后,每孔加入20 μLMTT溶液,继续孵育4 h。弃上清后每孔加150 μL DSMO,震荡摇匀,全自动酶标仪490 nm波长处测定各孔吸光度(A)值。细胞活力=实验组A值/对照组A值×100%。
1.4 流式细胞术分析细胞凋亡率取对数生长期的SHG-44细胞,平均接种于4个25 mm2培养瓶中,每瓶1×106个细胞,置入37℃、5% CO2细胞培养箱中培养。24 h后加入NPPB(终浓度分别为50、100和200 μmol · L-1),同时设对照组,继续培养48 h。消化后Annexin V/PI染色,流式细胞术检测各样品每10000个细胞中的细胞凋亡率。细胞凋亡率 = 早期凋亡率+ 晚期凋亡率。
1.5 免疫组织化学法检测细胞中凋亡蛋白表达水平SHG-44 细胞接种于24孔板(内置无菌玻片),设对照组和100 μmol· L-1 NPPB组,培养48 h,多聚甲醛固定。采用SABC法,实验步骤按试剂盒说明书操作,DAB显色。镜下胞浆着色呈棕黄色者为阳性表达。每组每张玻片随机选择5个视野扫描,用Image-Pro Plus分析软件分析蛋白阳性产物的积分吸光度(IA)值,取平均值进行统计学分析。
1.6 蛋白免疫印记法检测细胞中凋亡蛋白表达水平取对数生长期的SHG-44细胞,平均接种于3个25 mm2培养瓶中,每瓶1×106细胞。培养 48 h后加入NPPB(终浓度分别为50和100 μmol · L-1),同时设对照组,继续培养48 h。收集细胞至1.5 mL离心管中,离心弃上清,PBS洗涤后每个样品加入40 μL细胞裂解液,充分裂解细胞。12000g 、4℃ 离心15 min,留取上清,测定样品蛋白浓度,行SDS-PAGE分离样品,转膜封闭,加入一抗4℃孵育过夜。加入二抗,室温、避光孵育1h,胶片曝光拍照。采用Quantity One 软件进行灰度分析。以β-actin蛋白为内参,以Bcl-2、Bax蛋白与β-actin蛋白灰度值的比值表示蛋白相对表达水平。
1.7 统计学分析 采用SPSS 17.0统计软件进行统计学分析。细胞活力、细胞凋亡率和细胞中凋亡蛋白表达水平以 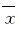 ±s表示,组间比较采用 t 检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用 t 检验。以P<0.05为差异有统计学意义。
SHG-44细胞活力 NPPB作用3h时可促进胶质瘤细胞的生长,与对照组比较,200 μmol·L-1 NPPB组细胞活力明显升高,差异有统计学意义(P<0.05)。NPPB作用24和48h时,NPPB可以明显抑制胶质瘤细胞的生长,与对照组比较,100和200 μmol·L-1NPPB组细胞活力明显降低(P<0.01)。NPPB的作用具有明显的剂量和时间效应。由于48h时抑制效果最为明显,后续实验均采用这一时间。 见表1。
(n=5,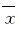 ±s) ±s) | |||
| Group | Viabilityof SHG-44 cells | ||
| (t/h) 3 | 24 | 48 | |
| Control | 100.0±9.9 | 100.0±9.87 | 100.0±22.9 |
| NPPB(μmol · L-1) | |||
| 50 | 95.5±6.2 | 97.2±13.8 | 74.8±7.1* |
| 100 | 114.0±14.6 | 65.4±3.0** | 40.3±2.4** |
| 200 | 137.8±23.5* | 58.0±8.7** | 26.6±3.4** |
| *P<0.05,**P<0.01 compared with control group. | |||
对照组及50、100和200 μmol·L-1 NPPB组细胞凋亡率分别为(4.17±0.90)%、(4.38±0.79)%、 (24.64±4.17)%和(41.85±9.35)%,与对照组比较,100和200 μmol·L-1 NPPB组细胞凋亡率明显升高(P<0.01)。
与对照组比较, 100 μmol·L-1NPPB作用SHG-44细胞48 h后,Bcl-2蛋白表达水平明显降低 (P<0.05) ,Bax和Caspase-3蛋白表达水平明显升高(P<0.05或P<0.01)。见表2。
(n=5,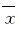 ±s) ±s) | |||
| Group | Bcl-2 | Bax | Caspase-3 |
| Control | 254.74±69.43 | 88.70±39.89 | 165.75±36.37 |
| NPPB(100 μmol·L-1) | 124.12±26.60* | 244.77±10.99* | 267.20±72.59** |
| *P<0.05,**P<0.01 compared with control group. | |||
各组SHG-44细胞中Bcl-2和Bax蛋白表达水平 50、100 μmol·L-1 NPPB作用SHG-44细胞48 h后,Bcl-2蛋白表达水平降低,Bax蛋白表达水平升高,与对照组比较,100 μmol·L-1 NPPB组差异有统计学意义(P<0.05)。见图1和表3。
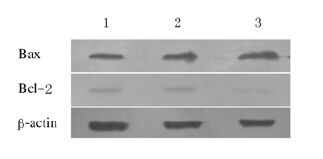
|
| 图1 各组SHG-44细胞中Bcl-2和Bax蛋白表达电泳图 Fig.1 Electrophoregram of expressions of Bcl-2 and Bax in SHG-44 cells in various groups Lane 1:Control group;Lane 2:50 μmol·L-1 NPPB group; Lane 3:100 μmol·L-1 NPPB group. |
(n=5,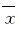 ±s) ±s) | ||
| Group | Bcl-2 | Bax |
| Control | 0.579±0.010 | 0.947±0.031 |
| NPPB( μmol·L-1) | ||
| 50 | 0.582±0.009 | 0.969±0.002 |
| 100 | 0.496±0.038* | 0.996±0.024* |
| *P<0.05 compared with control group. | ||
脑胶质瘤是中枢神经系统最常见的肿瘤,世界卫生组织将其分为Ⅰ~Ⅳ级,级别越高恶性程度越高。高级别的胶质细胞瘤占脑胶质瘤的60%,预后极差,平均存活时间不到1年,现有的治疗方法效果不佳。脑胶质瘤经常伴有基因突变(包括原癌基因和抑癌基因)及离子通道的变异。90%的多形性胶质母细胞瘤样品中检测出了离子通道及转运体的变异;小儿脑肿瘤中,33%的患者伴有离子通道及转运体表达上调,48%的患者伴有离子通道及转运体表达下调。因此,离子通道是参与脑胶质瘤发生的潜在基因,有可能成为治疗脑胶质瘤的一个新的靶点[7]。
本研究结果显示:100和200 μmol·L-1 NPPB作用SHG-44细胞3h可促进细胞增殖,而作用时间超过24h后可以明显抑制胶质瘤细胞增殖,降低细胞活力,同时100和200 μmol·L-1 NPPB可以促进细胞凋亡。氯通道分为6 类[1],分别是电压依赖氯通道、囊性纤维跨膜电导调节体、钙激活氯通道、P64相关氯通道、容量调控氯通道(volume regulated anion channels,VRAC)及配体门控氯通道。NPPB可以阻断囊性纤维跨膜电导调节体、VRAC和钙激活的氯通道。本文作者认为:NPPB的作用主要是通过抑制VRAC产生的。VRAC普遍存在于机体细胞和肿瘤细胞中,在细胞容量调控、增殖、转移和凋亡等进程中均具有十分重要的作用。目前研究[7, 8, 9]显示:VRAC参与细胞凋亡可能有2种机制,凋亡性体积减小(apoptotic volume decrease,AVD)被认为是凋亡过程中的标志性事件;K+和Cl-经钾通道和VRAC外流是细胞出现AVD的一个重要因素,而AVD是驱动细胞死亡的重要因素,给予VRAC阻断剂能够抑制AVD和细胞凋亡。另外,VRAC能够通过转运HCO3-直接降低细胞内的pH值,也能够通过易化Cl-/ HCO3-交换体分泌HCO3-间接降低细胞内pH值。细胞内酸化后激活酸性核酸内切酶,进而参与细胞凋亡的过程[10],因此,抑制VRAC可以阻碍细胞凋亡的进程。研究[5]显示:阻断VRAC可以明显促进化疗药物的促凋亡作用。某些促进凋亡的中药可以激活VRAC[11, 12]。最近,Park等[6]将替莫唑胺(temozolomide,TMZ)与NPPB共轭耦联作为新型药物应用于胶质瘤的治疗研究,结果发现:耦联后的药物在抑制胶质瘤的增殖、转移及侵袭的同时,其促进肿瘤细胞凋亡的作用也比单独应用TMZ明显加强。但NPPB促进细胞凋亡的机制尚不清楚。
凋亡的发生是个复杂的过程,包括死亡受体途径、线粒体途径和内质网途径。Bcl-2和Bax作为线粒体途径的重要成员,其表达的变化对细胞的命运起着决定性的作用[13, 14, 15, 16]。Bcl-2和Bax通常以二聚体的形式存在,在凋亡调控上游信号途径中发挥着中心性的作用。当Bax的表达水平高于Bcl-2时,Bax-Bax 同型二聚体占有绝对的优势,诱导细胞凋亡因素增加;Bcl-2表达水平高于Bax时,Bax-Bax二聚体解离,形成更稳定的Bcl-2-Bax二聚体,从而"中和"了Bax诱导凋亡的作用,细胞得以存活。因此,两者的比值决定了凋亡的启动,并在凋亡中起着重要的调节作用。本研究结果显示:NPPB作用后SHG-44细胞中Bcl-2蛋白表达水平降低,而Bax蛋白表达水平升高,这会导致促凋亡因素增加,使细胞形成更多的Bax-Bax,使下游的Caspase-3活化增加,促进细胞凋亡发生。
综上所述,本研究结果表明:NPPB在一定时间内可以促进肿瘤细胞的凋亡,并且主要是增加了Bax蛋白表达,降低了Bcl-2蛋白表达,最终引起促凋亡因素占优势。NPPB可以通过阻断细胞的容积变化减少细胞凋亡的发生、抑制肿瘤细胞的转移与侵袭,也可促进某些细胞的凋亡或促进某些化疗药物的促凋亡作用,说明NPPB对细胞生长的调节是双向的,其影响细胞的生命周期可能具有一定的时间节点或浓度阈值 ,其对细胞生长的调节还需进行更深入的研究。
| [1] | Jentsch TJ,Stein V,Weinreich F,et al. Molecular structure and physiological function of chloride channels [J]. Physiol Rev,2002,82(2):503-568. |
| [2] | 焦军东,岳 朋,杜智敏,等. 氯通道阻滞剂抑制人肾小球系膜细胞增殖[J]. 中国药理学通报,2007,23(1):86-90. |
| [3] | 范爱辉,陈丽新,毛建文,等. 阻断氯通道对鼻咽癌细胞凋亡和细胞增殖的影响 [J]. 广东医学,2006,27(12):1804-1806. |
| [4] | He D,Luo X,Wei W,et al. DCPIB,a specific inhibitor of volume-regulated anion channels (VRACs),inhibits astrocyte proliferation and cell cycle progression via G1/S arrest [J]. J Mol Neurosci,2012,46(2):249-257. |
| [5] | Kang MK,Kang SK. Pharmacologic blockade of chloride channel synergistically enhances apoptosis of chemotherapeutic drug resistant cancer stem cells[J]. Biochem Biophys Res Commun,2008,373(4):539-544. |
| [6] | Park M,Song C,Yoon H,et al. Double blockade of glioma cell proliferation and migration by temozolomide conjugated with NPPB,a chloride channel blocker[J]. ACS Chem Neurosci,2016,181(2):1328-1336. |
| [7] | Turner KL,Sontheimer H. Cl- and K+ channels and their role in primary brain tumour biology [J]. Philos Trans R Soc Lond B Biol Sci,2014,369(1638):20130095. |
| [8] | Min XJ,Li H,Hou SC,et al. Dysfunction of volume-sensitive chloride channels contributes to cisplatin resistance in human lung adenocarcinoma cells [J]. Exp Biol Med(Maywood),2011,236(4):483-491. |
| [9] | Cuddapah VA,Sontheimer H. Ion channels and transporters in cancer. 2. Ion channels and the control of cancer cell migration [J]. Am J Physiol Cell Physiol,2011,301(3):C541-549. |
| [10] | Che XF,Zheng CL,Akiyama S,et al.2-Amimophenoxazine-3-one and 2-amino-4,4α-dihydro-4α,7-dimethyl-3H-phenoxazine-3-one cause cellular apoptosis by reducing higher intracellular pH in cancer cells[J]. Proc Jpn Acad Ser B Phys Biol Sci,2011,87(4):199-213. |
| [11] | 刘善文,李 媛,李华荣,等. 小檗碱激活人结肠癌细胞容积敏感的氯通道[J].生理学报,2011,63(6):517-524. |
| [12] | 厉冰雪,藤双凤,刘镇锋,等. 熊果酸激活低分化鼻咽癌细胞氯通道和减小细胞容积[J]. 生理学报,2012,64(6):673-680. |
| [13] | Lam M,Dubyak G,Chen L,et al. Evidence that bcl-2 represses apoptosis by regulating endoplasmic reticulum-associated Ca2+ fluxes[J]. Proc Natl Acad Sci USA,1994,91(14):6569-6573. |
| [14] | Susin SA,Zamzami N,Castedo M,et al. Bcl-2 inhibits the mitochondrial release of an apoptogenic protease[J]. J Exp Med,1996,184(4):1331-1341. |
| [15] | 赵 佳,郝利铭,姜文华,等.新霉素对脑胶质瘤细胞增殖及PDGF、VEGF和血管生成素表达的影响[J]. 中国实验诊断学,2014,18(10):1579-1582. |
| [16] | 袁兆新,高 寒,池 明,等.CLIC4在饥饿诱导神经胶质瘤细胞自噬中的作用[J]. 中国实验诊断学,2015,19(5):707-710. |
 2016, Vol. 42
2016, Vol. 42


