扩展功能
文章信息
- 李凤娥, 向国艳, 孔繁利, 郝峰, 杨紫嫣, 郑岩, 方芳
- LI Fenge, XIANG Guoyan, KONG Fanli, HAO Feng, YANG Ziyan, ZHENG Yan, FANG Fang
- pEGFP-N1脂质体转染方法的优化及其应用
- Optimization of liposome-mediated transfection of pEGFP-N1 and its applification
- 吉林大学学报(医学版), 2016, 42(03): 612-616
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 612-616
- 10.13481/j.1671-587X.20160338
-
文章历史
- 收稿日期: 2016-01-17
2. 北华大学基础医学院病理生理教研室, 吉林 吉林132013;
3. 吉林医药学院生物化学检验教研室, 吉林 吉林 132013;
4. 吉林医药学院病原教研室, 吉林 吉林 132013
2. Department of Pathophysiology, School of Basic Medical Sciences, Beihua University, Jilin 132013, China;
3. Department of Biochemistry Laboratory, Jilin Medical College, Jilin 132013, China;
4. Department of Pathogen, Jilin Medical College, Jilin 132013, China
目的基因导入并表达于真核细胞是确定目的基因生物学活性的必要方法之一,目前常用的目的基因导入方法有电穿孔、病毒介导转染和脂质体转染等。其中,脂质体介导的转染法因具有操作简便性和经济适用性,且不需要特殊仪器设备等优点而被广泛采用[1, 2, 3]。在应用脂质体介导的转染方法时,获取较高的转染效率是成功转染的关键。检测转染效率可采用免疫荧光、实时荧光定量PCR和Western blotting等方法,但上述方法步骤繁琐,并且价格较高。绿色荧光蛋白因其较低的细胞毒性和易检测性而被广泛应用于生命科学的各个领域[4, 5, 6]。本研究选用可表达绿色荧光蛋白的pEGFP-N1真核载体作为目的基因,以不同配比的质粒与脂质体转染入Fisher大鼠甲状腺滤泡上皮细胞,该细胞具有贴壁性强、生长速度适中和可高效表达异源基因等特性,是合适的高通量细胞筛选模型候选者[7, 8, 9, 10]。甲状腺滤泡上皮细胞可用于进一步检测绿色荧光蛋白的表达效率和细胞毒性,获取相应的优化转染条件,同时应用其他载体转染Fisher大鼠甲状腺滤泡上皮细胞,获取优化转染条件,并比较pEGFP-N1的优化转染条件是否是其他载体的优化转染条件,证实pEGFP-N1优化的转染条件是否具有较为广泛的适用性,是否可用作后续目的基因高效转染优化条件。
1 材料与方法 1.1 细胞、主要试剂和仪器Fisher大鼠甲状腺滤泡上皮细胞pEGFP-Aquaporin2、pEGFP-Aquaporin4和pEGFP-Aquaporin5为大连医科大学麻彤辉教授馈赠。pEGFP-N1真核表达载体(Clontech 公司,美国),Lipofectamine2000(Invitrogen公司,美国)。 倒置荧光显微镜(尼康公司,日本),流式细胞仪(Beckman Coulter公司,美国),Nanodrop2000分光光度计(Thermol公司,美国)。
1.2 细胞转染细胞复苏后传2~3代,待长势良好时接种于24孔板,16 h后分别挑选融合度达75%的细胞进行转染。转染前,将质粒和脂质体分别用F12coon’s基本培养液稀释至125 μL,并充分混匀,静置10 min后将稀释的质粒与脂质体充分混合,室温下静置10 min。吸掉细胞旧培养液,PBS洗涤3次,将质粒与脂质体混合物分别逐滴加入,并置于37℃、5%CO2细胞培养箱中培养,6 h后换成完全培养液继续培养。
1.3 转染条件的优化 1.3.1 质粒与脂质体比例的优化24孔板中挑选细胞融合度达75%的孔,将质粒与脂质体分别以1:2(0.8 μg:1.6 μL)、1:3(0.8 μg:2.4 μL)、1:4(0.8 μg:3.2 μL)和1:5(0.8 μg:4.0 μL)的比例进行转染,每组设计3个复孔。分别于转染后36 h,于倒置荧光显微镜下观察甲状腺滤泡上皮细胞中增强型绿色荧光蛋白 (enhanced green fluorescence protein,EGFP) 的表达情况,并收集细胞制成单细胞悬液,800 r·min-1离心5 min,弃去旧培养液,加入3 mL PBS重悬5 min,流式细胞术检测转染效率;将细胞悬液与0.4%台盼蓝溶液以9:1的比例混匀(终浓度为0.04%),5 min后计算细胞存活率。细胞存活率=活细胞数/(活细胞数+死细胞数)×100%。
1.3.2 质粒与脂质体量的优化24孔板中挑选细胞融合度达75%的孔,调整质粒与脂质体的比例为1:4,并分别以0.8 μg:3.2 μL、1.6 μg:6.4 μL、3.2 μg:12.8 μL和6.4 μg:25.6 μL的比例进行转染,每组设置3个复孔。具体检测方法同1.3.1。
1.4 pEGFP-Aquaporin2、pEGFP-Aquaporin4和pEGFP-Aquaporin5转染条件的优化在上述条件下,分别将pEGFP-Aquaporin2、pEGFP-Aquaporin4和pEGFP-Aquaporin5转入Fisher大鼠甲状腺滤泡上皮细胞中。在转染后12、24、36和48 h时,倒置荧光显微镜下观察EGFP的表达情况,流式细胞术检测转染效率,台盼蓝染色法检测细胞存活率。
2 结果 2.1 转染所用载体质量的鉴定以pEGFP-N1为例,经Nanodrop 2000 检测质粒的质量,结果显示:在260 nm处有最高峰,A(260)/A(280)约为1.79,A(260)/A(230)约为2.12。表明所测核酸 pEGFP-N1符合实验要求。见图 1。
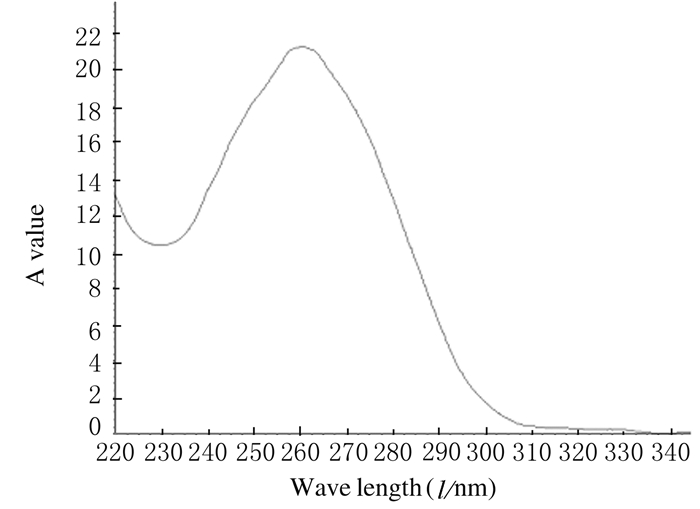
|
| 图 1 pEGFP-N1载体的质量 Fig.1 Quality of pEGFP-N1 |
质粒和脂质体以1:2(0.8 μg:1.6 μL)、1:3(0.8 μg:2.4 μL)、1:4(0.8 μg:3.2 μL)和1:5(0.8 μg:4.0 μL)转染时,随着比例的减小,转染效率呈上升趋势,转染效率分别为(31.35±0.89)%、(37.51±0.93)%、(43.17±0.62)%和(41.08±0.53)%;细胞存活率分别为(71.53±0.52)%、(67.29±0.72)%、(65.07±0.55)%和(63.13±0.86)%。可见当质粒和脂质体的比例为1:4(0.8 μg:3.2 μL)时,细胞转染效率达最高。因此,优化的质粒和脂质体的比例为1:4(0.8 μg:3.2 μL)。见图 2(插页四)和3。
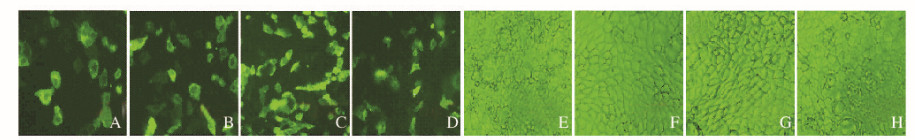
|
| A-D; Dark field; E-H; Bright field. A,E: 1; 2(0.8 μg; 1.6 μL);B,F:1; 3(0.8 μg; 2.4 μL);C,G: 1; 4(0.8 μg; 3.2 μL);D,H: 1; 5(0.8 μg; 4.0 μL). 图 2 质粒和脂质体比例不同时Fischer大鼠甲状腺滤泡上皮细胞中EGFP的表达 (bar=100μm) Fig.2 EGFP expressions in thyroid follicular epithelial cells of Fischer rats with different ratios of plasmids to liposomes (bar=100 μm) |
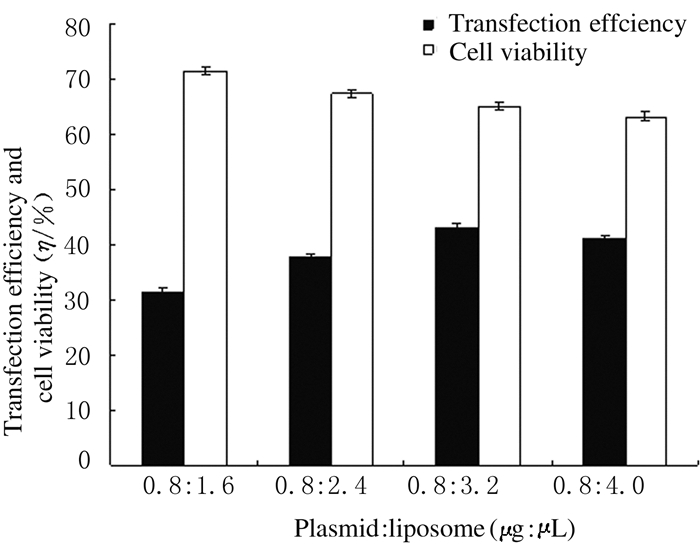
|
| 图 3 质粒和脂质体比例不同时Fischer大鼠甲状腺滤泡上皮细胞中pEGFP-N1的转染效率和细胞存活率 Fig.3 Transfection efficiencies of pEGFP-N1 and cell viabilities in thyroid follicular epithelial cells of Fischer rats with different ratios of plasmids to liposomes |
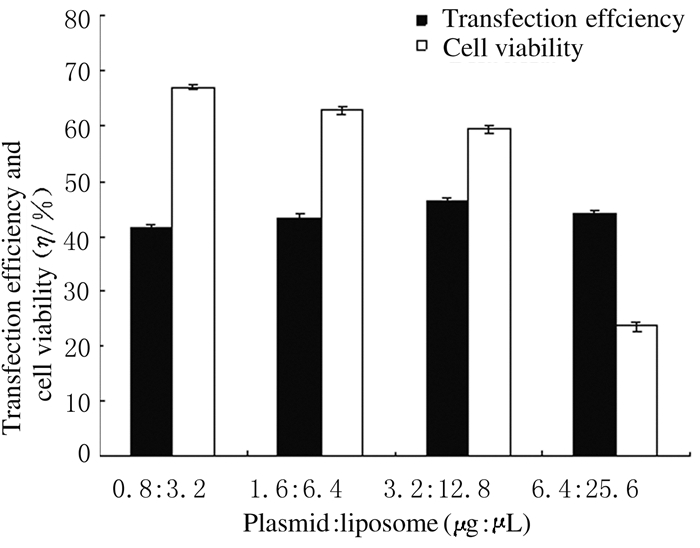
质粒和脂质体分别以0.8 μg:3.2 μL、1.6 μg:6.4 μL、3.2 μg:12.8 μL和6.4 μg:25.6 μL进行转染时,随着质粒和脂质体质量的增加,转染效率小幅度上升,转染效率分别为(41.51±0.66)%、(43.21±0.83)%、(46.13±0.95)%和(44.13±0.59)%。但是过多的脂质体对细胞有毒害作用,当脂质体质量达25.6 μL时,细胞大量死亡。各孔细胞存活率分别为(67.03±0.51)%、(62.78±0.52)%、(59.35±0.71)%和(23.61±0.79)%。可见,质粒和脂质体以3.2 μg:12.8 μL的质量比转染时,可获得较高的转染效率和存活率。因此,优化的质粒和脂质体的量分别为3.2 μg和12.8 μL。见图 4(插页四)和5。
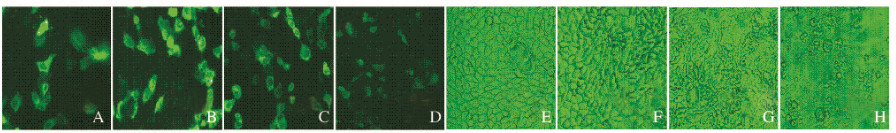
|
| A-D: Dark field; E-H: Bright field. A,E: 0.8 μg; 3.2 μL; B,F: 1.6 μg; 6.4 μL; C,G: 3.2 μg; 12.8 μL; D,H: 6.4 μg; 25.6 μL. 图 4 质粒和脂质体质量不同时Fischer大鼠甲状腺滤泡上皮细胞中EGFP的表达(bar=100μm) Fig.4 EGFP expressions in thyroid follicular epithelial cells of Fischer rats with different quantities of plasmids and liposomes (bar=100 μm) |
|
| 图 5 质粒和脂质体质量不同时Fischer大鼠甲状腺滤泡上皮细胞中pEGFP-N1的转染效率和细胞存活率 Fig.5 Transfection efficiencies of pEGFP-N1 and cell viabilities in thyroid follicular epithelial cells of Fischer rats with different quantities of plasmids and liposomes |
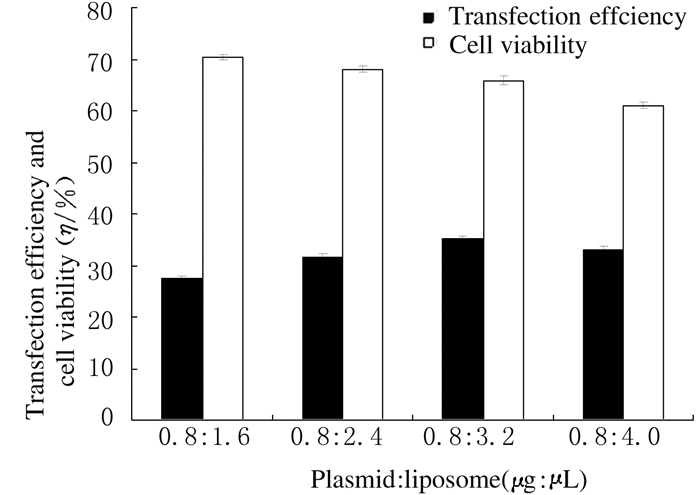
pEGFP-Aquaporin2、pEGFP-Aquaporin4和pEGFP-Aquaporin5获得优化转染效率的条件与pEGFP-N1优化条件相同,即在质粒和脂质体的配比为1:4(3.2 μg:12.8 μL)时获得最高的转染效率。以pEGFP-Aquaporin2为例,转染结果显示:质粒和脂质体以1:2(0.8 μg:1.6 μL)、1:3(0.8 μg:2.4 μL)、1:4(0.8 μg:3.2 μL)和1:5(0.8 μg:4.0 μL)转染时,随着质量比例的减小,转染效率呈上升趋势,分别为(27.35%±0.57)%、(31.51%±0.72)%、(35.17%±0.58)%和(33.08%±0.63)%,细胞存活率分别为(70.33%±0.48)%、(68.05%±0.57)%、(65.83%±0.81)%和(61.07%±0.61)%,表明优化的转染比例为1:4,即与pEGFP-N1的优化比例相同(图 6),pEGFP-Aquaporin4和pEGFP-Aquaporin5转染结果与pEGFP-Aquaporin2趋势一致。
|
| 图 6 质粒质量固定而脂质体质量逐渐增加时Fischer大鼠甲状腺滤泡上皮细胞中pEGFP-Aquaporin2的转染效率和细胞存活率 Fig.6 Transfection efficiencies of pEGFP-Aquaporin2 and cell viabilities in thyroid follicular epithelial cells of Fischer rats with certain quantity of plasmid and increased lipsome quantities |
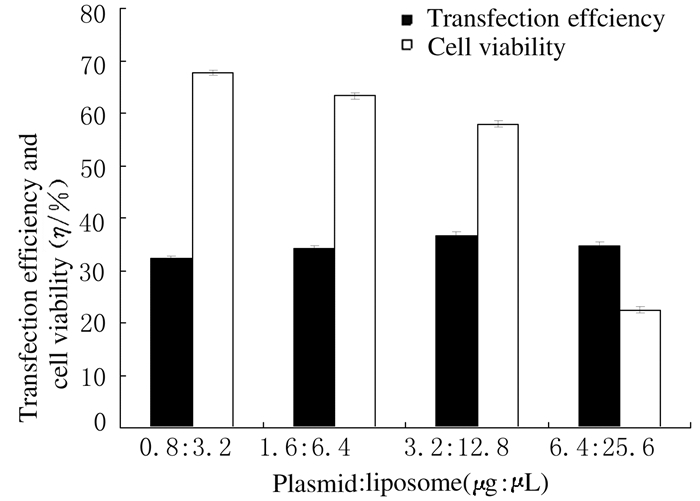
在质粒和脂质体分别以0.8 μg:3.2 μL、1.6 μg:6.4 μL、3.2 μg:12.8 μL和6.4 μg:25.6 μL的比例转染时,随着质粒和脂质体质量的增加,转染效率小幅度升高,转染效率分别为(32.19%±0.62)%、(34.11%±0.57)%、(36.65%±0.67)%和(34.67%±0.83)%。但过多的脂质体对细胞有毒性作用,当脂质体用量达25.6 μL时,细胞大量死亡。各孔细胞存活率分别为(67.62%±0.49)%、(63.31%±0.58)%、(57.86%±0.62)%和(22.53%±0.53)%。表明质粒和脂质体以1:4(3.2 μg:12.8 μL)的配比转染时获得较佳的转染效率,即与pEGFP-N1优化的转染条件相同(图 7)。pEGFP-Aquaporin4和pEGFP-Aquaporin5结果与pEGFP-Aquaporin2一致。
|
| 图 7 质粒和脂质体比例固定而质量逐渐增加时Fischer大鼠甲状腺滤泡上皮细胞中pEGFP-Aquaporin2的转染效率和细胞存活率 Fig.7 Transfection efficiencies of pEGFP-Aquaporin2 and cell viabilities in thyroid follicular epithelial cells of Fischer rats with certain ratio of plasmid to liposome and increased quantities |
脂质体介导的转染方法是研究目的基因生物学活性的最常用方法,而获得高效的转染效率是脂质体介导转染方法成功的关键[11, 12, 13]。通常为了获得更高的表达效率,在转染不同目的基因和应用不同受体细胞时均需要进行优化转染条件的摸索,目的基因的转染和表达效率的检测方法有多种,常用的方法有实时荧光定量PCR和免疫荧光等,分别从mRNA和蛋白水平检测,还可以通过相应的功能实验检测[14, 15]。但上述方法均较为费时费力,如何获知优化的转染条件,以便获得较高的转染效率和较高的目的基因表达情况,进而为后续目的基因的生物学活性研究奠定基础成为转染的重点和难点。本研究选取pEGFP-N1真核表达载体中的绿色荧光蛋白作为目的基因,pEGFP-N1载体中的绿色荧光蛋白前具有起始密码子并具有KOZAK序列,可作为脂质体介导转染的报告基因,采用倒置荧光显微镜和流式细胞术可简便、高效和可靠地检测其转染效果和表达效率,较为容易地检测出转染效率。本研究首先获知脂质体和质粒的优化比例,并进一步相应增加优化比例情况下的 质粒和脂质体的质量,最终获得较好的质粒和脂质体的配比,即优化的转染条件。为了证实pEGFP-N1所优化条件的有效性,进行了Aquaporin2、Aquaporin4和Aquaporin5的转染,结果证实:虽然在优化的转染条件下Aquaporin2、Aquaporin4和Aquaporin5的转染效率低于pEGFP-N1的转染效率(其原因可能是Aquaporin2、Aquaporin4和Aquaporin5的目的基因比EGFP的相对分子质量大),但 其质粒和脂质体配比的优化转染条件相同。因此,本研究结果证实:在应用脂质体介导的转染时,可首先应用pEGFP-N1摸索优化的转染条件,并应用该优化转染条件作为目的基因的转染条件,即pEGFP-N1优化的转染条件具有较为广泛的适用性,可用作后续目的基因高效转染的优化条件。例如,今后应用脂质体介导的方法转染某种目的基因入某种特定细胞时,可首先选用pEGFP-N1转染入该细胞,摸索出优化的转染条件后,应用该优化的转染条件(质粒和脂质体的配比)转染目的基因进入特定的受体细胞,可获得较高的转染效率。
| [1] | Montier T,Benvegnu T,Jaffrès PA,et al. Progress in cationic lipid-mediated gene transfection:a series of bioinspired lipids as an example[J].Curr Gene Ther,2008,8(5):296-312. |
| [2] | Bochicchio S,Dalmoro A,Barba AA,et al.Liposomes as siRNA delivery vectors[J].Curr Drug Metab,2014,15(9):882-892. |
| [3] | Haynes MT,Huang L.Lipid-coated calcium phosphate nanoparticles for nonviral gene therapy[J].Adv Genet,2014,88:205-229. |
| [4] | Tsien RY.The green fluorescent protein[J].Annu Rev Biochem,1998,67:509-544. |
| [5] | Verkhusha VV,Lukyanov KA.The molecular properties and applications of Anthozoa fluorescent proteins and chromoproteins[J].Nat Biotechnol,2004,22(3):289-296. |
| [6] | Zheng K,Xu HJ,Zang YX,et al.Effect of enhanced green fluorescent protein fusion on Ano1 physiological feature[J].Sheng Li Xue Bao,2015,67(6):623-628. |
| [7] | Verkman AS,GaLietta LJ.Chloride channels as drug targets [J].Nat Rev Drug Discov,2009,8 (2):153-171. |
| [8] | 郝 峰,白雪松, 鞠晓红.TMEM16A钙激活氯离子通道在Fisher大鼠甲状腺滤泡上皮细胞的表达及其电生理特性研究[J].中国病理生理杂志,2014,30(9):1633-1639. |
| [9] | 李凤娥,郝 峰,藏雨轩,等.重组EGFP-aquaporin-4融合蛋白真核表达载体的构建及其在FRT细胞中的表达和定位[J].吉林大学学报:医学版,2013,39(2):273-277,428. |
| [10] | Piechowicz KA,Truong EC,Javed KM,et al.Synthesis and evaluation of 5,6-disubstituted thiopyrimidine aryl aminothiazoles asinhibitors of the calcium-activated chloride channel TMEM16A/Ano1[J].J Enzyme Inhib Med Chem,2016:1-7. |
| [11] | Nath S,Dancourt J,Shteyn V,et al.Lipidation of the LC3/GABARAP family of autophagy proteins relies on a membrane-curvature-sensing domain in Atg3[J].Nat Cell Biol,2014,16(5):415-424. |
| [12] | Xu H,Li Z,Si J.Nanocarriers in gene therapy:a review[J].J Biomed Nanotechnol,2014,10(12):3483-3507. |
| [13] | Ramamoorth M,Narvekar A.Non viral vectors in gene therapy-an overview[J].J Clin Diagn Res,2015,9(1):GE01-6. |
| [14] | Junquera E,Aicart E.Cationic lipids as transfecting agents of DNA in gene therapy[J].Curr Top Med Chem,2014,14(5):649-663. |
| [15] | Yang J,Liu H,Zhang X.Design,preparation and application of nucleic acid delivery carriers[J].Biotechnol Adv,2014,32(4):804-817. |
 2016, Vol. 42
2016, Vol. 42


