扩展功能
文章信息
- 孙牧男, 方艳秋, 刘磊, 马寅芙, 魏海峰, 谭岩
- SUN Munan, FANG Yanqiu, LIU Lei, MA Yinfu, WEI Haifeng, TAN Yan
- 小细胞肺癌患者外周血中Th9细胞水平检测及其临床意义
- Detection of Th9 cells in peripheral blood of patients with small cell lung cancer and its clinical significance
- 吉林大学学报(医学版), 2016, 42(03): 561-564
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 561-564
- 10.13481/j.1671-587X.20160327
-
文章历史
- 收稿日期: 2015-10-13
小细胞肺癌(small cell lung cancer,SCLC)属于恶性程度较高的一种肺癌,在肺癌中所占比例为20%~25%,其易复发、转移,总体5年生存率约为5%,严重威胁人类健康 [1, 2, 3, 4]。近年研究[5, 6, 7, 8]表明:机体的炎症反应与SCLC的发生、转移和侵袭过程肿瘤的炎性微环境主要由T、B和NK等免疫细胞及其分泌的多种细胞因子构成,其中辅助性T淋巴细胞(T helper cells,Th)包括Th1、Th2和Th17细胞,发挥着重要的功能。研究[9, 10, 11]表明:Th细胞能够调节T和B细胞的增殖、分化和成熟,并能够募集并活化中性粒细胞等免疫细胞,调节机体炎症反应。研究[12]显示:一种辅助性T细胞—Th9细胞在炎症反应的过程中发挥重要作用。Th9细胞在肺癌患者胸腔积液中的数量有所增加,并能够通过活化转录信号转导子与激活子3(STAT3)信号来促进肿瘤增殖和迁移;Th9细胞分泌的白细胞介素9(IL-9)可以促进肺癌细胞对单层胸膜间皮细胞的黏附,IL-9的表达受E2A和GATA-3等转录因子调节[13]。因此Th9细胞在肺癌细胞的增殖、凋亡和迁移过程中可能发挥重要的免疫调节作用。本研究旨在通过检测SCLC患者外周血Th9细胞比例和血清中IL-9水平,探讨Th9细胞及IL-9作为SCLC诊断分子标记的可能性。
1 资料与方法 1.1 研究对象收集2013—2014年本院收治36例SCLC患者的临床资料(SCLC组),其中男性30例,女性6例;所有患者均经穿刺活检病理学检查确诊。根据临床目前最常用的美国退伍军人医院制定的SCLC分期系统,将SCLC分为局限期和扩散期2个阶段,本研究中局限期患者20例(局限期SCLC组),扩散期患者16例(扩散期SCLC组)。所有患者在术前均未接受过放疗、化疗、免疫治疗或其他抗肿瘤治疗。另招募健康志愿者10人作为健康对照组,其中男性8人,女性2人;均经过体检排除各脏器病变、系统性疾病和感染性疾病。
1.2 标本采集分别抽取健康志愿者和SCLC患者手术前的清晨空腹静脉血各10 mL。1 500 r·min-1离心10 min,分离血清,血清冻存于-80℃冰箱中待检,剩余外周血用于分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。
1.3 主要试剂和仪器淋巴细胞分离液购自北京索莱宝科技有限公司,离子霉素和佛波酯(PMA)购自美国Sigma公司,布雷杆式菌素A(BFA)购自上海前尘生物科技有限公司,RPMI1640、Hank’s液等均购自美国Gibco公司,FITC-Anti-Human IL-9抗体和PE-Anti-Human CD4抗体均购自美国BD公司,抗人IL-9 ELISA检测试剂盒购自美国R&D公司。BD FACS Calibur流式细胞仪购自美国BD公司。
1.4 ELISA法检测各组研究对象外周血中IL-9水平实验设置空白孔(不加样品和酶标试剂,其余各步骤操作相同)、标准孔和待测样品孔。按说明书将标准品进行梯度稀释,同时用样品稀释液将待测样品稀释5倍,取稀释好的标准品和样品各50 μL,加入到经过预包被的96孔板中,每板设2个空白孔作为对照。经室温孵育1 h后,加洗涤液洗3次,随后每孔中加入50 μL辣根过氧化物酶标记的链霉卵白素,经37℃孵育30 min,洗涤3次后再加入50 μL酶作用底物,室温孵育20 min,待底物显色后每孔中加入50 μL终止液,以空白孔调零,15 min内测定各孔在450 nm处的吸光度(A)值。以标准物的浓度为横坐标,A值为纵坐标,在坐标纸上绘出标准曲线,根据样品的A值计算出样品浓度,外周血中IL-9水平以ng·L-1表示。
1.5 流式细胞术检测各组研究对象外周血中Th9细胞比例将等体积生理盐水加入新鲜的外周血样本中,混匀后再缓慢加入等体积的淋巴细胞分离液,1 300 r·min-1离心30 min,分离中间的白色PBMCs至另一离心管中,加PBS洗涤2次后,用含10%FBS的RPMI1640培养液重悬细胞,细胞计数后调整密度至5×106 mL-1,随后接种于24孔板,37℃、5%CO2孵箱培养。采用PMA(终浓度0.5 g·L-1)和离子霉素(终浓度1 mg·L-1)联合刺激PBMCs,2 h后在孔板内加入BFA(终浓度1 mg·L-1),继续孵育4 h,收集细胞,加PE-Anti-Human CD4一抗,室温避光孵育30 min,固定破膜后加入FITC-Anti-Human IL-9抗体,室温避光孵育30 min,PBS洗涤2次,流式细胞仪上机检测。依据流式检测图,在外周血淋巴细胞中以CD4设门,在CD4+淋巴细胞中观察IL-9+细胞亚群(即Th9细胞)占总CD4+T淋巴细胞的比例。
1.6 统计学分析采用SPSS 13.0统计软件进行统计学分析。各组研究对象血清中IL-9水平和患者外周血中Th9细胞占总CD4+T淋巴细胞的比例均以x±s表示,组间比较采用独立样本t检验(正态分布数据)或非参数Mann-Whitney U检验(非正态分布数据)。以α = 0.05 为检验水准。
2 结 果 2.1 各组研究对象外周血中IL-9水平ELISA检测结果显示:与健康对照组比较,SCLC组患者外周血中IL-9水平明显升高(P<0.01);扩散期SCLC组患者外周血中IL-9水平明显高于局限期SCLC组(P<0.01)。与肿瘤体积>5cm组比较,肿瘤体积<5cm组SCLC患者外周血中IL-9水平降低(P<0.01);SCLC组患者外周血中IL-9表达水平和比较差异无统计学意义(P>0.05)。见表 1。
| [x±s,ρB /(ng·L-1)] | ||||
| Characteristic | n | IL-9 | t | P |
| *P<0.01 vs healthy control group; △P<0.01 vs tumor size<5 cm group; #P <0.01 vs limited stage SCLC group. | ||||
| Healthy control SCLC | 10 36 | 4.23±1.4 7.31±1.83* | 4.001 | 0.003 |
| Age(year) | ||||
| <56 ≥56 | 14 22 | 6.94±1.02 7.65±1.67 | 1.863 | 0.108 |
| Gender | ||||
| Male Female | 30 6 | 7.76±0.91 6.83±1.12 | 1.325 | 0.091 |
| Tumor size (cm) | ||||
| <5 ≥5 | 16 20 | 6.41±0.78 7.95±1.84△ | 2.467 | 0.009 |
| Stage | ||||
| Limited stage Expensive stage | 20 16 | 5.68±1.41 8.64±0.37# | 3.089 | 0.008 |
与局限期SCLC组比较,扩散期SCLC组患者外周血中Th9细胞(即CD4+IL-9+T细胞)在总CD4+ T细胞中所占比例明显升高(P<0.01);SCLC患者外周血中Th9细胞比例均高于健康对照组(P<0.01)。见图 1(插页三)和表 2。
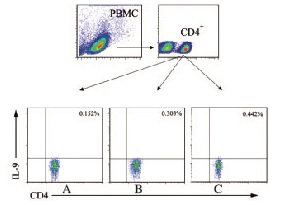
|
| 图1 流式细胞术检测健康对照组研究对象(A)和局限期SCLCS组(B)以及扩散期SCLC组(C)患者外周血中Th9细胞比例 Fig.1 Ratios of Th9 clls in peripheral blood of subjects in healthy control group (A) and limited stage SCLC group (B) and expensive stage SCLC group(C) |
| (x±s,η/%) | ||||
| Characteristic | n | Th9 | t | P |
| *P<0.01 vs healthy control group; △P < 0.01 vs limited stage SCLC group. | ||||
| Healthy control SCLC | 10 36 | 0.14±0.05 0.41±0.06* | 3.731 | 0.004 |
| Limited stage Expensive stage | 20 16 | 0.35±0.04 0.46±0.02△ | 2.825 | 0.008 |
CD4+T细胞分为Th1和Th2 2种细胞亚型,其中肿瘤组织中多为Th2类细胞因子,因此肿瘤组织生长环境中的Th2细胞及其相关因子占优势地位被认为是肿瘤细胞免疫逃逸的重要机制之一。后来的研究陆续发现了Th17和调节性T细胞等新的亚型,进一步探讨了CD4+T细胞的功能。Th9细胞是近几年发现的一类属于CD4+亚群的效应性T细胞,当静息T细胞经TGF-β和IL-4共同刺激后可分化为Th9细胞,Th2细胞也可在TGF-β单独诱导后分化为Th9细胞。Th9细胞主要分泌的效应因子为IL-9,其参与多种感染性疾病、自身免疫性疾病等的发生发展过程,有重要的免疫调节作用[14, 15, 16]。已有研究[17, 18]证明:IL-9能够抑制嗜酸性粒细胞凋亡,并同时诱导前体嗜酸性粒细胞成熟,最终导致嗜酸性粒细胞数量增多;IL-9还可诱导哮喘患者体内中性粒细胞数量增多,加强中性粒细胞引起的炎症反应;此外,IL-9还可引起嗜酸性粒细胞和T淋巴细胞浸润到组织细胞间质中,诱导上皮细胞中黏蛋白表达水平升高。
肿瘤组织中的炎性微环境已经被公认为是肿瘤细胞增殖、侵袭和转移的重要介质,肺癌发生发展同样与机体的炎症反应密不可分。本研究结果显示:SCLC组患者血清中IL-9水平较健康对照组明显升高,并且扩散期SCLC组患者血清中Th9细胞占CD4+T细胞比例与局限期SCLC组患者比较也明显增高,提示Th9细胞及其分泌的IL-9在SCLC的发生、转移和侵袭过程中可能具有直接的促进作用。
已有研究[19]表明:IL-9诱导的细胞活化主要是通过激活IL-9/IL-9R信号通路,进而启动JAK/STAT信号转导来实现的。JAK/STAT通路在细胞增殖和分化中具有重要作用,IL-9与其受体结合后,能够激活JAK信号并进一步激活STAT1、STAT3和STAT5,从而诱导细胞增殖并同时抑制其发生凋亡。因此IL-9表达水平异常升高将会导致细胞持续增殖并促进其转化为具有侵袭性的恶性细胞,这可能是Th9细胞促进肺癌发生发展的重要机制。
随着对Th9细胞功能研究的深入,其在多种免疫疾病和肿瘤中的作用得到越来越广泛的认可。本研究结果提示:Th9细胞及其分泌的IL-9可能够成为提示SCLC进展的重要分子标志,但是其发挥免疫调节作用的详细机制还需进一步研究。
| [1] | Beasley MB,Brambilla E,Travis WD. The 2004 World Health Organization classification of lung tumors [J].Semin Roentgenol,2005,40(2):90-97. |
| [2] | Travis WD,Travis LB,Devesa SS.Lung cancer [J].Cancer,1995,75(1Suppl1):191-202. |
| [3] | Worden FP,Kalemkerian GP.Therapeutic advances in small cell lung cancer [J].Expert Opin Investig Drugs,2000,9(3):565-579. |
| [4] | Socinski MA,Bogart JA.Limited-stage small-cell lung cancer:the current status of combined-modality therapy [J].J Clin Oncol,2007,25(26):4137-4145. |
| [5] | Seow A,Ng DP,Choo S,et al.Joint effect of asthma/atopy and an IL-6 gene polymorphism on lung cancer risk among lifetime non-smoking Chinese women [J].Carcinogenesis,2006,27(6):1240-1244. |
| [6] | Johnson SK,Kerr KM,Chapman AD,et al.Immune cell infiltrates and prognosis in primary carcinoma of the lung [J].Lung Cancer,2000,27(1):27-35. |
| [7] | Hiraoka K,Miyamoto M,Cho Y,et al.Concurrent infiltration by CD8+ T cells and CD4+ T cells is a favourable prognostic factor in non-small-cell lung carcinoma [J].Br J Cancer,2006,94(2):275-280. |
| [8] | Munn DH,Bronte V.Immune suppressive mechanisms in the tumor microenvironment [J].Curr Opin Immunol,2016,39:1-6. |
| [9] | Zhu J,Yamane H,Paul WE.Differentiation of effector CD4 T cell populations [J].Ann Rev Immunol,2010,28:445-489. |
| [10] | Cox CA,Shi G,Yin H,et al.Both Th1 and Th17 are immunopathogenic but differ in other key biological activities [J].J Immunol,2008,180(11):7414-7422. |
| [11] | Davidson MG,Alonso MN,Yuan R,et al.Th17 cells induce Th1 polarizing monocyte-derived dendritic cells [J].J Immunol,2013,191(3):1175-1187. |
| [12] | Ye ZJ,Zhou Q,Yin W,et al.Differentiation and immune regulation of IL-9-producing CD4+ T cells in malignant pleural effusion [J].Am J Respir Crit Care Med,2012,186(11):1168-1179. |
| [13] | Nakatsukasa H,Zhang D,Maruyama T,et al.The DNA-binding inhibitor Id3 regulates IL-9 production in CD4(+) T cells [J].Nat Immunol,2015,16(10):1077-1084. |
| [14] | Froidure A,Shen C,Gras D,et al.Myeloid dendritic cells are primed in allergic asthma for thymic stromal lymphopoietin-mediated induction of Th2 and Th9 responses [J].Allergy,2014,69(8):1068-1076. |
| [15] | Chen N,Lu K,Li P,et al.Overexpression of IL-9 induced by STAT6 activation promotes the pathogenesis of chronic lymphocytic leukemia [J].Int J Clin Exp Pathol,2014,7(5):2319-2323. |
| [16] | Niedbala W,Besnard AG,Nascimento DC,et al.Nitric oxide enhances Th9 cell differentiation and airway inflammation [J].Nat Commun,2014,5:4575. |
| [17] | Ma CS,Tangye SG,Deenick EK.Human Th9 cells:inflammatory cytokines modulate IL-9 production through the induction of IL-21 [J].Immunol Cell Biol,2010,88(6):621-623. |
| [18] | Li H,Rostami A.IL-9:basic biology,signaling pathways in CD4+ T cells and implications for autoimmunity [J].J Neuroimmune Pharmacol,2010,5(2):198-209. |
| [19] | Adamson AS,Collins K,Laurence A,et al.The current status of lymphocyte signaling:new roles for old players [J].Curr Opin Immunol,2009,21(2):161-166. |
 2016, Vol. 42
2016, Vol. 42


