扩展功能
文章信息
- 陈洪涛, 杨智, 吴诗品
- CHEN Hongtao, YANG Zhi, WU Shipin
- 慢性乙肝病毒感染各阶段患者外周血单个核细胞中IL-22mRNA的表达水平及其临床意义
- Expression levels of IL-22 mRNA in PBMCs of patients at different HBV infection phases and their significances
- 吉林大学学报(医学版), 2016, 42(03): 551-555
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 551-555
- 10.13481/j.1671-587X.20160325
-
文章历史
- 收稿日期: 2015-09-25
白细胞介素22(IL-22)是一种新型的细胞因子,由活化的Th22细胞、Th17细胞和Th1细胞产生。IL-22不作用于免疫细胞,不参与免疫调节效应。IL-22的靶细胞为肝脏、消化道、皮肤和肺等器官中白细胞介素22受体1(IL-22R1)表达阳性细胞,以肝细胞中表达密度最高。由于其生物学效应的独特性,IL-22成为近年各学科领域研究的热点。目前的研究[1, 2]显示:IL-22参与皮肤黏膜、消化道和呼吸道等人体天然屏障的先天性免疫,在抗感染免疫、维持天然屏障的完整性等方面起重要作用。大量的体外实验和动物模型均显示IL-22对肝细胞炎性损伤有保护作用,并能促进肝组织再生。也有研究者[3, 4]指出:IL-22能促进原发性肝癌(hepatocellular carcinoma,HCC)的进展,但研究结论尚缺少临床证据支持。本研究分析慢性乙型病毒性肝炎(chronic hepatitis B,CHB)患者外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中IL-22 mRNA在乙肝重症化演变与HCC发展中的不同作用,印证IL-22免疫效应的双重性。
1 资料与方法 1.1 一般资料126例慢性乙肝病毒(hepatitis B virus,HBV)感染者为 2011年4月—2011年12月暨南大学医学院附属深圳市人民医院感染内科和介入病房住院患者,患者一般资料见表 1。病例的诊断符合我国《慢性乙型肝炎防治指南(2010年版)》、《肝衰竭诊断指南(2012年版)》和《原发性肝癌诊疗规范(2011版)》诊断标准。纳入标准:①乙肝病毒表面抗原(hepatitis B surface antigen,HBsAg)阳性;②乙肝病毒e抗原(hepatitis B e antigen,HBeAg)阳性或阴性;③HBV-DNA定量升高;④肝功能异常者。排除标准:①并发其他类型病毒性肝炎者,如并发丙型肝炎和戊型肝炎等;②其他非病毒性肝炎及其引起的肝硬化,如药物性肝炎、酒精性肝硬化和代谢性肝硬化等;③目前有明显的非本病临床症状和体征而影响症候确定者;④因精神、语言等因素而影响资料收集者。其中CHB中度患者 (CHB中度组)33例,CHB重度患者(CHB重度组)21例,慢加急性/亚急性重型肝炎患者(重型肝炎组)16例,(活动性)乙型肝炎肝硬化患者(肝硬化组)16例,HCC患者 40 例(HCC组,Edmondson分期:Ⅲ-Ⅳ期)。同时以年龄和性别均匹配的健康者20名作为健康对照组,均来自本科室健康工作人员。所有研究对象均于本院检验科行常规 ELISA 法检测 HBsAg、抗-HBs、HBeAg、抗-HBe 和抗-HBc;Real-Time PCR 法定量检测 其HBV-DNA 载量,同时进行血常规、凝血功能、肝功能、甲胎蛋白(alpha-fetoprotein,AFP)和肝脏彩超检查。
| Group | n | Age(year) | Male/Female | ALT[λB/(U·mL-1)] | AFP[ρB/(μg·L-1)] |
| “-”: No data. | |||||
| Control | 20 | 35.6±13.1 | 9/11 | 19.1±3.5 | - |
| Moderate CHB | 33 | 31.2±12.5 | 22/11 | 260.1±168.4 | 46.9±133.4 |
| Severe CHB | 21 | 32.4±15.2 | 15/6 | 864.4±304.3 | 159.9±189.2 |
| Severe hepatitis | 16 | 41.7±19.7 | 16/0 | 1 033.8±498.8 | 80.5±58.1 |
| Cirrhosis | 16 | 48.6±21.5 | 13/3 | 101.4±58.6 | 16.2±13.9 |
| HCC | 40 | 58.8±14.9 | 28/12 | 186.5±161.5 | 9 749.1±15 320.6 |
| Group | n | TB[cB/(μmol·L-1)] | PTA(η/%) | HBV DNA(lgIU·mL-1) | |
| Control | 20 | 10.2±4.8 | 77.4±2.1 | - | |
| Moderate CHB | 33 | 40.0±10.4 | 73.1±1.9 | 7.1±2.3 | |
| Severe CHB | 21 | 106.8±46.2 | 58.2±5.8 | 7.4±1.7 | |
| Severe hepatitis | 16 | 348.2±89.3 | 30.0±5.3 | 7.2±2.6 | |
| Cirrhosis | 16 | 119.2±89.5 | 42.8±9.3 | 6.2±2.4 | |
| HCC | 40 | 171.5±82.0 | 40.8±11.1 | 5.3±2.6 | |
淋巴细胞分离液购于天津市GBD公司,RNA提取试剂Trizol购于北京TIANGEN公司,RT试剂盒、PCR试剂盒和DNA Marker均购于美国Fermetas公司,PCR引物由天津金斯瑞公司合成,Eppendorf Mastercycler gradient PCR扩增仪、Eppendorf Biospectrometer fluorescence分光光度计、电泳仪和凝胶成像分析系统购自美国Bio-Rad公司。
1.2.2 标本采集和处理抽取所有研究对象外周静脉血3~4 mL,淋巴细胞分层液密度梯度离心法分离PBMCs。按Trizol说明书步骤,提取细胞总RNA,分光光度计定量RNA纯度,A(260)/A(280)为1.9~2.0视为标本合格,总RNA定量终浓度为1.0g·L-1,-60℃保存。
1.2.3 PCR引物设计根据GenBank中的基因序列,采用Premier5软件分别设计人IL-22和人β-actin引物(β-actin为内参照),所有引物由天津金斯瑞公司合成。IL-22上游引物:5′-TCTTGGTACAGGGAGGAGC-3′,下游引物:5′-CCTATCAGATTGAGGGAAC-3′,扩增产物长度为254 bp;β-actin上游引物:5′- CGGGAAATCGTGCGTGACAT-3′,下游引物:5′-CAGGAAGCAAGGCTGGAAGA-3′,扩增产物长度为186 bp。
1.2.4 各组研究对象PBMCs中IL-22 mRNA表达水平的检测以提取的总RNA(12μL)为模板,按RT试剂盒说明合成cDNA,再以cDNA为模板扩增IL-22基因片段,β-actin作为内参照。反复摸索PCR最佳反应条件和反应平台期,PCR最佳反应条件为:93 ℃、2 min;94 ℃、30 s,55 ℃、30 s,72 ℃、45 s,28个循环,最后1次循环延伸5 min。PCR 产物在1.5%的琼脂糖凝胶中电泳。Bio-rad Geldoc成像系统采集电泳图片。采用Quantity One分析软件读取目的条带及内参的灰度值,同一泳道中目的条带与内参灰度比值表示目的基因mRNA的相对表达水平,将目的基因3次PCR结果的灰度比值平均值作为IL-22 mRNA相对表达水平。
1.3 统计学分析采用SPSS 19.0统计软件进行数据分析。各组研究对象的年龄、ALT、AFP、TB、PTA和HBVDNA水平及PBMCs中IL-22mRNA表达水平以x±s表示,组间均数比较采用两样本t检验;多组间均数比较采用单因素方差分析;IL-22mRNA表达水平与各临床检测指标的相关关系分析采用Pearson相关分析法。以α=0.05为检验水准。
2 结 果 2.1 各组研究对象PBMCs中IL-22 mRNA的表达水平CHB中度、CHB重度、重型肝炎、肝硬化和健康对照组研究对象PBMCs中IL-22 mRNA 的相对表达水平分别为0.734±0.062、0.744±0.036、0.602±0.041、0.757±0.064和0.561±0.038(F=66.285,P<0.001)。CHB中度、CHB重度和肝硬化组患者PBMCs中IL-22 mRNA表达水平均高于健康对照组(P< 0.001)。重型肝炎组患者PBMCs中IL-22 mRNA表达水平与健康对照组比较差异无统计学意义(P=0.83),即两者表达水平相近;而重型肝炎组患者PBMCs中IL-22 mRNA表达水平低于CHB中度、CHB重度和肝硬化组(P< 0.001)。HCC组患者PBMCs中IL-22 mRNA的表达水平为0.309±0.044,明显低于健康对照组、CHB中度组、CHB重度组和肝硬化组(P<0.001)。各组PCR产物电泳结果见图 1。
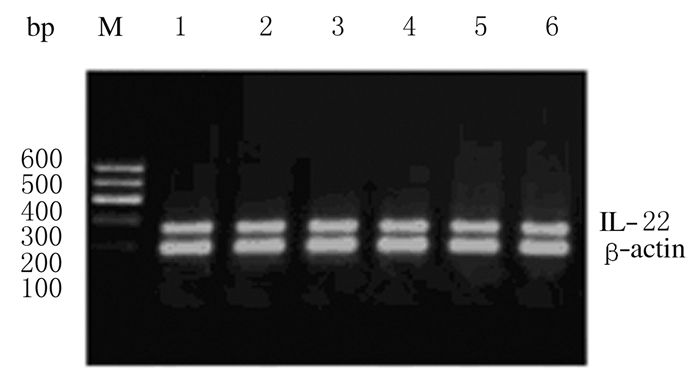
|
|
M:600 bp DNA marker;Lane 1:Moderate CHB group; Lane 2:Severe CHB group;Lane 3:Severe hepatitis group; Lane 4:Cirrhosis group;Lane 5:HCC group;Lane 6:Control group. 图1 各组研究对象PBMCs中IL-22mRNA表达电泳图 Fig.1 Electrophoregram of IL-22 mRNA expressions in PBMCs of subjects in various groups |
CHB重度组患者PBMCs中IL-22 mRNA表达水平与谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、凝血酶原活动度(prothrombin activity,PTA)和AFP水平无相关关系(P>0.05),而与TB水平呈负相关关系(r=-0.383,P=0.043);重型肝炎组患者PBMCs中IL-22 mRNA表达水平与GPT、AFP、PTA水平无相关关系,而与TB水平呈负相关关系(r=-0.619,P=0.028)。见表 2。
| Clinical data | GPT | TB | PTA | AFP | ||||
| r | 2 | r | P | r | P | r | P | |
| Control | 0.623 | 0.055 | -0.110 | 0.481 | 0.325 | 0.310 | - | - |
| Moderate CHB | 0.148 | 0.420 | -0.131 | 0.210 | 0.160 | 0.330 | 0.109 | 0.276 |
| Severe CHB | -0.057 | 0.808 | -0.383 | 0.043 | 0.220 | 0.190 | -0.129 | 0.288 |
| Severe hepatitis | 0.391 | 0.132 | -0.619 | 0.028 | 0.193 | 0.297 | -0.192 | 0.297 |
| Cirrhosis | 0.013 | 0.484 | -0.370 | 0.122 | 0.310 | 0.441 | -0.010 | 0.439 |
HCC组患者PBMCs中IL-22 mRNA的表达水平与血清GPT和TB水平无相关关系(r=-0.038,P=0.816;r=-0.012,P=0.942),但与血清AFP水平呈正相关关系(r=0.664,P=0.000)。
3 讨 论IL-22为IL-10家族成员,其受体由IL-22R1和IL-10R2两条链组成,受体结合特异性由IL-22R1决定。IL-22主要由淋巴系细胞分泌,外周血中50%的IL-22由Th22细胞分泌[1]。IL-22R1主要分布于肝、肺、皮肤和胸腺等组织,而以肝细胞中表达密度最高[5];T细胞、B细胞、NK细胞、单核/巨噬细胞和DC细胞均不表达IL-22R1[2]。以上这些特点决定了IL-22生物学效应的特殊性,即IL-22不作用于免疫细胞,效应细胞是以肝细胞为代表的组织细胞。大量的研究提示:IL-22对肝损伤有直接保护效应,且这种保护效应广泛地体现在病毒性肝炎[6, 7]、自身免疫性肝炎[5, 8, 9]、药物或中毒性肝炎[10, 11]、酒精性及非酒精性脂肪性肝炎[12, 13]和缺血再灌注肝损伤[14]等动物模型中。而PBMCs中IL-22表达水平变化与肝炎演化关系尚未见报道。
本研究结果显示:CHB(中度、重度)和肝硬化组患者PBMCs中IL-22 mRNA表达水平较健康对照组明显升高,提示这部分患者肝损害的同时存在一定程度的肝细胞再生;而重型肝炎组患者PBMCs中IL-22 mRNA表达水平明显低于CHB和肝硬化组,与健康对照组IL-22mRNA表达水平比较差异无统计学意义,提示重型肝炎组患者肝细胞再生状态明显低下,且预后不良。
本研究进一步分析了PBMCs中IL-22 mRNA表达水平与CHB和肝硬化组患者重要临床检测指标的相关性,发现CHB重度和重型肝炎组患者PBMCs中IL-22 mRNA表达水平与TB水平呈负相关关系,表明在这部分患者中IL-22 mRNA表达水平与TB一样能反映病情的严重程度,即IL-22 mRNA表达水平高者肝组织修复能力强,TB水平低,预后好,提示IL-22可能是CHB重症化过程中一个较好的评估指标。
本文作者在对HCC组患者研究中发现:尽管中晚期HCC患者PBMCs中IL-22 mRNA呈低水平表达,但其表达水平与AFP水平呈正相关关系,提示IL-22对肝癌细胞生长可能也有促进作用。这一结论与Jiang等[3]和Qin等[4]的研究结果一致,但以上研究者均未对所研究的HCC患者PBMCs中IL-22 mRNA表达水平与AFP血清水平进行相关性分析。
IL-22在CHB与HCC中的不同作用,或许与其激活的信号通路有关联。目前已明确IL-22结合受体后导致了肝细胞中STAT3信号分子活化,后者诱导了肝细胞中抗调亡蛋白(如BCL-2、BCL-XL、MCL1)和致有丝分裂蛋白(如Rb样蛋白2、Cyclin D1、p21、CDK4)的表达[2]。IL-22也能以STAT3依赖的方式促进肝干细胞向肝细胞和胆管上皮细胞分化[2]。在HCC微环境中,IL-22同样以STAT3依赖的方式促成了肝癌细胞的生长、凋亡抑制和癌细胞的转移[3]。因此,IL-22促进肝细胞再生与促进肝癌进展的效应可能是活化STAT3信号通路在肝细胞和肝癌细胞中不同的生物学效应的体现[15]。
综上所述,结合近期国内外对IL-22在动物实验性肝炎及HCC患者中观察到的不同研究结果,本文作者认为:IL-22在CHB和HCC中起不同作用,其生物学效应有两面性,而IL-22在CHB和乙肝肝硬化演变为HCC过程中的具体作用机制尚需深入研究。
| [1] | Dudakov JA,Hanash AM,van den Brink MR.Interleukin-22:immunobiology and pathology[J].Annu Rev Immunol,2015,33:747-785. |
| [2] | Sabat R,Ouyang W,Wolk K.Therapeutic opportunities of the IL-22-IL-22R1 system[J].Nat Rev Drug Discov,2014,13(1):21-38. |
| [3] | Jiang R,Tan Z,Deng L,et al.Interleukin-22 promotes human hepatocellular carcinoma by activation of STAT3 [J].Hepatology,2011,54(3):900-909. |
| [4] | Qin S,Ma S,Huang X,et al.Th22 cells are associated with hepatocellular carcinoma development and progression[J].Chin J Cancer Res,2014,26(2):135-141. |
| [5] | Zenewicz LA,Yancopoulos GD,Valenzuela DM,et al.interleukin-22 but not interleukin-17 provides protection to hepatocytes during acute liver inflammation[J].Immunity,2007,27(4):647-659. |
| [6] | Feng D,Kong X,Weng H,et al.Interleukin-22 promotes proliferation of liver stem/progenitor cells in mice and patients with chronic hepatitis B virus infection[J].Gastroenterology,2012,143(1):188-198. |
| [7] | Sertorio M,Hou X,Carmo RF,et al.IL-22 and IL-22 binding protein (IL-22BP) regulate fibrosis and cirrhosis in hepatitis C virus and schistosome infections[J].Hepatology,2015,61(4):1321-1331. |
| [8] | Radaeva S,Sun R,Pan HN,et al.Interleukin 22 (IL-22) plays a protective role in T cell-mediated murine hepatitis:IL-22 is a survival factor for hepatocytes via STAT3 activation[J].Hepatology,2004,39(5):1332-1342. |
| [9] | Brand S,Dambacher J,Beigel F,et al.IL-22-mediated liver cell regeneration is abrogated by SOCS-1/3 overexpression in vitro[J].Am J Physiol Gastrointest Liver Physiol,2007,292(4):G1019-G1028. |
| [10] | Feng D,Wang Y,Wang H,et al.Acute and chronic effects of IL-22 on acetaminophen-induced liver injury[J].J Immunol,2014,193(5):2512-2518. |
| [11] | Matsumoto A,Kanai T,Mikami Y,et al.IL-22-producing RORγt-dependent innate lymphoid cells play a novel protective role in murine acute hepatitis[J].PLoS One,2013,8(4):e62853. |
| [12] | Ki SH,Park O,Zheng M,et al.Interleukin-22 treatment ameliorates alcoholic liver injury in a murine model of chronic-binge ethanol feeding:role of signal transducer and activator of transcription 3[J].Hepatology,2010,52(4):1291-1300. |
| [13] | Rolla S,Alchera E,Imarisio C,et al.The balance between IL-17 and IL-22 produced by liver-infiltrating T-helper cells critically controls NASH development in mice[J].Clin Sci,2016,130(3):193-203. |
| [14] | Chestovich PJ,Uchida Y,Chang W,et al.Interleukin-22:implications for liver ischemia/reperfusion injury[J].Transplantation,2012,93(5):485-492. |
| [15] | Gao B,Wang H,Lafdil F,et al.STAT proteins - key regulators of anti-viral responses,inflammation,and tumorigenesis in the liver[J].J Hepatol,2012,57(2):430-441. |
 2016, Vol. 42
2016, Vol. 42


