扩展功能
文章信息
- 李清茹, 季顺东
- LI Qingru, JI Shundong
- 多肿瘤标志物蛋白芯片检测在老年人健康体检中的应用价值及其临床意义
- Application of multiple tumor marker protein chip in healthy screening of old people and its clinical significance
- 吉林大学学报(医学版), 2016, 42(03): 535-540
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 535-540
- 10.13481/j.1671-587X.20160322
-
文章历史
- 收稿日期: 2015-08-11
2. 苏州大学附属第一医院江苏省血液研究所 卫生部血栓与止血重点研究室, 江苏 苏州 215006;
3. 苏州大学血液学协同创新中心, 江苏 苏州 215006
2. Jiangsu Institute of Hematology, Key Laboratory of Thrombosis and Hemostasis, Ministry of Health, First Affiliated Hospital, Soochow University, Suzhou 215006, China;
3. Collaborative Innovation Center of Hematology, Soochow University, Suzhou 215006, China
随着人口增长和老龄化,恶性肿瘤已成为全球死亡的首要原因[1]。中国已于1999年开始进入老龄化社会,《中国健康老年人标准》定义60岁及以上为老年人,80岁及以上为高龄老人[2]。肿瘤标志物检测是肿瘤血清学诊断的主要方法之一。单项标志物检测在临床上已应用多年,但存在特异性不强、阳性率偏低,特别是对早期肿瘤的检出率低等不足[3]。多肿瘤标志物蛋白芯片(C12芯片)一次测量可获得甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖链抗原15-3(carbohydrate antigen 15-3,CA15-3)、糖链抗原19-9(CA19-9)、糖链抗原125(CA125)、糖链抗原242(CA242)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、铁蛋白(ferritin)、β-人绒毛膜促性腺激素(human chorionic gonadotropin beta,β-HCG)、人生长激素(human growth hormone,HGH)、前列腺特异性抗原(prostate special antigen,PSA)和游离PSA(free prostate special antigen,f-PSA)共12项肿瘤标志物的检测值[4, 5]。C12芯片具有高通量、微型化和自动化的特点,可增加肿瘤检测的敏感性和特异性,尤其是对无症状人群的早期肿瘤筛查具有重要的意义。近几年的同类研究 [6, 7, 8, 9]显示:C12芯片老年体检筛查多是笼统地针对60岁以上的老年人,对于80岁及以上的高龄老人未单独进行分析。本研究首次系统地分析了高龄老人C12芯片检测指标的阳性率和正常检测值,旨在探讨多肿瘤标志物蛋白芯片在老年人尤其是高龄老人健康体检中的应用价值。
1 资料与方法 1.1 一般资料选择2012年8月—2014年12月在苏州大学附属第一医院进行健康体检的健康体检者9654人,体检前均无肿瘤病史。高龄组(80岁及以上):男性602人,年龄80~99岁,平均年龄(83.5±3.4)岁;女性344人,年龄80~98岁,平均年龄(82.9±3.0)岁。老年组(60~79岁):男性2 312人,年龄60~79岁,平均年龄(69.7± 6.0)岁;女性1 707人,年龄60~79岁,平均年龄(68.3±5.6)岁。对照组(40~59岁):男性2 592人,年龄40~59岁,平均年龄(50.4±4.8)岁;女性2 099人,40~59岁,平均年龄(50.1±5.1)岁。早晨空腹采血2 mL,待检标本置于4℃冰箱保存并于1周内完成检测。
1.2 检测方法按照上海数康公司多种肿瘤标志物蛋白芯片检测系统的说明书[10],对收集的血清进行12种肿瘤标志物检测。将待测血清和不同浓度的标准品各100 μL分别滴加至不同的蛋白芯片分隔内,将芯片置于37℃水浴箱中温育30 min,倾去孔内液体,然后吸取200 μL洗涤液加入芯片格内,超声振荡洗涤8 min,再次弃去洗涤液,相同步骤重复洗涤4次,芯片小方格内各加入100 μL反应液再次置于37℃水浴箱中温育30 min,弃去液体后再次按以上步骤重复洗涤2次,剥离蛋白芯片集成块的上部,在每个芯片的膜表面加入20 μL等体积液静置2 min,采用生物芯片检测仪读取蛋白芯片数据,图像分析系统软件完成自动读取图像,分析各被测样本的结果,并打印数据报表。对出现阳性结果(超出正常范围)的体检者随访6个月以确定是否有肿瘤发生。正常参考值由上海数康公司蛋白芯片检测试剂盒提供[4]:AFP<20.00 μg·L-1;CA15-3<35.00 U·mL-1;CA19-9<35.00 U·mL-1;CA125<35.00 U·mL-1;CA242<20.00 U·mL-1;CEA <5.00 μg·L-1; Ferritin,男性<322.00 μg·L-1,女性<219.00 μg·L-1; NSE<13.00 μg·L-1; β-HCG<3.00 IU·L-1;HGH<7.50 μg·L-1;PSA<5.00 μg·L-1;fPBS<1.00 μg·L-1。为保持检测结果的一致性,将高龄组、老年组和对照组标本在每块芯片上随机分布(每块芯片上均有相同的标准品及质控品进行质量控制)。
1.3 统计学分析采用SPSS 19.0 统计软件进行数据分析。各组体检者肿瘤指标检测值以x±s表示。组间样本均数比较采用单因素方差分析。各组体检者肿瘤指标阳性率比较采用χ2检验。以α=0.05为检验水准。
2 结 果 2.1 各组体检者肿瘤标志物阳性率在体检者9 654人中共计665人检出肿瘤标志物阳性结果,阳性率为6.89%。各组体检者肿瘤标志物阳性率见表 1。对照组、老年组和高龄组体检者肿瘤标志物总阳性率分别为2.03%(95/4689)、8.66%(348/4019)和23.47%(222/946),χ2检验结果表明:总阳性率分布呈随年龄增长而升高的趋势(χ2=597.89,P<0.001)。CA19-9、CA242、CEA、NSE、PSA和f-PSA阳性率的分布呈随年龄增长而升高的趋势(P<0.01)。AFP阳性率分布变化趋势为随年龄增长先升高随后降低(P<0.05)。肿瘤标志物阳性体检者665人中32人经内窥镜、病理学和影像学检查确诊为早期或中期肿瘤,肿瘤检出率为0.33%;其余均为非肿瘤患者。确诊为肿瘤的32例患者中,前列腺癌11例、结肠癌9例、胆管癌4例、肾癌4例、卵巢癌2例和膀胱癌2例。对照组、老年组和高龄组研究对象肿瘤确诊率分别为0.09%(4/4689)、0.32%(13/4019)和1.58%(15/946),χ2检验结果表明:肿瘤确诊率分布呈随年龄增长而升高的趋势(χ2=53.65,P<0.001)。
| [n(η/%)] | |||||||
| Group | n | AFP | CA15-3 | CA19-9 | CA125 | CA242 | CEA |
| Control | 4 689 | 0.00(0) | 0.02(1) | 0.15(7) | 0.66(31) | 0.09(4) | 0.51(24) |
| Old people | 4 019 | 0.15(6) | 0.05(2) | 1.29(52) | 0.02(1) | 0.47(19) | 1.05(42) |
| Senile people | 946 | 0.11(1) | 0.00(0) | 3.07(29) | 0.95(9) | 0.95(9) | 2.85(27) |
| χ2 | 6.82 | 0.89 | 85.26 | 27.60 | 22.03 | 45.75 | |
| P | 0.033 | 0.886 | 0.00 | 0.147 | 0.001 | 0.00 | |
| Group | n | Ferritin | β-HCG | HGH | NSE | PSA | f-PSA |
| Control | 4 689 | 0.11(5) | 0.02(1) | 0.02(1) | 0.36(17) | 0.00(0) | 0.09(4) |
| Old people | 4 019 | 0.22(9) | 0.00(0) | 0.02(1) | 0.47(19) | 1.47(59) | 3.43(138) |
| Senile people | 946 | 0.11(1) | 0.00(0) | 0.00(0) | 1.37(13) | 3.70(35) | 10.36(98) |
| χ2 | 2.09 | 1.06 | 0.23 | 16.12 | 129.20 | 368.27 | |
| P | 0.476 | 0.352 | 0.809 | 0.001 | 0.00 | 0.00 | |
不同性别体检者肿瘤标志物阳性率比较差异有统计学意义(P<0.05或P<0.01),男性体检者肿瘤标志物阳性率前5位由高到低依次为f-PSA(4.36%)、PSA(1.71%)、 CEA(1.22%)、CA19-9(0.91%)和NSE(0.51%)。女性体检者肿瘤标志物阳性率前5位由高到低依次为CA19-9(0.92%)、CA125(0.82%)、 CEA(0.63%)、NSE(0.51%)和CA242(0.31%)。 检验结果表明:男性体检者CEA、PSA和f-PSA阳性率高于女性(P<0.01),CA125阳性率低于女性(P<0.01),AFP和Ferritin阳性率低于女性(P<0.05)。男女体检者肿瘤标志物总阳性率分别为9.32%(513/5506)和3.66%(152/4150),χ2检验结果表明:男性肿瘤标志物总阳性率高于女性(χ2=117.99,P<0.01)。
2.3 不同性别体检者肿瘤标志物阳性率在不同年龄段分布的趋势对照组、老年组和高龄组男性体检者肿瘤标志物总阳性率分别为1.74%(45/2592)、12.54%(290/2312)和29.57%(178/602),而女性体检者肿瘤标志物总阳性率分别为2.38%(50/2099)、3.40%(58/1707)和12.79%(44/344),χ2检验结果表明:男女体检者总阳性率的分布均呈随年龄增长而升高的趋势(χ2=496.99,χ2=91.33,P<0.01)。老年组和高龄组男性体检者肿瘤标志物阳性率均高于女性(χ2=103.85,χ2=34.31,P<0.01)。
对照组、老年组和高龄组男性体检者CA19-9、CA125、CEA、PSA和f-PSA阳性率的分布呈随年龄增长而升高的趋势(χ2=35.39,χ2=26.34,χ2=22.45,χ2=115.35,χ2=329.47,P<0.01);CA242肿瘤标志物阳性率分布的变化趋势为随年龄增长先升高后降低(χ2=10.38, P<0.01)。对照组、老年组及高龄组女性体检者CA19-9、CA242、CEA和NSE阳性率分布呈随年龄增长而升高的趋势(χ2=73.75,χ2=25.77,χ2=25.58,χ2=18.04,P<0.01);肿瘤标志物阳性率分布随年龄增长先升高后降低的肿瘤标志物有CA125(χ2=24.21,P<0.01)和AFP(χ2=6.15,P<0.05)。
选取肿瘤标志物阳性率分布随年龄变化差异有统计学意义的指标,将体检者按照10岁为1个年龄段,共分为6个年龄组,分别进行肿瘤标志物阳性率的统计。男性体检者CA19-9、CA125、CEA、PSA和f-PSA阳性率分布随年龄的增长而升高,见图 1。女性体检者AFP、CA19-9、CA242、CEA和NSE阳性率分布随年龄的增长而升高,CA125阳性率的变化趋势为60岁前随年龄的增长而降低,70岁后又随年龄的增长而升高。见图 2。
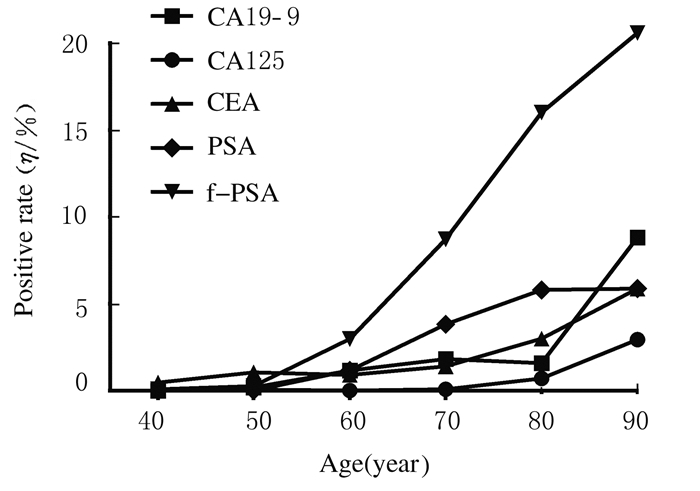
|
| 图1 男性体检者肿瘤标志物阳性率随年龄变化的分布图 Fig.1 Distribution diagram of positive rates of tumor markers with changes of ages in male subjects |
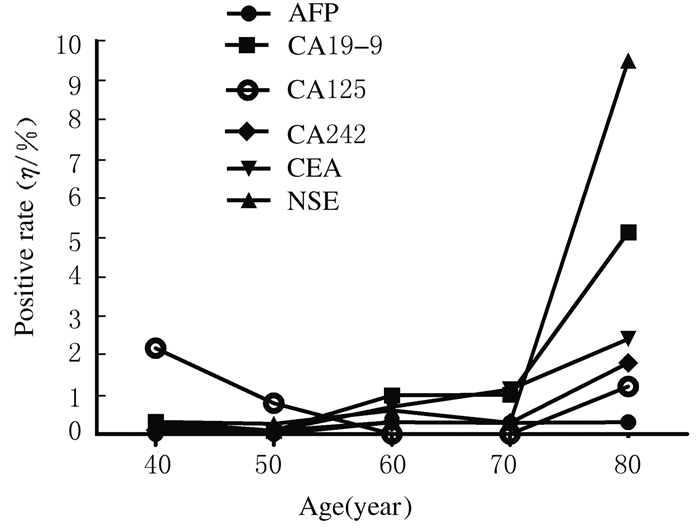
|
| 图2 女性体检者肿瘤标志物阳性率随年龄变化的分布图 Fig.2 Distribution diagram of positive rates of tumor markers with changes of ages in female subjects |
为比较高龄组体检者肿瘤标志物的正常检测值与老年组和对照组之间是否有差异,去除样本中的阳性结果后进行单因素方差分析。各年龄组体检者去除样本中的阳性结果后检测结果见表 2。各组体检者AFP、CA125、CA19-9、CA242、CEA、HGH、NSE和PSA均值随着年龄的增长而升高,高龄组体检者上述指标值高于老年组和对照组,老年组体检者上述指标值高于对照组,组间比较差异均有统计学意义(P<0.01)。
| (x±s) | |||||
| Group | n | AFP[ρB/(μg·L-1)] | CA125 [λB/(U·mL-1)] | CA15-3 [λB/(U·mL-1)] | CA19-9[λB/(U·mL-1)] |
| *P<0.01 vs control group;△P<0.01 vs old people group. | |||||
| Control | 4 689 | 1.19±0.96 | 7.53±3.97 | 5.53±3.50 | 7.30±4.67 |
| Oldpeople | 4 019 | 1.29±1.03* | 7.30±3.40* | 4.79±3.83* | 8.62±5.77* |
| Senile people | 946 | 1.46±1.41*△ | 7.98±4.13*△ | 5.09±4.11*△ | 10.25±6.65*△ |
| Group | n | CA242 [λB/(U·mL-1)] | CEA[λB/(U·mL-1)] | Ferritin[ρB/ (μg·L-1)] | β-HCG[ρB/ (μg·L-1)] |
| Control | 4 689 | 3.27±2.18 | 1.22±0.73 | 53.24±44.37 | 0.17±0.12 |
| Old people | 4 019 | 3.39±2.129* | 1.52±0.86* | 64.54±41.66* | 0.18±0.13* |
| Senile people | 946 | 3.61±2.55*△ | 1.71±0.91*△ | 65.92±44.54* | 0.19±0.14* |
| Group | n | HGH[λB/ (U·mL-1)] | NSE[ρB /(μg·L-1)] | f-PSA [ρB /(μg·L-1)] | PSA[ρB/(μg·L-1)] |
| Control | 4 689 | 0.29±0.61 | 2.80±1.17 | 0.13±0.14 | 0.35±0.34 |
| Old people | 4 019 | 0.33±0.49* | 3.05±1.29* | 0.18±0.21* | 0.61±0.77* |
| Senile people | 946 | 0.46±0.56* | 3.23±1.54*△ | 0.19±0.24* | 0.86±1.06*△ |
本研究结果显示:肿瘤标志物总阳性率为6.89%,低于严海燕等[6]报道的14.5%,高于匡红等[7]报道的2.88%以及陆汉魁等[8]报道的1.99%。本研究中高龄组体检者肿瘤标志物总阳性率为23.47%,明显高于老年组(8.66%)和对照组(2.03%)。
男性体检者单项肿瘤标志物阳性率从高到低排列的前5位依次为f-PSA>PSA>CEA>CA19-9>NSE,明显异于女性体检者。PSA 是由男性前列腺和尿道周围腺体柱状上皮细胞分泌的一种糖蛋白,并非前列腺癌的特异性抗体,作为一种血液标志物,血清PSA 水平对于前列腺癌的诊断有价值,但血清PSA水平升高并不能确诊为前列腺癌[11, 12, 13]。研究[12, 14]表明:良性前列腺增生症和前列腺癌患者血清PSA水平 参考值区间有很大重叠。前列腺增生已成为我国老年男性的常见病,前列腺增生的患病率随着年龄增长而升高,人口老龄化是前列腺增生患病率升高的主要原因。根据目前临床通用的PSA>10 μg·L-1且f-PSA/PSA < 0.14的鉴别前列腺癌与良性前列腺增生的标准[15, 16],本研究中的5 506名男性体检者中,有8名符合标准,但随访半年后共发现11例前列腺癌患者,说明对于PSA水平较该年龄段正常值范围高、但又未超过10 μg·L-1的高龄体检者需要加强前列腺癌的日常排查。
以往的研究[6, 7, 8, 9]报道未关注到高龄老年人C12检测肿瘤标志物的特性,一般将其合并入老年组一起分析。本研究首次系统地分析了高龄老年人C12检测指标的阳性率和正常检测值,结果发现高龄组和老年组无论是肿瘤标志物的阳性率还是正常检测值范围比较差异均有统计学意义。
与老年组比较,高龄组体检者肿瘤标志物阳性率分布基本符合随年龄增长而升高的趋势,但并不完全一致。例如,本研究发现女性体检者CA125阳性率在60岁前随着年龄的增长而降低,70岁后又随年龄的增长而升高。除去阳性结果后的检测结果表明:各年龄段组体检者AFP、CA125、CA19-9、CA242、CEA、HGH、NSE和PSA均值随着年龄的增长而升高,高龄组体检者上述指标高于老年组和对照组。本研究结果提示:应设置针对高龄老年人及老年人肿瘤标志物的正常检测范围,降低假阳性率,必要时可以考虑扩大样本量对C12芯片的临床应用进行深入研究。
综上所述,本研究分析了946名高龄体检者C12芯片检测结果,发现高龄组体检者C12芯片检测值基本符合随年龄增长而升高的一般趋势,但与老年组并不完全一致。C12芯片中CA19-9、CEA、NSE、PSA和f-PSA等肿瘤标志物在老年人尤其是高龄老年人的健康筛查中阳性率高,有助于肿瘤的早期发现。
[致谢:感谢皖南医学院贺连平老师在统计学方面给予的帮助和支持]
| [1] | Torre LA,Bray F, Siegel RL,et al. Global cancer statistics,2012[J].CA Cancer J Clin, 2015,65(2):87-108. |
| [2] | 刘险峰,唐 俊.中国高龄老人的社会保障问题初探[J].中国行政管理,2011,6(3):20-23. |
| [3] | Jimbo M, Rana GK, Hawley S,et al.What is lacking in current decision aids on cancer screening? [J].CA Cancer J Clin, 2013,63(3):193-214. |
| [4] | Balachandra K,Laisupasin P,Dhepakson P,et al.Preliminary clinical evaluation of a protein chip for tumor marker serodiagnosis of various cancers [J].Asian Pac J Allergy Immunol,2003,21(3):171-178. |
| [5] | Wingfield SA,Heflin MT.Cancer screening in older adults[J].Clin Geriatr Med, 2016,32(1):17-33. |
| [6] | 严海燕,钟日辉,李 竞,等.多肿瘤标志物蛋白芯片在老年人健康筛查中的应用[J].中华流行病学杂志,2011,32(9):924-926. |
| [7] | 匡 红,孙 晨,李 静,等.多肿瘤标志物蛋白芯片技术在人群健康体检中的应用[J].国际检验医学杂志,2013,34(9):1074-1076. |
| [8] | 陆汉魁,季 红,顾建英,等.多项肿瘤标志物生物芯片检测系统的初步临床应用[J].标记免疫分析与临床,2005,12(4):196-199. |
| [9] | 林尤斌.肿瘤标志物蛋白芯片应用于老年人健康筛查的评估分析[J].中国老年学杂志,2013,33(12):2931-2932. |
| [10] | 汪广杰,王 东,张 涛,等.血清多种肿瘤标志物联合检测对肺癌的诊断价值[J].重庆医学,2015,44(13):1759-1761. |
| [11] | Center MM,Jemal A, Lortet-Tieulent J, et al.International variation in prostate cancer incidence and mortality rates[J].Eur Urol,2012,61(6):1079-1092. |
| [12] | Tay KJ, Moul JW, Armstrong AJ.Management of prostate cancer in the elderly [J].Clin Geriatr Med,2016,32(1):113-132. |
| [13] | Pomerantz M.Active surveillance:pathologic and clinical variables associated with outcome[J].Surg Pathol Clin,2015,8(4):581-585. |
| [14] | 于普林,郑 宏,苏鸿学,等.中国六城市老年人前列腺增生的患病率及相关因素[J].中华流行病学杂志, 2000,21(4):36-39. |
| [15] | 邢金春.前列腺癌诊断治疗学[M].北京:人民卫生出版社,2011:65-67. |
| [16] | Kravchick S,Peled R,Dorfman D,et al.Predictive criteria for prostate cancer detection in men with serum PSA concentration of 2.0 to 4.0 ng /ml[J]. Urology,2005,66(3):542-546. |
 2016, Vol. 42
2016, Vol. 42


