扩展功能
文章信息
- 姜慧, 张桐菲, 杨鹤, 徐召南, 毕也, 孙抒, 张泽兵, 贾杰
- JIANG Hui, ZHANG Tongfei, YANG He, XU Zhaonan, BI Ye, SUN Shu, ZHANG Zebing, JIA Jie
- 人舌鳞状细胞癌顺铂耐药细胞株CAL-27/DDP的建立及其生物学评价
- Establishment of human tongue squamous cell carcinoma cisplatin resistant cell line CAL-27/DDPand its biological evaluation
- 吉林大学学报(医学版), 2016, 42(03): 506-511
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 506-511
- 10.13481/j.1671-587x.20160317
-
文章历史
- 收稿日期: 2015-12-26
2. 延边大学基础医学院病理学与法医学教研部, 吉林 延吉 133002;
3. 吉林大学中日联谊医院电诊科, 吉林 长春 130033
2. Department of Pathology and Forensic Medicine, College of Basic Medical Sciences, Yanbian University, Yanji 133002, China;
3. Department of Electrical Diagnosis, China-Japan Union Hospital, Jilin University, Changchun 130033, China
口腔癌是口腔颌面部最常见恶性肿瘤,占全身恶性肿瘤的1.5%~5.6%[1],口腔癌的总体治疗标准目前提倡以手术治疗为主的综合序列治疗[2],化疗是主要的辅助手段[3]。研究[4]表明:在我国,化疗方案中70%~80%以铂类为主。
顺铂是临床应用最为广泛的化疗药物之一,用以治疗各种癌症,如卵巢癌、睾丸癌和食管癌[5, 6]等。但是在治疗过程中患者往往对顺铂产生耐药性,通常表现为对多种在结构和功能上不同的细胞毒性的抗性,即多药耐药(multi-drug resistance,MDR),最终导致化疗失败。目前,多药耐药的机制尚不明确,已知耐药细胞株是研究肿瘤多药耐药机制的重要模型,目前国内外针对化疗耐药建立了多种耐药细胞株模型,但关于口腔癌细胞株CAL-27模型的建立国内外尚未见报道。因此,建立顺铂耐药细胞株模型,对于研究肿瘤MDR机制具有重要意义。本研究利用顺铂浓度梯度法体外诱导建立人口腔癌CAL-27/DDP顺铂耐药细胞株,并探讨其生物学和耐药特性。
1 材料与方法 1.1 细胞株、主要试剂和仪器人舌鳞状细胞癌(舌鳞癌)CAL-27细胞株由上海交通大学附属口腔医学院陈万涛教授惠赠。H-DMEM培养基粉剂、RPMI-1640培养基粉和胎牛血清(美国Gibco公司),青霉素-链霉素(奥地利PAA公司),二甲基亚砜(DMSO,美国Sigma公司),噻唑蓝(MTT)和FITC标记的山羊抗兔二抗(北京中杉金桥公司),AnnexinⅤ-FITC/PI试剂盒(凯基生物有限公司)。CO2恒温细胞培养箱MCO-20AIC(日本SANYO公司),倒置显微镜TH4-100和流式细胞仪(日本Olympus公司),水平电泳仪DYY-7C(北京六一仪器厂),超纯水器Milli-Q(美国Millipore公司),电子天平FA1004D(上海越平科学仪器有限公司),酶标仪ELX800(美国BioTek公司)。PCR System 9700(美国GENE公司),微量核酸蛋白检测仪NanoDropND-2000(美国NanoDrop公司),凝胶成像系统(美国Bio-Rad公司)。
1.2 细胞株培养采用H-DMEM细胞培养液培养舌鳞癌CAL-27细胞株(含 10%胎牛血清、 100U·mL-1青霉素和100mg·L-1 链霉素),置于 37℃、5%CO2孵箱中培养。每 2 d换液1次,待细胞株生长至对数生长期时使用。
1.3 耐药细胞的建立顺铂浓度的确定:采用以低浓度(0.1 mg·L-1 )为起始剂量、逐步递增顺铂浓度的方法,诱导细胞耐药。顺铂浓度按照梯度差设置为3段,第一段梯度差:0.1mg·L-1(即0.1、0.2、0.3....1.0 mg·L-1);第二段梯度差:1mg·L-1(即2、3、4....10 mg·L-1);第三段梯度差:10mg·L-1(即20、30、40和50 mg·L-1)。
耐药细胞的诱导:取对数生长期的CAL-27细胞株,待增长至70%左右进行如下操作,①加入含有顺铂(浓度为0.1 mg·L-1)的培养液,作用24 h;②弃去含药的培养液,加入新鲜的培养液,继续培养;③待其恢复正常生长,消化传代;④用含有顺铂(浓度0.2 mg·L-1)的培养液处理24 h。如此反复②和③步骤,并逐步提高顺铂浓度,直至细胞不能耐受为止。持续诱导细胞最终获得1株能耐受1 mg·L-1顺铂的稳定耐药细胞株,命名为CAL-27/DDP。该细胞株可用不含顺铂的培养液培养,但每月用含有1 mg·L-1顺铂的培养液作用24 h,以维持其耐药性。实验前先用不含顺铂的培养液培养至少3 d。
1.4 细胞株形态表现观察将CAL-27细胞株和CAL-27/DDP细胞株在普通培养液中进行培养至少3 d,采用倒置显微镜动态观察CAL-27和CAL-27/DDP细胞株的生长情况并照相。
1.5 细胞株生长曲线和倍增时间的测定将CAL-27细胞株和CAL-27/DDP细胞株在普通培养液中培养至少3 d,调整细胞浓度至1× 104L-1,以每孔1 mL接种至24孔板,每日计数3孔取平均值,连续观察7 d,绘制细胞株生长曲线,根据细胞株倍增时间公式计算细胞株倍增时间Td。Td(h)=T×lg2/(lgNt-lgN0),其中T为培养时间,N0、Nt分别为接种后及培养T时间后的细胞数。
1.6 MTT法检测CAL-27/DDP细胞株的耐药指数(resistanceindex,RI)将CAL-27细胞株和CAL-27/DDP细胞株在普通培养液中培养至少3 d,收集对数生长期的CAL-27和CAL-27/DDP细胞株,调整细胞密度为1×105 mL-1,接种于96孔细胞培养板,每孔加入0.1 mL细胞悬液,培养24 h后加入设定浓度的顺铂溶液200 μL,同时设空白对照组。设定顺铂的浓度梯度为0、0.01、0.1、1、10和100 mg·L-1,每一药物浓度设 9个复孔,置于 37℃、5%CO2孵箱中培养12、24、48和72 h后,每孔加入MTT液(5 g·L-1)20μL,继续培养4 h弃去孔内液体,加入150μL DMSO 振荡10 min,于酶标仪490 nm 波长处测定各孔吸光度(A)值,计算出CAL-27和CAL-27/DDP半数有效抑制浓度(IC50),根据公式算出CAL-27/DDP耐药细胞株的RI。RI=CAL-27/DDP细胞株的IC50/CAL-27细胞株的IC50。
1.7 流式细胞术检测CAL-27和CAL-27/DDP细胞株的细胞周期将CAL-27细胞株和CAL-27/DDP细胞株在普通培养液中培养至少3 d,取对数生长期细胞,吸弃培养液,加入750μL胰酶进行消化,制备单细胞悬液,1 000 r·min-1 离心5 min沉淀细胞后,用1mL预冷的PBS重悬。再一次1 000 r·min-1 离心5 min沉淀细胞。用1 mL预冷的70%乙醇轻轻混匀,4℃过夜。接下来1 000 r·min-1 离心5 min沉淀细胞后,用1 mL预冷的PBS重悬。然后再次1 000 r·min-1离心5 min沉淀细胞。配置碘化丙啶染色液,每个细胞样品加入0.5 mL配置的碘化丙啶染色液,轻轻混匀重悬细胞。37℃避光温浴30 min后,采用流式细胞仪检测,以激发波长488 nm检测2组细胞株的细胞周期。
1.8 RT-PCR法检测CAL-27和CAL-27/DDP细胞株中MDR1mRNA的相对表达水平在对数期收集2组细胞,分别提取总RNA,釆用紫外分光光度仪测定总RNA含量,进行cDNA合成和扩增。以GAPDH作为内参,引物序列如下:上游,5′-AGGTCGGAGTCAACGGATTTGGTCG-3′,下游,5′-TGGCCAGGGGTGCTAAGCAGT-3′,扩增片段长度为477 bp。MDR1引物序列如下:上游,5′-GCAATGGAGGAGCAAAGAAG-3′,下游,5′-AATGTAAGCAGCAACCAGCAC-3′,扩增片段长度为374 bp。经凝胶成像分析系统扫描成像,釆用 Bio-Rad 成像分析软件 Quantity One 分析结果。
1.9 Western blotting法测定CAL-27和CAL-27/DDP细胞株中P糖蛋白(P-glycoprotein,P-gp)相对表达水平收集CAL-27和CAL-27/DDP细胞株,提取2组细胞株中的总蛋白;釆用PAGE-SDS电泳分离蛋白,利用电转移将蛋白转移到PVDF膜上;配制含有1 g脱脂奶粉和20 mL TBST的封闭液,将膜取出,做好标记,用去离子水冲洗1次,将膜放入封号的袋中,加上封闭液,挤出气泡,封好,37℃水平摇床1 h;封闭一抗1∶500,4℃过夜;用TBST洗膜3次,水平摇床,每次10 min;封闭二抗 1∶1 000,37℃摇1h;用1×PBS洗膜3次,水平摇床,每次10 min;取A、B液各1 mL混匀,冲洗膜,将膜放入仪器中,进行显色。经凝胶成像分析系统扫描成像,釆用Bio-Rad 凝胶成像分析软件分析结果。细胞株中P-gp相对表达水平=P-gp条带灰度值/β-actin条带灰度值。实验重复3次,取平均值。
1.10 统计学分析采用SPSS17.0统计软件进行统计学分析。2组细胞株倍增时间、IC50、RI、MDR1 mRNA的相对表达水平和P-gp的相对表达水平以 ± s
表示,组间比较釆用t检验。以α=0.01为检验水准。
± s
表示,组间比较釆用t检验。以α=0.01为检验水准。
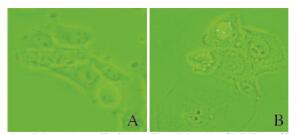
人口腔癌顺铂耐药细胞株CAL-27/DDP在1个月之内,可在不含顺铂的普通培养液中仍维持其形态和耐药性状,将2种细胞在普通培养液中进行培养至少3 d,观察2种细胞株的细胞形态:正常人口腔鳞癌CAL-27细胞株形态较规则,常呈“铺路石”样生长(图 1A,见插页三)。与CAL-27细胞株比较,CAL-27/DDP细胞株体积略大,核仁也增大,胞浆丰富,多呈“空泡”性变,多角型生长(图 1B,见插页三)。
|
| 图 1 倒置显微镜下2组细胞株的形态学表现(×40) Fig.1 Morphology of cell lines in two groups under inverted microspcope(×40) A:CAL-27 cell line;B:cal-27/DDP cell line. |
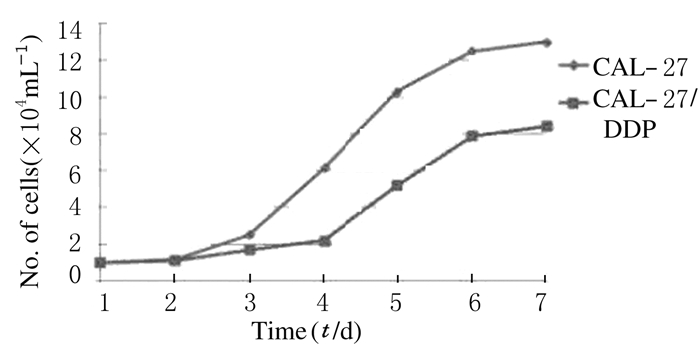
根据连续7 d计数细胞绘制的细胞生长曲线,计算细胞倍增时间,CAL-27细胞株倍增时间为(45.12±0.32)h,而CAL-27/DDP细胞株倍增时间为(54.43±1.04)h;与CAL-27细胞株比较,CAL-27/DDP细胞株倍增时间明显延长(P < 0.01),增殖缓慢。见图 2。
|
| 图 2 CAL-27和CAL-27/DDP细胞株生长曲线 Fig.2 Growth curves of CAL-27 and CAL-27/DDP cell lines |
采用MTT法测定顺铂对2种细胞株的杀伤性,并测定CAL-27/DDP的RI。CAL-27细胞株的IC 50为(5.00±0.11)mg·L-1,CAL-27/DDP细胞株的IC50 为(90.46±0.60)mg ·L-1(P < 0.01),CAL-27/DDP细胞株的RI为18.09±0.30。
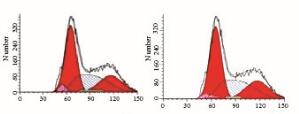
2.4 流式细胞术检测CAL-27和CAL-27/DDP细胞株的细胞周期分布与CAL-27组比较,CAL-27/DDP组G1期和G2期细胞比例降低,S期细胞比例升高,DNA复制期明显延长,细胞对数生长期的增殖速度减慢。见图 3(插页三)。
|
| 图 3 2组细胞株的细胞周期分布图 Fig.3 Diagram of cell cycles of cell lines in two groups A:CAL-27 cell line;B:cal-27/DDP cell line. |
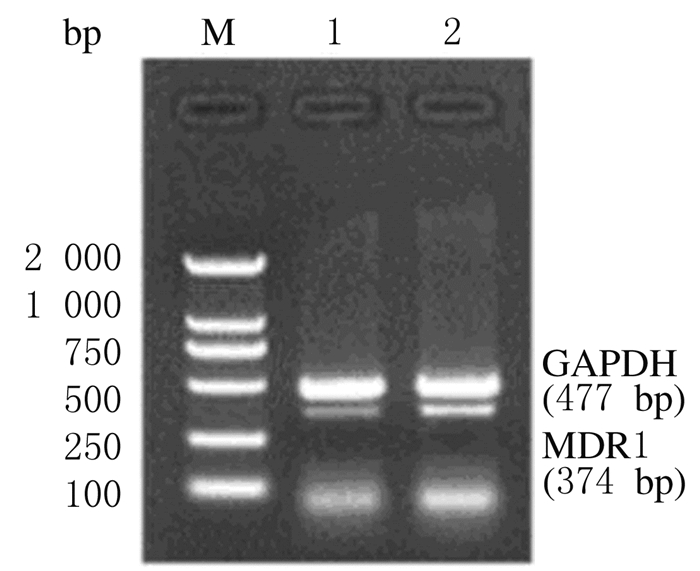
CAL-27细胞株中MDR1mRNA相对表达水平为0.30±0.01,CAL-27/DDP细胞株中MDR1mRNA相对表达水平为0.50±0.02,高于CAL-27细胞株(P < 0.01)。见图 4。
|
| 图 4 CAL-27和CAL-27/DDP细胞株中MDR1 mRNA表达电泳图 Fig.4 Electrophoregram of expressions of MDR1 mRNA in CAL-27 and CAL-27/DDP cell lines M:DL 2000 DNA marker;Lane 1:CAL-27 cell line;Lane 2:CAL-27/DDP cell line. |
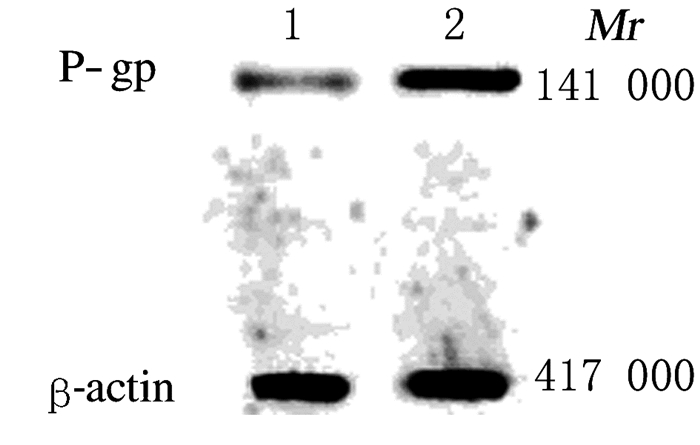
CAL-27细胞株中P-gp相对表达水平为0.31±0.03;CAL-27/DDP细胞株中P-gp相对表达水平为0.96±0.02,明显高于CAL-27细胞株 (P < 0.01)。见图 5。
|
| 图 5 CAL-27和CAL-27/DDP细胞株中P-gp表达电泳图 Fig.5 Electrophoregram of expressions of P-gp in CAL-27 and CAL-27/DDP cell lines Lane 1:CAL-27 cellline; Lane 2:CAL-27/DDP cell line |
顺铂是一种广谱、高效的抗癌药物,临床被广泛用于口腔癌的治疗,并认为是治疗口腔癌的有效药物之一。但随着临床研究的不断深入,越来越多的研究[7, 8]结果显示:以顺铂为主的化疗方案对相当一部分口腔癌患者的总体生存率无明显改善,其中口腔癌细胞对DDP的耐药是导致化疗失败的最直接和最重要的原因。因此,体外建立口腔癌耐药模型,对后续研究口腔癌的耐药机制及逆转耐药有重要意义。
肿瘤耐药细胞系的建立方法有大剂量冲击法、浓度梯度递增法和基因转染法[9, 10, 11, 12]。 大剂量冲击法获得的耐药模型与临床用药方式相似,但大剂量冲击法处理细胞得到的耐药模型耐药性并不稳定;而低剂量药物连续作用的方法保证了顺铂的化疗作用持续进行数周甚至数月,耐药性比大剂量冲击法稳定,且耐药倍数明显升高[13]。基因转染法是将MDR1基因转染入肿瘤细胞株,使其表达,由此获得耐药细胞株,但转染过程中常因新基因的介入而导致细胞稳定性发生变化[14],且其形成机制与临床治疗过程中形成的化疗药物耐药性机制相差甚远,故不常用。所以目前国内外多采用低浓度持续诱导的方法建立稳定的耐药细胞模型。
建立模型的评价方法主要有RI的检测和耐药相关蛋白的检测。常用作检测指标的耐药相关蛋白主要有P-gp和MDR1[15]。MDR1的耐药机制极其复杂,其中,MDR1编码的P-gp表达是耐药的主要机制[16, 17, 18]。
本研究结果显示:CAL-27细胞株在顺铂浓度差(0.1 mg·L-1)较小时,随着浓度的增加,细胞死亡数量有所增加,少数细胞由小变大,但总体仍呈“铺路石”状。细胞中出现颗粒状物质,细胞突起和颗粒物质增多,可能是耐药细胞表面积增加以排除细胞内的化疗药物的一种“自我保护”,细胞生长速度和倍增时间均比在普通培养液中培养的CAL-27细胞株延长;而顺铂浓度差(1 mg·L-1)增大时,细胞死亡数量明显增加,形态学变化较明显,多数细胞呈现“多角”型,出现较多细胞核浓缩、细胞质饱满的“空泡”样细胞,细胞长到对数期的时间明显延长,CAL-27细胞株需要2 d传代,而加药细胞需要长到5 d左右传代;当顺铂浓度差(10 mg·L-1)增加到更大时,细胞大量死亡,只剩少数细胞存活,其形态学也发生了明显变化,细胞全部呈“多角”型生长,且“空泡”样细胞增多,但是死亡细胞数量也随之增多,可见随着顺铂浓度的增加,细胞凋亡率升高。CAL-27细胞与顺铂长期接触,逐渐耐受了顺铂,可以在含1.0 mg·L-1顺铂的培养液中稳定生长并可传代,经过12个月的诱导,培养出耐顺铂的CAL-27/DDP细胞株,与CAL-27细胞株比较,其细胞株倍增时间由(45.12±0.32) h增加到(54.43±1.04) h,细胞周期明显被阻滞在DNA复制期 ,RI增加到(18.09±0.30)倍,且MDR1 mRNA相对表达水平明显升高,由MDR1编码的P-gp相对表达水平也明显升高。
本实验中顺柏的起始浓度为0.1 mg·L-1,并设置了3段顺铂浓度梯度差进行多次筛选,这是成功诱导出耐药细胞株的关键所在。CAL-27/DDP耐药细胞株的建立为探讨化疗耐药机制、指导临床合理用药、及时有效地逆转耐药提供了良好的体外模型,具有实际意义。
| [1] | Wamakulasuriya S.Global epidemiology of oral and oropharyngeal cancer[J].Oral Oncol,2009,45(4/5):309-316. |
| [2] | 邱嘉旋,魏军水,朱声荣,等.Ki-67、EGFR、P53及RARβ 在口腔鳞癌化疗前后的变化及临床意义评价[J].口腔医学研究,2011,27(2):127-131. |
| [3] | Vikulova IV.The state-of-the-art of the diagnosis of oral and oropharyngeal cancer[J]. Vestn Rentgenol Radiol,2012(3):51-54. |
| [4] | 张建忠,柯 樱,沈佳琳.铂类抗肿瘤药物的研发进展及市场情况[J].上海医药,2013,34(23):52-59. |
| [5] | Tong X,Dong S,Yu M,et al.Role of heteromeric gap junctions inthe cytotoxicity of cisplatin[J].Toxicology, 2013,310:53-60. |
| [6] | Mendoza J, Martinez J, Hernandez C, et al. Association between ERCC1 and XPA expression and polymorphisms and the response to cisplatin in testicular germ cell tumours[J].Br J Cancer,2013,109(1):68-75. |
| [7] | Li X,Ling V,Li PC.Same -single -cell analysis for the study of drug efflux modulation of multidrug resistant cells using a microfluidic chip[J].Anal Chem,2008,80(11):4095-4102. |
| [8] | Sakaeda T, Kadoyama K, Okuno Y. Adverse event profiles of Platinum agents: data mining of the public version of the FDA adverse event reporting system, AERS, and reproducibility of clinical observations[J].Int J Med Sci,2011,8(6):487-491. |
| [9] | 肖 扬,王万春.姜黄素对人骨肉瘤细胞株/阿霉素多药耐药逆转作用的实验研究[J].卫生研究,2011,40(1):103-106. |
| [10] | Goldstein L.Clinical reversal of drug resistance[J].Curr Prob Cancer,1995,19(2):18-21,70-80,83-106,109-123. |
| [11] | Jang SH, Wientjes MG, Au JL. Kinetics of P-glycoprotein-mediated efflux of paclitaxel.[J]. J Pharmacol Exp Ther,2001,298(3):1236-1242. |
| [12] | 延 冰,刘国勤,姜永胜,等.高剂量法诱导胃癌铂类耐药细胞株的建立及其生物学特性[J].山东大学学报:医学版,2014,52(4):49-52,57. |
| [13] | 黄在菊,杨守华,李 敏,等.不同方法建立卵巢癌紫杉醇耐药细胞株对临床用药方案的启发[J].中国药师,2008,10(11):1135-1137. |
| [14] | Findling-Kagan S,Sivan H,Ostrovsky O,et al.Establishment and characterization of new cellular lymphoma model expressing transgenic human MDR1 [J]. Leuk Res,2005,29(4):407-414. |
| [15] | 张 峰,岑 娟.肿瘤多药耐药模型的建立与评价方法[J].药物评价研究, 2013,36(5):377-381. |
| [16] | 张浩轩,孙小锦,孙一鸣,等.氯喹逆转人鼻咽癌细胞HNE1/DDP的耐药作用[J].南方医科大学学报,2015,35(5):687-691. |
| [17] | 周丽佳,杨 洲,张士博,等.载顺铂聚乳酸静电纺丝膜对口腔鳞癌细胞的杀伤作用研究[J].中国实验诊断学,2014,18(2):179-182. |
| [18] | 徐亚娟,孙 旭,李烁烯,等.CKS1 siRNA对人舌癌Tca 8113细胞中CKS1蛋白的抑制作用[J].中国老年学杂志,2015,35(3):743-745. |
 2016, Vol. 42
2016, Vol. 42


