扩展功能
文章信息
- 薛欢, 曲圆, 朱天全, 胡杨, 孙申国, 阎鑫, 纪影实, 包雪鹦
- XUE Huan, QU Yuan, ZHU Tianquan, HU Yang, SUN Shenguo, YAN Xin, JI Yingshi, BAO Xueying
- 清脑止痛胶囊对硝酸甘油致偏头痛大鼠体内炎性细胞因子表达水平的影响及其意义
- Effect of QNZTJN on expression levels of inflammatory cytokines in migraine rats induced by nitroglycerin and its significance
- 吉林大学学报(医学版), 2016, 42(03): 496-501
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 496-501
- 10.13481/j.1671-587x.20160315
-
文章历史
- 收稿日期: 2015-10-18
2. 吉林大学第二医院骨科, 吉林 长春 130041;
3. 吉林敖东洮南药业股份有限公司, 吉林 白城 137100;
4. 中国人民解放军第208医院神经内科, 吉林 长春 130062
2. Department of Orthopedics, Second Hospital, Jilin University, Changchun 130041, China;
3. Jilin AoDong Medicine Industry Group Co., Ltd., Baicheng 137100, China;
4. Department of Neurology, No.208 Hospital of PLA, Changchun 130062, China
偏头痛是一种以一侧或双侧反复发作头痛为特征的原发性中枢神经系统功能紊乱性疾病,其发病机制复杂,目前仍未阐明,且治疗偏头痛的药物疗效仍不理想[1]。西药主要镇静止痛,但其副作用明显,因此寻求中药辩证治疗具有重要意义,已有研究[1]表明清脑止痛胶囊的主要成分天麻和川芎对治疗偏头痛有较好疗效。研究[2]显示:脑膜血管扩张和炎症反应是偏头痛发病机制的关键环节,与核因子kappa B(nuclear factor kappa B,NF-кB)、环氧合酶2(cyclooxygenase 2,COX-2)、前列环素E2(prostaglandin E2,PGE2)、白细胞介素1β(interleukin-1 beta,IL-1β)和肿瘤坏死因子α(TNF-α)等炎症因子有密切关系。本研究采用硝酸甘油(NTG)制备偏头痛大鼠模型,观察清脑止痛胶囊对偏头痛大鼠体内炎症因子表达的影响,探讨其可能的作用机制,为其临床应用提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级成年雄性Wistar大鼠90只,体质量180~220g,购于吉林大学实验动物中心,动物合格证号:SCXK(吉)-2007-0003。清脑止痛胶囊由吉林敖东洮南药业股份有限公司生产,批号: Z20080035;正天丸由华润三九医药股份有限公司生产;NTG注射液由河南润弘制药股份有限公司生产;大鼠PGE2酶联免疫检测试剂盒、大鼠SP酶联免疫检测试剂盒、大鼠TNF- a酶联免疫检测试剂盒和大鼠IL-1β酶联免疫检测试剂盒购于上海安迪生物科技有限公司;兔抗大鼠NF-кB单克隆抗体和兔抗大鼠COX-2单克隆抗体购于上海艾博抗贸易有限公司;兔抗大鼠COX-2单克隆抗体购于美国Santa Cruz公司;UltraSensitiveTM S-P超敏试剂盒(鼠)、DAB显色试剂盒为福州市迈新生物技术开发有限公司产品;BCA蛋白浓度测定试剂盒为上海碧云天生物技术公司产品。微孔板分光光度计(EPOCH,日本Sanyo公司),立式超低温保存箱(DW-86L386,日本三洋公司),分析天平(ESJ60-4,美国METTLER TOLEDO公司),斡旋器(QL901,美国其林贝尔仪器制造有限公司),台式离心机(TD4A-WS,美国Thermo公司),生物显微镜(CX21FS1C,日本OLympus公司)和自动凝胶成像分析系统(Taton-4200,美国Tanon公司)等。
1.2 动物分组和模型制备90只雄性Wistar大鼠随机分为空白组,模型组,低、中、高剂量清脑止痛胶囊组和阳性药组,每组15只。低、中和高剂量清脑止痛胶囊组大鼠的给药剂量分别为0.35 g·kg-1、0.70 g·kg-1、1.40 g·kg-1,阳性药组大鼠给予1.8 g·kg-1正天丸,同时空白组和模型组大鼠给予等量的蒸馏水,均灌胃给药7 d。依据文献[3, 4],末次给药60 min后,于右肩皮下注射NTG 注射液10 mg·kg-1,制备偏头痛模型;空白组大鼠给予生理盐水。观察造模后大鼠180 min内的挠头次数。造模4 h后,10%水合氯醛腹腔内注射麻醉,取血,3 500 r·min-1离心15 min,分离血浆;每组取10只大鼠分离脑干,制备脑组织匀浆液,4 ℃离心15 min(3500 r·min-1),吸取上清保存于-80 ℃冰箱中,其余5只大鼠取中脑固定于10%的甲醛溶液中待用。
1.3 免疫组织化学法检测大鼠中脑组织中NF-кB 和COX-2表达水平将固定于甲醛溶液中的大鼠脑干常规脱水、石蜡包埋并切片。将切片进行如下处理:二甲苯脱蜡、梯度酒精复水、枸橼酸缓冲液抗原修复,按UltraSensitiveTM S-P超敏试剂盒(鼠)说明书进行免疫组织化学染色。一抗兔抗大鼠COX-2和NF-кB抗体工作浓度均为1∶100,于4℃孵育过夜后,PBS洗5 min×3次,滴加二抗,在37℃条件下孵育30 min,PBS洗5 min×3次,DAB显色,苏木素复染,盐酸酒精分化,梯度酒精脱水,二甲苯透明,中性树胶封片。光镜400倍视野下观察,在每一张切片的中脑导水管周围随机取5个点,采用 Image Pro Plus 6.0 图像分析系统对切片阳性区域表达部分测定平均吸光度(A)值。
1.4 Western blotting法检测大鼠中脑组织中NF-кB 和COX-2表达水平提取大鼠脑干组织蛋白,用BCA蛋白浓度测定试剂盒测定样品蛋白含量,将样本稀释、上样,采用10% SDS-PAGE进行电泳;将凝胶上的蛋白转移到PVDF膜上,采用5%脱脂奶粉封闭液于室温下封闭2 h后洗膜,分别加兔抗大鼠NF-кB抗体(1∶1 000)、NF-кB抗体(1∶1 000)和GAPDH抗体(1∶5 000),4℃冰箱过夜孵育,洗膜;加羊抗兔二抗(1∶5 000),室温孵育2 h,洗膜;采用ECL化学发光法显色,采用Quantity One软件对结果进行处理分析。
1.5 酶联免疫法检测大鼠血浆和中脑组织中PGE2、IL-1β和TNF-a的水平将在-80℃冰箱中保存的大鼠脑组织和血浆取出,室温下冻融。按照试剂盒说明书进行操作。按说明配置不同浓度梯度的标准品,在酶包被板中加入工作液及相应的标准品或样品,37℃孵育1h。洗涤5次,加入HRP结合的抗生物素蛋白工作液,37℃孵育30min,洗涤5次,加入终止液,在450nm处读取A值。根据标准品的浓度及对应的A值计算出标准曲线的直线回归方程,再根据样品的A值在回归方程上计算出对应的样品浓度。
1.6 统计学分析采用GraphPad Prism5.0软件进行统计学分析。各组大鼠挠头次数,大鼠血浆中PGE2、IL-1β、TNF- α水平,中脑组织中NF-кB和COX-2表达水平均以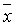 ± s表示,组间比较采用t检验。以α=0.05为检验水准。
± s表示,组间比较采用t检验。以α=0.05为检验水准。
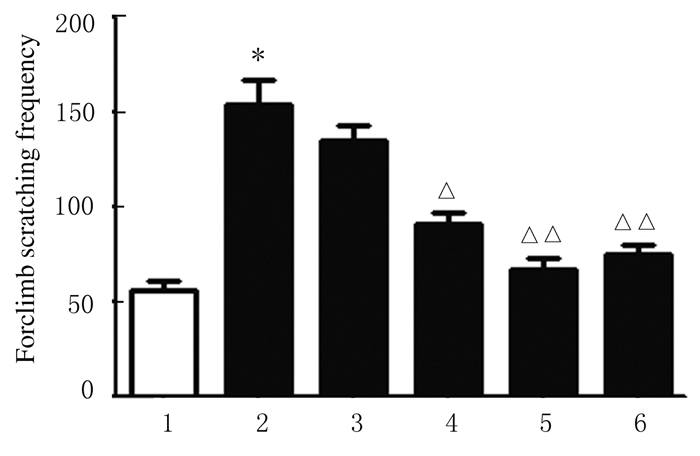
在给予NTG后的180min内,空白组大鼠挠头次数为(55.9±5.1)次;模型组大鼠挠头次数为(153.5±13.4)次,较空白组明显增加(P < 0.01);低、中和高剂量清脑止痛胶囊组大鼠挠头次数分别为(134.5±12.8)、(91.1±6.9)和(67.0± 7.4)次,挠头次数随给药剂量的 增加而降低,且中和高剂量清脑止痛胶囊组大鼠挠头次数明显低于模型组(P<0.05或P < 0.01)。见图 1。
|
| 图 1 各组大鼠挠头次数及比较结果 Fig.1 Forelimb scratching frequencies of rats and comparison results in various groups 1:Control group;2:Model group;3-5:Low,middle,and high doses of QNZTJN groups;6:Positive drug control group. * P<0.01 compared with control group;△P<0.05, △△P<0.01 compared with model group. |
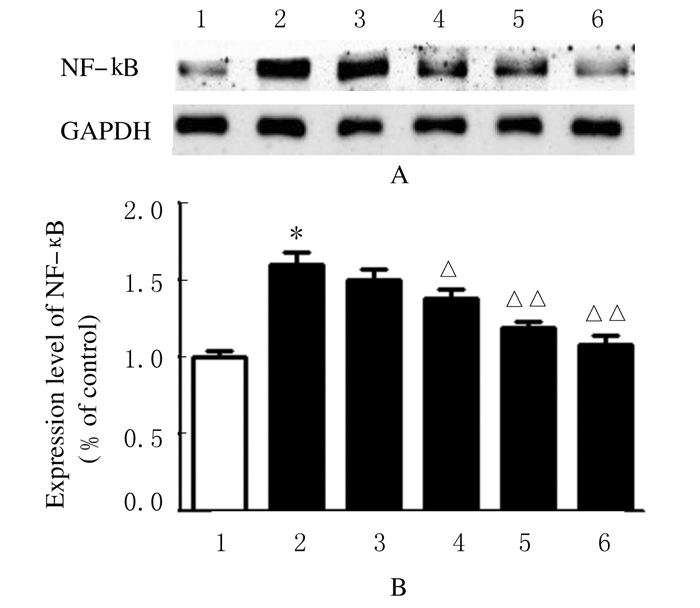
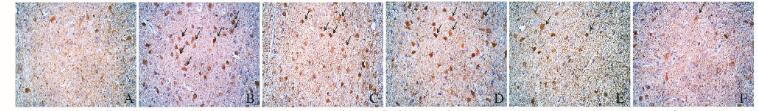
免疫组织化学检测结果:与空白组(100%)比较,模型组大鼠中脑导水管周围灰质区NF-кB阳性细胞表达水平(140%)明显升高(P < 0.01);与模型组比较,低、中和高剂量清脑止痛胶囊组及阳性药组大鼠中脑导水管周围灰质区NF-кB阳性细胞表达降低,分别为132%、120%、105%和108%,且中、高剂量清脑止痛胶囊组和阳性药组与模型组比较差异有统计学意义(P < 0.05或P < 0.01),见图 2(插页二)。Western blotting检测结果:与空白组(100%)比较,模型组大鼠中脑组织中NF-кB表达水平(160%)明显升高(P < 0.01);与模型组比较,低、中和高剂量清脑止痛胶囊组及阳性药组大鼠中脑组织中NF-кB表达水平(150%、138%、119%和108%)降低,且中、高剂量清脑止痛胶囊组和阳性药组与模型组比较差异有统计学意义(P < 0.05或P < 0.01),见图 3。

|
| 图 2 各组大鼠中脑组织中NF-кB表达水平(免疫组织化学,×400) Fig.2 Expression levels of NF-кB in midbran tissue of rats in various groups(Immunohistochemistry,×400 A:Control group; B: Model group;C-E:Low,middle,and high doses of QNZTJN groups;F: Positive drug control group. |
|
| 图 3 Western blotting法检测各组大鼠中脑组织中NF-κB表达水平 Fig.3 Expression levels of NF-κB in midbrain tissue of rats in various groups detected by Western blotting method A:Electrophoregram;Lane 1:Control group;Lane 2:Model group;Lane 3-5:Low,middle,and high doses fo QNZTJN groups;Lane 6:Positive drug control group. B:Histogram;1:Control group;2:Model group;3-5:Low,middle,and high doses of QNZTJN groups;6:Positive drug control group.*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group. |
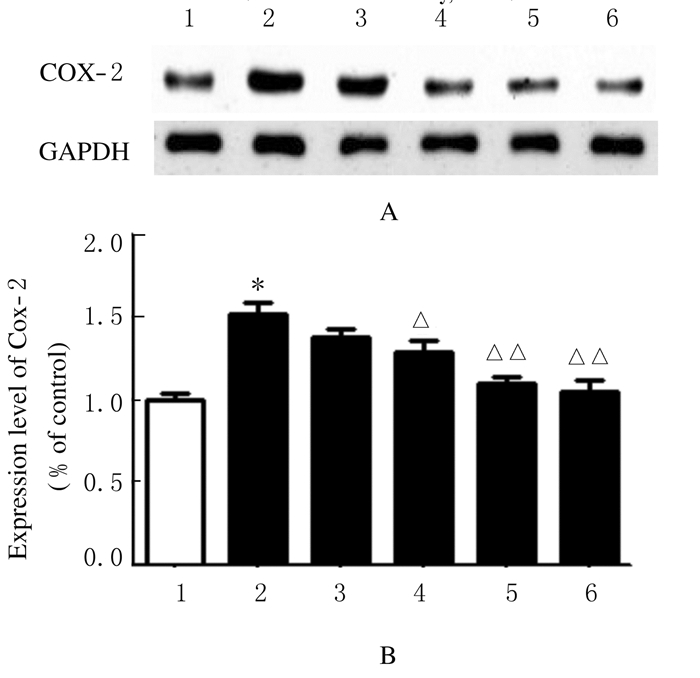
免疫组织化学检测结果:与空白组(100%)比较,模型组大鼠中脑导水管周围灰质区COX-2阳性细胞表达水平 (144%)明显升高(P < 0.01);与模型组比较,低、中和高剂量清脑止痛胶囊组及阳性药组大鼠中脑导水管周围灰质区COX-2阳性细胞表达水平(130%、120%、104%和102%)降低,且中、高剂量清脑止痛胶囊组和阳性药组与模型组比较差异有统计学意义(P < 0.05或P < 0.01),见图 4(插页二)。Western blotting检测结果:与空白组(100%)比较,模型组大鼠中脑组织中COX-2表达水平(152%)明显升高(P < 0.01);与模型组比较,低、中和高剂量清脑止痛胶囊组和阳性药组大鼠中脑组织中COX-2表达水平(141%、129%、110%和105%)降低,且中、高剂量清脑止痛胶囊组和阳性药组与模型组比较差异有统计学意义(P < 0.05或P < 0.01),见图 5。
|
| 图 4 各组大鼠中脑组织中COX-2表达水平(免疫组织化学,×400) Fig.4 Expression levels of COX-2 in midbran tissue of rats in various groups(Immunohistochemistry,×400) A:Control group; B: Model group;C-E:Low,middle,and high doses of QNZTJN groups;F: Positive drug control group. |
|
| 图 5 Western blotting法检测各组大鼠中脑组织中COX-2表达水平 Fig.5 Expression levels of COX-2 in midbrain tissue of rats in various groups detected by Western blotting method A:Electrophoregram;Lane 1:Control group;Lane 2:Model group;Lane 3-5:Low,middle,and high doses fo QNZTJN groups;Lane 6:Positive drug control group. B:Hostogram;1:Control group;2:Model group;3-5:Low,middle,and high dose of QNZTJN groups;6:Positive drug control group. *P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group. |
与空白组比较,模型组和低剂量清脑止痛胶囊组大鼠血浆中PGE2、IL-1β和TNF-α水平明显升高(P <0.05或P <0.01),中脑组织中PGE2、IL-1β和TNF-α水平明显升高(P <0.05或P <0.01);与空白组比较,中、高剂量清脑止痛胶囊组和阳性药组大鼠血浆中PGE2、IL-1β和TNF-α水平差异无统计学意义。与模型组比较,中、高剂量清脑止痛胶囊组和阳性药组大鼠血浆中PGE2、IL-1β和TNF-α水平明显降低(P <0.05或P <0.01),(除外中剂量清脑止痛胶囊组血浆IL-1β水平);中和高剂量清脑止痛胶囊组大鼠中脑组织中PGE2、IL-1β和TNF- α水平随剂量的增加逐渐降低,但与模型组比较差异无统计学意义(P <0.05)。见表 1。
(n=5, ± s) ± s) |
||||||
| Group | PGE2 | IL-1β | TNF-α | |||
| Plasma [ρB/(ng·L-1)] |
Tissue [wB/(ng·g-1)] |
Plasma [ρB/(ng·L-1)] |
Tissue [wB/(ng·g-1)] |
Plasma [ρB/(ng·L-1)] |
Tissue [wB/(ng·g-1)] |
|
| *P < 0.05,** P < 0.01 compared with control group;△P < 0.05,△△P < 0.01 compared with model group. | ||||||
| Control | 180.35±14.73 | 27.53±3.4 | 11.29±2.45 | 85.23±9.84 | 57.44±7.28 | 1.08±0.03 |
| Model | 220.54±27.83** | 39.21±7.92* | 12.4±4.89* | 123.31±20.25** | 76.87±10.53** | 1.26±0.11* |
| QNZTJN | ||||||
| Low | 201.01±29.99* | 36.26±6.98* | 12.24±4.01* | 122.81±15.67** | 68.39±12.7* | 1.24±0.12* |
| Middle | 193.34±14.52△ | 34.01±5.76 | 11.65±2.98 | 123.46±10.99** | 62.37±8.88△ | 1.23±0.10* |
| High | 185.47±16.88△△ | 30.48±4.35 | 11.25±3.1△ | 115.46±13.4 | 59.66±10.45△△ | 1.15±0.11 |
| Positive drug control | 186.83±15.77△△ | 30.5±4.56 | 11.59±3.54△ | 104.59±12.79△ | 62.64±9.86△△ | 1.19±0.09 |
清脑止痛胶囊的主要成分包括天麻、川芎、蒺藜、枸杞子、牛膝、香附、丹参、熟地黄、藁本和细辛,有祛风清脑、化瘀止痛功效,用于普通型偏头痛肝风夹瘀证[5]。已有研究[6, 7, 8]表明天麻和川芎对治疗偏头痛有很好的疗效。
偏头痛的发病机制复杂,目前认为三叉神经血管系统激活导致的硬脑膜无菌性炎症为关键环节[9],因此本实验从神经源性炎症入手,探讨偏头痛的发病机制。NTG致偏头痛动物模型是一个公认的偏头痛模型,是目前用于研究人类偏头痛发病机制较理想的选择。
NF-кB是一种介导信号传递的快反应转录因子,广泛存在于多种类型的真核细胞中,可调整多种基因的表达[10]。研究[11]表明:NF-кB是许多炎症介质基因表达所需的一种转录因子,其可在炎症部位高度表达。NF-кB通常以p65-p60二聚体的形式存在,在正常生理状态下,NF-кB与抑制因子IκB结合并以三聚体复合物的形式存在于细胞浆中,而在应激状态下IκB发生磷酸化,使NF-кB迅速进入核内并与相应基因上的κB位点特异结合,引发目的基因如TNF-α、IL-1β、IL-2和IL-6等转录 [12, 13, 14]。已有研究[15]显示:在NTG偏头痛大鼠模型中,三叉神经分布的硬脑膜处NF-кB表达增强,从而促进偏头痛发作时的炎症反应,提示在神经源性炎症的产生以及偏头痛发作的过程中,NF-кB起重要作用。本实验采用免疫组织化学和Western blotting法检测大鼠中脑组织中NF-кB水平结果显示:NTG致偏头痛模型大鼠脑组织中NF-кB表达水平升高,给予清脑止痛胶囊可以降低NF-кB的表达水平。
COX-2为诱导型环氧合酶,又称“炎症反应基因”。在正常情况下COX-2表达量很少,而在应激状态下COX-2迅速合成表达,参与与炎症相关的病理生理过程。COX-2受NF-кB调控,可通过应用COX-2抑制剂抑制中枢致敏作用,从而抑制偏头痛的发生[16]。本研究结果显示:NTG致偏头痛模型组大鼠中脑组织中COX-2表达水平升高,给予清脑止痛胶囊可以降低COX-2表达水平。此外,COX-2的催化产物PGE2可以改变感觉神经元的敏感性,增加刺激引发的冲动发放数目,促进炎症反应,而细胞因子如IL-1、IL-6和TNF-α又可诱导COX-2的合成。临床研究[17]显示:偏头痛患者头痛发作期间,血液和唾液中PGE2水平升高。本文作者发现:NTG致偏头痛大鼠脑干和血浆中PGE2表达水平升高,给予清脑止痛胶囊可以降低PGE2表达。
细胞因子是由多种细胞分泌的小分子物质,在炎症和免疫的病理生理过程中发挥重要作用。神经源性炎性反应可使IL-1β和TNF- α分泌增多,上调的IL-1β和TNF- α可增强血管内皮细胞表达细胞间黏附因子的能力,促进白细胞黏附于血管内皮,加重三叉神经无菌性炎症反应的状态。研究[18, 19]显示:静脉注射NTG后,IL-1β蛋白表达水平升高。偏头痛患者血浆和脑脊液中IL-1β和TNF-α水平均升高[20, 21]。本实验结果显示:NTG致偏头痛大鼠血浆和中脑组织中IL-1β和TNF- α表达水平升高,给予清脑止痛胶囊可以降低IL-1β和TNF-α的表达水平。
综上所述,清脑止痛胶囊可使由NTG诱发的偏头痛模型大鼠脑组织中与神经源性炎症相关的炎症因子如NF-кB、COX-2、PGE2、IL-1β和TNF- α等表达水平降低,从而对偏头痛起到预防作用。
| [1] | 华 赞.头痛宁胶囊联合尼莫地平治疗偏头痛的疗效观察[J].实用心脑肺血管杂志,2014,3(22):81-82. |
| [2] | 董兰真,蒲圣雄,周冀英.偏头痛与神经源性炎症的研究进展[J].重庆医学,2015,44(8):1126-1128. |
| [3] | 周永红,王新陆,胡怀强,等.硝酸甘油型实验性偏头痛大鼠模型建立与评价[J].中国神经免疫学和神经病学杂志,2005,12 (2):113. |
| [4] | 袁博博.偏头痛实验动物模型的研究现状[J].医学综述,2011,17(10):1447-1450. |
| [5] | 孙亚玲,贾敬全,吴 丹,等.清脑止痛胶囊治疗普通型偏头痛Ⅳ期临床安全性和疗效观察[J].心脑血管病防治,2013,8(13):285-288. |
| [6] | 刘慧兰,曹克刚,高永红,等.天麻素预防大鼠偏头痛发作的功效评价及其作用机制研究[J].中国中医药信息杂志,2008,15(2):32-33. |
| [7] | 王 强,沈 岚,梁 爽,等.川芎对天麻指标成分在偏头痛大鼠体内药动学的影响[J].中成药,2015,37(1):62-69. |
| [8] | 杨子谊,吴红彦,王红蕾.天芎头风颗粒对偏头痛大鼠的防治作用及其机制[J].中国老年学杂志,2012,32(23):5175-5176. |
| [9] | Dalkara T,Zervas NT,Moskowitz MA.From apreading depression to the trigeminovascular system[J].Neurol Sci,2006,27(2):S86-90. |
| [10] | Li Q,Verma IM.NF-κB regulation in the immune system[J].Nat Rev Immnol,2002,2(10):725-734. |
| [11] | Greco R,Tassorelli C,Cappelletti D,et al.Activation of the transcription factor NF-κB in the nucleus trigenminalis caudalis in an animal of migrain[J].Neurotoxicology,2005,26(5):795-800. |
| [12] | Senftleben U,Karin M.The IKK/ NF-κB pathway[J].Crit Care Med,2002,30(Suppl 1):S18-S26. |
| [13] | Karin M,Lin A.NF-κB at the crossroads of life and death [J].Nat Immunol,2002,3(3):221-227. |
| [14] | Ghosh S,Karin M.Missing pieces in the NF-κB puzzle [J].Cell,2002,109(2):S81-S96. |
| [15] | 牛争平,杨丽白,解龙昌,等.硝酸甘油诱导偏头痛大鼠三叉神经尾核核因子-κB表达增加[J].国际脑血管病杂志,2007,15(7):505 -508. |
| [16] | Zhang XC,Kainz V,Jakubowski M,et al.Localization of COX-1 and COX-2 in the intracranial dura mater of the rat [J].Neurosci Lett,2009,452(1):33-36. |
| [17] | Vardi J,Flechter S,Alguati A,et al.Prostaglandin-E2 levels in the saliva of common migrainous women[J].Headache,1983,23(2):59-61. |
| [18] | 周兆丽,张吉臻.静脉注射硝酸甘油脑膜炎症因子IL-1β及COX-2表达的研究[J].中国实用内科杂志,2006,26(S2):59-60. |
| [10] | 董晓梦,荆 龙,陈金波.偏头痛模型大鼠相关活性物质表达[J].中国神经免疫学和神经病学杂志,2015,22(1):34-39,45. |
| [20] | Rozen T,Swidan SZ.Elevation of CSF tumor necrosis factor alpha levels in new daily persistent headache and treatment refractory chronic migraine[J].Headache,2007,47(7):1050-1055. |
| [21] | 李自如,高彩云,袁 军.偏头痛患者血清C-反应蛋白水平的变化[J].中国老年学杂志,2014,34(19):5568-5569. |
 2016, Vol. 42
2016, Vol. 42


