扩展功能
文章信息
- 万鑫, 何建平, 张欢, 林玲辉, 张甜, 费瑜
- WAN Xin, HE Jianping, ZHANG Huan, LIN Linghui, ZHANG Tian, FEI Yu
- 低分子壳聚糖对缺氧/复氧大鼠心肌细胞中ClC-3表达的影响
- Effects of low molecular weight chitosan on ClC-3 expression in cardiomyocytes of rats with hypoxia-reoxygenation injury
- 吉林大学学报(医学版), 2016, 42(03): 491-495
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 491-495
- 10.13481/j.1671-587X.20160314
-
文章历史
- 收稿日期: 2015-10-31
2. 邢台医学高等专科学校微生物和免疫学教研室, 河北 邢台 054000;
3. 吉林大学第二医院心内科, 吉林 长春 130041
2. Department of Pathogenic Biology and Immunology, Xingtai Medical College, Xingtai 054000, China;
3. Department of Cardiology, Second Hospital, Jilin University, Changchun 130041, China
缺氧/复氧(hypoxia/reoxygenation,H/R)损伤是指在短时间心肌供血中断后又在一定时间内恢复血供,从而使原缺血心肌发生较血供恢复前更严重的损伤[1]。近年来,随着休克治疗的发展和动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术、心脏外科体外循环及器官移植等方法的建立及推广应用,缺血再灌注损伤越来越引起广大医务工作者的关注,而如何防治该损伤是摆在科学工作者面前的首要任务,其中药物防治仍是重要手段。
氯离子是机体中含量最丰富的阴离子,其通道广泛存在于细胞膜系统中,与细胞多种生理病理活动和调节过程有关联。氯离子通道3(chloride channel 3,ClC-3)是电压门控氯离子通道ClC 家族成员之一,广泛分布于多种动物和人的心血管组织中,与心肌细胞容积调节有关联,呈外向整流特性[2, 3, 4]。近年研究[5]显示:ClC-3与心肌缺血再灌注损伤的发生发展密切相关。
壳聚糖是甲壳素脱乙酰后的产物,是一种天然的带正电荷的生物高分子线形多糖,具有降低血脂、降血压、降血糖、抗肿瘤、抗脂质过氧化、调节免疫和器官保护等多重生物学特性[6, 7]。低分子壳聚糖(low molecular weight chitosan,LMCTS)是壳聚糖降解后的产物,有较高的溶解度,易被吸收和利用[8]。本研究利用原代培养的大鼠心肌细胞,观察LMCTS对大鼠心肌细胞H/R损伤和ClC-3蛋白表达水平的影响,旨在探讨LMCTS对大鼠心肌细胞H/R损伤的保护作用,为今后进一步开发和利用LMCTS防治心肌缺氧损伤提供实验依据。
1 材料与方法 1.1 实验动物出生72 h内的清洁级Wistar大鼠乳鼠90只,雌雄不限,由吉林大学基础医学院实验动物中心提供,动物合格证号:吉实动质(2000)-042。
1.2 药品、主要试剂和仪器水溶性LMCTS(相对分子质量<5 000,脱乙酰度85.9%,合格证号:鲁卫食证2007-370000-000052)购于济南海得贝海洋生物工程有限公司。ClC-3大鼠单克隆抗体购自美国Abcam公司,羊抗鼠IgG购于天津三箭生物技术有限公司,Alexa Fluor 488标记的羊抗鼠IgG抗体购自中国沃特司生物系统有限公司,ClC-3引物购自上海生工公司,BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,第1链cDNA合成试剂盒购于北京全式金生物技术有限公司,RIPA 裂解液、Trizol、胰蛋白酶和青链霉素混合溶液均购于北京鼎国昌盛生物技术有限公司,胎牛血清为美国Gibco公司产品,高糖DMEM培养基购于赛默飞世尔生物化学制品(北京)有限公司。8000 DH 二氧化碳恒温培养箱购自美国Series公司,倒置荧光显微镜购自日本Nikon公司,LD4-2型低速离心机购自北京医用离心机厂。
1.3 LMCTS溶液的配制取0.1 g LMCTS干粉加入少量培养基,于室温搅拌溶解后,在20 mL容量瓶中定容,制备 5 g·L-1储存溶液,然后先用分析纯滤纸过滤,以除去残渣;再用0.25 μm针式滤器过滤除菌后备用。使用时分别吸取120、240 和360 μL储存溶液加入直径为3 cm的培养皿中,补齐培养基至3 mL,进行培养。
1.4 大鼠原代心肌细胞的培养取Wistar大鼠乳鼠90只,雌雄不限。将其在75%酒精中消毒处死,然后在无菌条件下,剪开心包膜,取出心脏放入预冷的PBS中,冲洗3次;加0.125 %胰蛋白酶37℃消化5 min,弃去液体。将心脏用眼科剪刀剪成l mm×l mm×l mm大小的组织块,再加0.125 %胰蛋白酶37℃消化 10 min,转移至离心管中,加入10 mL PBS,1 000 r·min-1离心10 min,弃上清。加入适量的DMEM培养基吹打离心管底壁,制成细胞悬液,再加入10 %胎牛血清和1 %双抗。于直径为3 cm的培养皿中差速贴壁90 min后,小心吸出未壁贴细胞悬液至新的培养皿中,培养72 h后用于后续实验。
1.5 大鼠心肌细胞形态学观察将培养72 h的心肌细胞置于普通光学倒置显微镜下,观察大鼠心肌细胞的生长状况,如细胞贴壁、细胞伸展和融合情况等。
1.6 H/R损伤模型的建立和药物处理将培养72 h的心肌细胞饥饿处理24 h后随机分为空白对照组、模型组和不同浓度LMCTS组。空白对照组细胞正常培养,不给予任何处理;模型组细胞放入与真空泵相连的低压氧仓中,低压缺氧(真空度:0.09 MPa)处理1 h后,于37℃复氧24 h;不同浓度LMCTS组,首先按1.3方法在细胞中加入终浓度为200、400和600 mg·L-1的LMCTS溶液,培养24 h后按上述模型组处理方法操作。
1.7 RT-PCR法检测大鼠心肌细胞中ClC-3 mRNA表达水平采用Trizol提取各组细胞总RNA,检测并分析RNA的浓度和纯度,采用紫外光分光光度计测吸光度(A)值[A(260)和A(280)],重复 3 次。当A(260) 与 A(280) 之比在 1.8~2.1 时,采用逆转录试剂盒将RNA逆转录成cDNA,然后行PCR扩增。PCR引物序列:ClC-3上游引物,5′-TGGCTGCTGACGTTATGAGA-3′;下游引物,5′-CGAGAACTGCCAACGATACC-3′。GAPDH上游引物:5′-GGGTGATGCTGGTGCTGAGTATGT-3′,下游引物:5′-AAGAATGGGAGTTGCTGTTGAAG-T-3′。PCR扩增反应条件为:95℃预变性5 min,94 ℃变性30 s,58℃退火40 s,72℃延伸30 s,共32个循环;72℃延伸5 min。PCR扩增产物经琼脂糖凝胶电泳后,采用图像分析软件分析ClC-3与GAPDHA值的比值。
1.8 Western blotting法检测大鼠心肌细胞中ClC-3蛋白相对表达水平采用200 μL RIPA裂解液将各组细胞裂解,再用干净的细胞刮将细胞迅速刮下,转移至1.5 mL EP管中,冰上裂解30 min,12 000 r·min-1、4℃离心5 min。取上清,采用BCA蛋白浓度测定试剂盒测定蛋白质浓度。SDS-PAGE电泳,浓缩胶80 V恒压,分离胶160 V恒压。根据Marker条带的相对分子质量,切胶转移至醋酸纤维素膜上,转膜条件为300 mA、93 min。转膜结束后,用TBST溶液洗膜,共3次,每次10 min。然后用5 %的脱脂奶粉封闭2 h,洗膜3次,再用ClC-3抗体(1:1 000)室温摇床上孵育2 h(或4℃过夜)。洗膜3次,羊抗鼠IgG抗体(1:1 000)室温孵育2 h,洗膜3次,加ECL显色液后,采用多功能成像系统显影。以各组大鼠心肌细胞中ClC-3蛋白表达水平与GAPDH蛋白表达水平比值作为ClC-3蛋白的相对表达水平。
1.9 免疫荧光实验检测大鼠心肌细胞表面荧光强度按每孔1×105个将细胞接种于含有1 cm×1 cm载玻片的24孔板中。37℃、5 % CO2恒温培养箱中培养。细胞分组和各组处理方法同1.6。2~3 d后弃培养液,采用PBS轻洗3次,每次5 min;再用预冷的4 %多聚甲醛固定细胞20 min,PBS轻洗3次,每次5 min;然后用 0.3 % TritonX-100室温下漂洗15 min,PBS漂洗3次,每次5 min;10%山羊血清37℃封闭30 min,PBS漂洗3次,每次5 min;加入大鼠ClC-3抗体 (Abcam,稀释度 1:100 )于4℃过夜;取出后用PBS漂洗3次,每次5 min;加入荧光标记的羊抗鼠IgG抗体(稀释度1:100),37℃避光孵育1.5 h;取出,PBS漂洗细胞3次,每次5 min;采用500 g·L-1甘油封片,荧光显微镜观察并拍照,采用Image J软件分析心肌细胞表面荧光强度。
1.10 统计学分析采用SPSS 11.0统计软件进行统计学分析。各组大鼠心肌细胞中ClC-3 mRNA和蛋白相对表达水平以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组大鼠心肌细胞形态表现在倒置显微镜下可观察到大鼠心肌细胞贴壁生长,初为圆形,后逐渐成梭形,胞体较小,胞质有颗粒样物质;继而细胞逐渐在培养皿底壁展开,并随着细胞不断长大,伸出伪足相互交织成网。见图 1(插页二)。
|
| 图 1 培养72 h后大鼠原代心肌细胞形态表现(×200) Fig.1 Morphology of primary cardiomyocytes of rats after cultured for 72 h(×200) |
模型组大鼠心肌细胞中ClC-3 mRNA表达水平(275.57±10.74)明显高于空白对照组(110.61±2.41),组间比较差异有统计学意义(P<0.01);200 mg·L-1 LMCTS组大鼠心肌细胞中ClC-3 mRNA表达水平(152.66±17.83)低于模型组(P<0.05);400和600 mg·L-1 LMCTS组大鼠心肌细胞中ClC-3 mRNA的表达水平 (121.50±13.50,102.73±11.60) 明显低于模型组(P<0.01),且以600 mg·L-1 LMCTS组为最低。见图 2。
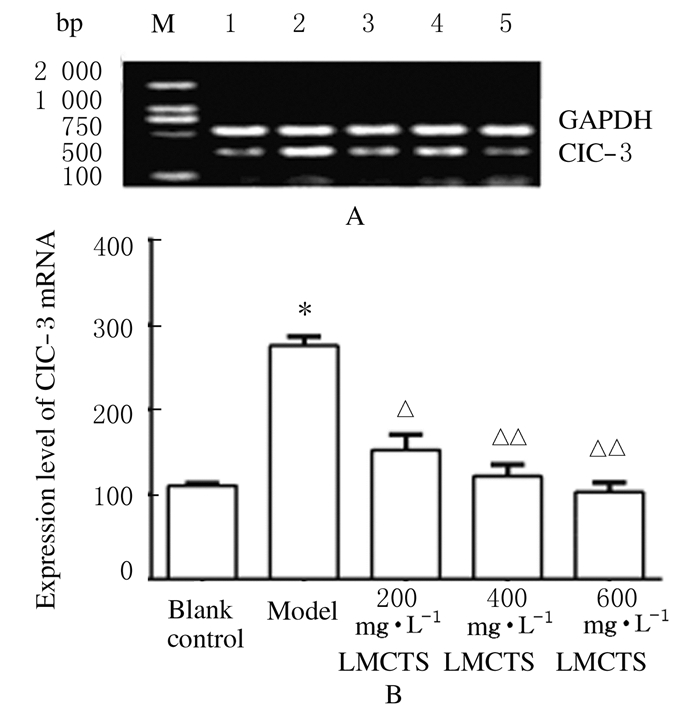
|
|
A: Electrophoregram;M:2000 bp marker; Lane 1: Blank control group; Lane 2: Model group; Lane 3-5: 200,400, and 600 mg·L-1 LMCTS groups. B: Histogram; * |
模型组大鼠心肌细胞中ClC-3的蛋白相对表达水平(359.34±9.33)明显高于空白对照组(288.61±15.00),组间比较差异有统计学意义(P<0.01);200 mg·L-1 LMCTS组ClC-3蛋白相对表达水平(342.62±2.43)低于模型组 (P < 0.05);400(272.91±20.92)和600 mg·L-1(234.63±15.29)LMCTS组ClC-3蛋白相对表达水平明显低于模型组(P<0.01),且以600 mg·L-1 LMCTS组表达水平为最低。见图 3。 2.4 各组心肌细胞表面荧光强度 免疫荧光检测结果:与对照组比较,模型组大鼠心肌细胞表面荧光强度明显增强,而LMCTS组大鼠心肌细胞表面荧光强度较模型组明显减弱。见图 4(插页二)。

|
|
A: Electrophoregram;M:Marker; Lane 1: Blank control group; Lane 2-4: 200,400, and 600 mg·L-1 LMCTS groups; Lane 5: Model group.B:Histogram; * |
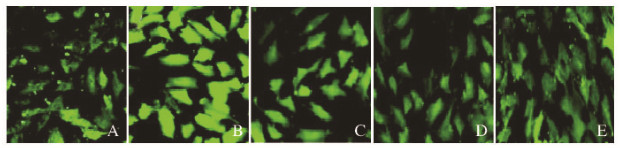
|
| 图 4 各组大鼠心肌细胞表面荧光强度(×200) Fig.4 Fluorescence intensities of ClC3 protein in cardiomyocytes of rats in various groups (×200) |
心肌缺血再灌注损伤是目前临床上治疗缺血性心脏病时常见的一种病理损害,其中心肌细胞的 H/R损伤是其主要的病理基础,而成功构建细胞H/R损伤模型对研究心肌缺血再灌注损伤机制及筛选防治缺血性心脏病的有效药物有重要意义[9, 10]。目前,构建H/R损伤模型的方法主要有物理性和化学性两种,但二者各有利弊。因此,细胞H/R损伤模型的成功建立需要在实验过程中针对不同细胞、不同实验要求和实验条件摸索适合的造模方法。由于心脏是人体内对缺氧较为敏感的器官,因此当动脉血氧饱和度下降到75%~80%时,机体即出现氧供应不足或发生缺氧症状。研究[11, 12]显示:低压缺氧模型可造成脑组织的H/R损伤,破坏血脑屏障,而利用真空泵也可造成细胞或组织器官的缺氧损伤。因此,本实验参照以往文献并结合自身条件,采用真空低压来构建H/R损伤模型。本研究中模型组大鼠心肌细胞中ClC-3蛋白相对表达水平明显高于空白对照组,这与以往文献[5]报道的心肌组织的缺血再灌注损伤可导致ClC-3蛋白表达升高的结果相吻合,表明该模型构建成功,可用于后续实验。
ClC-3蛋白是阴离子通道蛋白,广泛存在于酵母、细菌、植物和动物中。在哺乳动物中,ClC-3主要在中枢神经系统、心血管、肾、视网膜和肠道等部位表达丰富,其功能涉及细胞容积调节、免疫应答、迁移、增殖、分化及凋亡等[13]。近来研究[14]证实:ClC-3蛋白在心肌缺血、缺氧和心肌肥大中发挥重要作用,但LMCTS对H/R损伤心肌细胞的保护作用与ClC-3通道之间的相关性尚无文献报道。LMCTS是一种天然带正电荷的高分子化合物,是甲壳素脱乙酰产物。文献[15]报道:壳聚糖对球囊损伤大鼠腹主动脉再狭窄具有保护作用,且一定相对分子质量的壳聚糖也可在一定范围内调节血管平滑肌细胞和血管成纤维细胞的增殖。本实验利用原代培养的乳鼠心肌细胞的低压H/R损伤模型,观察LMCTS对H/R损伤大鼠心肌细胞中ClC-3表达影响的结果表明:LMCTS对H/R损伤的心肌细胞中ClC-3表达具有抑制作用,其中以600 mg·L-1LMCTS的作用最明显,并通过随后的免疫荧光实验得到证实。已有文献[5]报道:在大鼠个体缺血再灌注损伤中,其ClC-3表达水平升高,而LMCTS则可抑制H/R损伤的心肌细胞中ClC-3的表达,进一步表明LMCTS也可通过抑制H/R损伤的心肌细胞中ClC-3表达来保护心肌细胞免受H/R损伤。
研究[16, 17, 18, 19]证实:黄芪多糖、大蒜多糖和附子多糖对乳鼠心肌细胞H/R损伤有保护作用。因此,本研究结果不仅进一步证实了保护心肌细胞H/R损伤的一个新靶点,而且还发现了新的多糖在心肌H/R损伤保护中的作用及其与ClC-3通道之间的关系。本研究为进一步开发高效低副作用的保护心肌细胞H/R损伤的天然多糖类药物奠定了实验基础。
| [1] | 刘 威,张成义,沈 楠,等.五味子乙素对乳鼠缺氧/复氧损伤心肌细胞的保护作用及其机制[J].吉林大学学报:医学版,2014,40(5):977-980. |
| [2] | Jentsch TJ.ClC chloride channels and transporters from genes to protein structure[J].Crit Rev Biochem Mol Biol,2008,43(1):3-36. |
| [3] | Qian Y,Du YH,Tang YB,et al.ClC-3 chloride channel prevents apoptosis induced by hydrogen peroxide in basilar artery smooth muscle cells through mitochondria dependent pathway[J].Apoptosis,2011,16(5):468-477. |
| [4] | Zhu L,Yang H,Zuo W,et al.Differential expression and roles of volume-activated chloride channels in control of growth of normal and cancerous nasopharyngeal epithelial cells[J].Biochem Pharmacol,2012,83(3):324-334. |
| [5] | 邱少波,梁 燕,刘 萍.冠心康对大鼠缺血再灌注损伤心肌氯通道CLC-2、CLC-3、CFTR表达的影响[J].中西医结合心脑血管病杂志,2013,11(12):1482-1485. |
| [6] | 刘静娜,张家骊,夏文水.壳聚糖降低脂质过氧化的作用[J].食品与生物技术学报,2010,29(6):836-841. |
| [7] | 陈 伟,陈惠英,张 彦.壳聚糖在医药领域的应用[J].医学信息,2007,20(3):507-508. |
| [8] | 韩宝芹,王 剑,蔡文娣,等.水溶性低分子壳聚糖对糖尿病大鼠血糖的影响[J].中国海洋大学学报:自然科学学报,2011,41(1/2):87-92. |
| [9] | Chen Z,Hu Z,Lu ZQ,et al.Differential microRNA profiling in a cellular hypoxia reoxygenation model upon post-hypoxic propofol treatment reveals alterations in autophagy signaling network[J].Oxid Med Cell Longev,2013,2013(4):378484. |
| [10] | 杜毓菁,徐一心,王紫璇,等.细胞缺氧/复氧模型的建立方法与应用[J].南昌大学学报:医学版,2015,55(2):88-91. |
| [11] | 杨 虎,张永亮,龚海英,等.蕨麻对急性低压缺氧大鼠脑组织保护作用及Caspase 3表达的影响[J].武警后勤学院学报:医学版,2014,23(11):893-900. |
| [12] | 姚寅生,刘家传,杨艳艳,等.缺氧预处理对创伤性脑损伤大鼠Claudin-5表达及血-脑屏障通透性的影响[J].中国微侵袭神经外科杂志,2014,19(4):180-183. |
| [13] | Guo R, Pan F,Tian Y,et al.Down-regulation of ClC-3 expression reduces epidermal stem cell migration by inhibiting volume-activated chloride currents[J].J Membr Biol,2016,1(1):1-12. |
| [14] | Duan DD.The ClC-3 chloride channels in cardiovascular disease[J].Acta Pharmacol Sini,2011,32(6),:675-684. |
| [15] | 任彦锋,张 帆,王 莉,等,球囊损伤腹主动脉大鼠血浆NO水平的变化及WSC对其影响[J].中国实验诊断学,2013(8):1369-1371. |
| [16] | 闵 清,白育庭,余 薇,等.黄芪多糖对乳鼠心肌细胞缺氧/复氧损伤的保护作用[J].中国药理学通报,2010,26(12):1661-1664. |
| [17] | 余 薇,李 璐,姚 社,等.大蒜多糖对乳鼠心肌细胞缺氧/复氧损伤的保护作用[J].中国药理学通报,2010,26(5):697-699. |
| [18] | 刘 颖,纪 超,吴伟康.附子多糖保护缺氧/复氧乳鼠心肌细胞及其抗内质网应激机制的研究[J].中国病理生理杂志,2012,28(3):459-463. |
| [19] | 朱 娜,要瑞莉,刘俊双,等.大鼠肢体缺血/再灌注后心肌细胞凋亡及氧化应激的调节作用[J].中国老年学杂志,2015,35(23):6666-6668. |
 2016, Vol. 42
2016, Vol. 42


