扩展功能
文章信息
- 马雪, 张斌, 韩春耀, 刘明媛, 郝丽静, 葛树卿, 薛中原
- MA Xue, ZHANG Bin, HAN Chunyao, LIU Mingyuan, HAO Lijing, GE Shuqing, XUE Zhongyuan
- 特异性沉默α-catulin基因的表达对舌鳞状细胞癌TSCCA细胞增殖和凋亡的影响
- Effects of specific expression of α-catulin gene on proliferation and apoptosis of tongue squamous cell carcinoma TSCCA cells
- 吉林大学学报(医学版), 2016, 42(03): 486-490
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 486-490
- 10.13481/j.1671-587X.20160313
-
文章历史
- 收稿日期: 2015-09-13
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)简称口腔鳞癌,是口腔颌面部最常见的恶性肿瘤。在目前治疗方法中,手术、放疗和化疗仍是主要的治疗手段,虽然手术方式和同期修复水平在近几年有了明显的提高,但中晚期患者的5年生存率仍不理想[1]。舌鳞状细胞癌 (tongue squamous cell carcinoma,TSCC)是最常见的口腔癌,约占我国口腔癌发病总数的40%。α-catulin蛋白是一种α-连环蛋白相关蛋白(α-catenin-related protein),其结构类似于黏着斑蛋白(vinculin)和α-连环蛋白(α-catenin)[2]。有研究[3, 4, 5, 6, 7, 8, 9]显示:α-catulin在卵巢癌、子宫癌、肾癌、黑色素瘤、乳腺癌和非小细胞肺癌中均呈高表达,其在恶性肿瘤的发生发展、侵袭和转移中发挥重要的调节作用。而 α-catulin与TSCC的关系缺少相关研究。本实验观察沉默α-catulin基因后,人TSCC的TSCCA细胞增殖和凋亡情况,为探讨预防和治疗人TSCC的方法提供依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人TSCC的TSCCA细胞购自上海拜力生物公司;质粒由本课题组实验人员设计,江阴雨汐生物有限公司协助合成。LipofectaminTM 2000(江阴雨汐生物有限公司),RT-PCR引物(武汉转导生物科技发展有限公司),兔抗人α-catulin antibody(美国Thermo公司),DMEM培养基、链霉素/青霉素、小牛血清、PBS、EDTA消化液、75%酒精、Trypsin液、去核酸酶水、GAPDH、Trizol、氯仿、异丙醇、DEPC,电泳缓冲液、转移缓冲液、SDS-PAGE、硝酸纤维素膜、5%脱脂奶粉、解离液、羊抗兔IgG、彩虹marker、MTT、Annexin Ⅴ-FITC凋亡检测试剂盒、PI、RNA酶、1.12%枸橼酸钠溶液 (北京索莱宝科技有限公司)。倒置显微镜(日本Olympus公司),凝胶图像分析系统和酶联免疫检测仪(美国Bio-Rad公司),流式细胞仪(美国BD公司)。
1.2 细胞分组和转染转染前2d,取对数生长期的TSCCA细胞,将细胞按照每孔2×104个细胞铺至6孔培养板中,待细胞铺满90%孔底面积后转染。转染期间先将孔中的有血清培养基换成无血清培养基。分别将0.8 μg α-catulin质粒溶于50 μL Optimen无血清培养基中,2 μL Lipo 2000溶于48 μL Opti-men无血清培养基中,室温静置5 min。再将两者混匀,室温静置20 min后加入24孔板对应板中。6 h后换成有血清培养基,该组为α- catulin-siRNA组。采用同样方法将空质粒转染入TSCCA细胞,设为空质粒转染组。同时设置未转染质粒的TSCCA细胞为空白对照组。
1.3 RT-PCR法检测各组TSCCA细胞中α-catulin mRNA的相对表达水平转染后24、48和72 h分别从空白对照组、空质粒转染组和α-catulin -siRNA转染组细胞中提取细胞总RNA,按逆转录试剂盒说明进行逆转录合成cDNA。以GAPDH为内参,RT-PCR法扩增α-catulin目的基因。α-catulin扩增片段长度为292 bp,上游引物:5′-GAGGCATCCTAACTGCGAATC-3′,下游引物:5′-TCTGTGCTCATGGCTGGTGTA-3′;GAPDH扩增片段长度为452bp,上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游引物:5′-TCCACCACCCTGTTGCTGTA-3′。循环参数:94 ℃预变性5 min,94 ℃、30 s,65 ℃、30 s,72 ℃、1 min,30个循环,最后72 ℃延伸10 min。扩增产物在1.2%琼脂糖凝胶电泳中分析结果。目的基因的相对表达水平采用ΔΔCt方法计算。
1.4 Western blotting法检测各组TSCCA细胞中α-catulin蛋白的相对表达水平分别收集转染后24、48和72 h的3组细胞,经预冷的PBS清洗3次,置于冰上经RIPA充分裂解后抽提蛋白并定量。75%SDS-PAGE电泳分离,每孔总蛋白加样量为50 μg,电泳40 V、30 min,90 V、1.5 h,300 mA湿转2 h,将蛋白转至硝酸纤维素膜上,5%脱脂牛奶室温封闭2 h,兔抗人α-catulin (1∶1 000)4℃孵育过夜,PBS洗3次,加入辣根过氧化物酶偶联的羊抗兔IgG(1∶5 000),室温下杂交1 h,PBS洗10次,按化学发光法显影、定影。以GAPDH作为内参。使用Alpha Imager2200图像分析软件分析条带亮度。α-catulin蛋白表达水平=α-catulin蛋白条带值/GAPDH条带值。
1.5 MTT法检测细胞生长抑制率将转染后的3组细胞以每孔1×107个细胞接种于96孔培养板中,每组设6个复孔。分别于转染后24、48和72 h终止培养。每孔加入MTT(5 g·L-1)10 μL,继续培养4 h,弃上清,每孔加入DMSD 100 μL,振荡10 min,使结晶充分溶解,在酶标仪上测各孔490 nm波长处的吸光度(A)值。生长抑制率=(1-实验组A值/对照组A值)×100%。
1.6 流式细胞术检测各组TSCCA细胞凋亡率分别于转染后24、48和72 h收集各组细胞,采用0.25%胰蛋白酶消化,加入冰冷的PBS将细胞轻轻吹打成单个细胞,与漂浮细胞合并;5 000 r·min-1离心5 min;PBS洗2次,使用约500 μL PBS重悬细胞边振荡边加入5 mL预冷的70%乙醇,4 ℃固定过夜。染色前细胞用PBS洗2次,沉淀重悬于PI染液中(50 mg·L-1 PI+200 mg·L-1 RNase A),37 ℃避光染色30 min。流式细胞仪上机检测。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.7 统计学分析采用SPSS13.0软件进行统计学分析。各组TSCCA细胞中α-catulinmRNA和蛋白的相对表达水平、细胞生长抑制率及凋亡率均以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组TSCCA细胞中α-catulin mRNA相对表达水平各组TSCCA细胞转染后继续培养24 h,α-catulin-siRNA转染组细胞中α-catulin mRNA相对表达水平明显低于空质粒转染组和空白对照组(P < 0.01),空质粒转染组与空白对照组比较差异无统计学意义(P>0.05)。同时,随着培养时间的延长,α-catulin-siRNA转染组TSCCA细胞中α-catulin mRNA的相对表达水平逐渐降低,以72 h时表达水平最低,低于24和48h时的表达水平 (P < 0.01); 各时间点(24、48和72 h)α-catulin mRNA相对表达水平比较差异均有统计学意义(P < 0.01) 。见图 1和表 1。
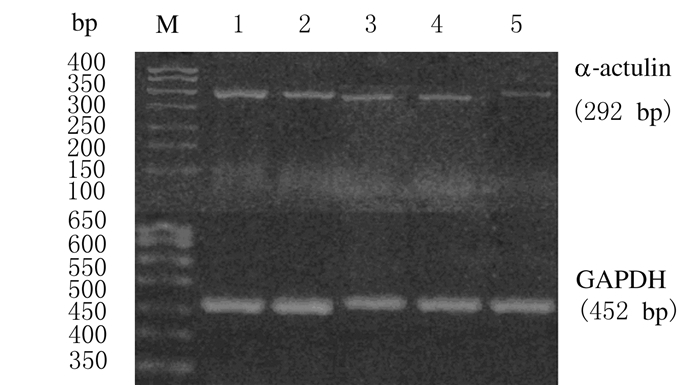
|
| Lane 1: Blank control group; Lane 2: Empty plasmid transfection group; Lane 3-5: α-catulin-siRNA transfection group(24, 48, and 72 h). 图 1 RT-PCR法检测各组TSCCA细胞中α-catulin mRNA表达电泳图 Fig.1 Electrophoregram of expressions of α-catulin mRNA in TSCCA cells in various groups detected by RT-PCR method |
| (x±s) | |
| Group | Relative expression level of α-catulinmRNA |
| Blank control | 0.83±0.24 |
| Empty plasmid transfection | 0.82±0.19 |
| α-catulin-siRNA transfection | |
| 24 h | 0.47±0.30*△ |
| 48 h | 0.35±0.60*△# |
| 72 h | 0.19±0.51*△#○ |
| * P < 0.01 vs blank control group;△ P < 0.01 vs empty plasmid transfection group;# P < 0.01 vs 24 h;○ P < 0.01 vs 48 h. | |
Western blotting检测结果:与空白对照组比较,空质粒转染组TSCCA细胞中α-catulin蛋白相对表达水平差异无统计学意义TSCCA(P>0.05),而α-catulin siRNA转染组TSCCA细胞中α-catulin蛋白的相对表达水平明显降低。Alpha Imager 2200图像分析软件分析条带亮度示:转染后24、48和72 h时,α-catulin-siRNA转染组TSCCA细胞中α-catulin蛋白的相对表达水平(0.32±0.62、0.28±0.71、0.19±0.58)均低于空白对照组(0.69±0.61)和空质粒转染组(0.69±0.61)(P < 0.05)。见图 2。
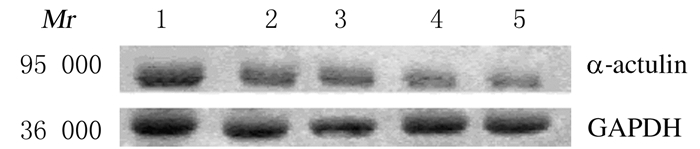
|
| M: Protein marker; Lane 1: Blank control group; Lane 2: Empty plasmid transfection group; Lane 3-5: α-catulin-siRNA transfection group (24, 48, and 72 h). 图 2 各组TSCCA细胞中α-catulin蛋白表达电泳图 Fig.2 Electrophoregram of expressions of α-catulin protein in TSCCA cells in various groups |
MTT法检测各组TSCCA细胞A值结果:α-catulin-siRNA转染组TSCCA细胞的生长曲线低平(图 3),24、48和72 h生长抑制率分别为(35.231±1.143)%、(35.924±1.035)%和(36.417±0.967)%,均高于各检验时间点空质粒转染组[(9.776±0.936)%,t=46.031,P < 0.001;(10.357±0.977)%,t=48.606,P < 0.001;(11.087±1.254)%,t=39.765,P < 0.001]和空白对照组[(8.315±0.829)%,t=51.961,P < 0.001;(9.987±1.036)%,t=45.744,P < 0.001;(12.372±0.984)%,t=44.777,P < 0.001]。
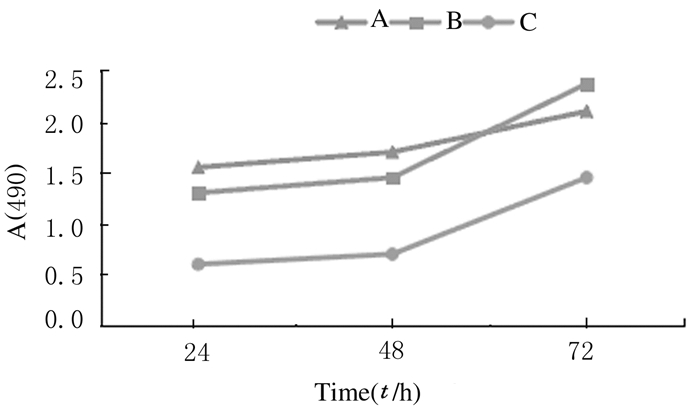
|
| A: Blank control group; B: Empty plasmid transfection group; C:α-catulin-siRNA transfection group. 图 3 各组TSCCA细胞的生长曲线 Fig.3 Growth curves of TSCCA cells in various groups |
利用Annexin Ⅴ-FITC/PI双染色检测TSCCA细胞凋亡情况。转染后48 h时,α-catulin-siRNA转染组TSCCA细胞中出现大量早期凋亡细胞,而空白对照组和空质粒转染组中少见凋亡细胞。
Annexin Ⅴ-FITC/PI双染色后采用流式细胞术检测各组细胞的凋亡率。α-catulin-siRNA转染组TSCCA细胞凋亡率峰值达到(18.014±1.030)%,高于空质粒转染组[(9.297±0.742)%,t=16.974,P < 0.001]和空白对照组[(9.323±1.247)%,t=21.738,P < 0.001]。见图 4。
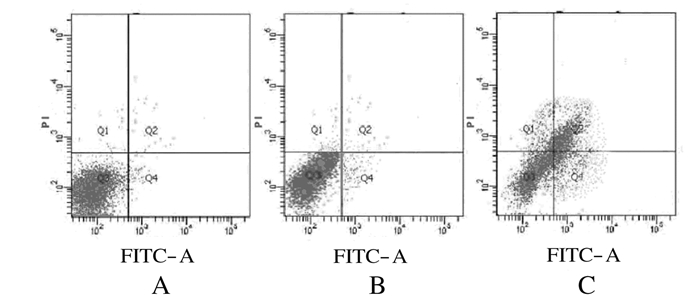
|
| A: Blank control group; B:Empty plasmid transfection group; C: α-catulin-siRNA transfection group. 图 4 各组TSCCA细胞培养48 h时细胞凋亡情况 Fig.4 Apoptosis situation of TSCCA cells after cultured for 48 hin various groups |
OSCC是严重危害人类健康的疾病,约占全身恶性肿瘤的3%[10],其中超过90%为鳞状细胞癌[11]。由于OSCC的治疗和预防在很多方面仍然处于探索阶段,所以目前OSCC尽管通过手术、放疗和化疗等方法治疗,但均难以彻底根治[13]。近年来OSCC发病年龄呈年轻化态势,尤其当临床中发生TSCC时,其诊断与治疗则变得更加棘手[12]。TSCC的发病率呈上升趋势。TSCC作为最常见的口腔恶性肿瘤,具有转移率高、易复发和预后差等特点。深入研究TSCC发生发展机制、揭示其生物学特性,对判断其恶性程度、指导临床治疗和评估预后具有重要意义。
Janssens等[14]克隆了一种新的人cDNA,基于其与α-catenin和vinculin序列具有相似性,将其命名为α-catulin。α-catulin是CTNNAL1编码的膜转运蛋白,其过表达可降低E-cadherin并增加N-cadherin、Snail/Slug和MMPs的表达,进而促进黑色素瘤的侵袭和转移[5]。 α-catulin 蛋白的结构表明其在细胞中起到连接细胞骨架的作用,具有维持细胞形态、细胞运动和黏附、细胞骨架重塑及细胞信号传导的调节等作用。细胞衰老是指细胞在执行生命活动过程中,随着时间的推移,细胞增殖与分化能力和生理功能逐渐发生衰退的变化过程。α-catulin能调节核因子κB(NF-κB)通路进而有致癌潜能[14]。研究[15, 16]显示:α-catulin能够击倒改变细胞周期调控中的几个关键基因,这些关键基因所诱导的细胞衰老可能是由染色体故障造成的,从而引起严重的DNA损伤并抑制受损DNA的修复能力,表明α-catulin通过抑制肿瘤细胞衰老而促进肿瘤生长。
本课题组将α-catulin-siRNA基因通过质粒转染入人TSCC的TSCCA细胞中,观察沉默α-catulin对TSCCA细胞生长的影响。采用RT-PCR法检测各组TSCCA细胞中α-catulin基因的沉默情况,证明α-catulin-siRNA对TSCCA中α-catulin基因沉默效果极佳;MTT实验结果显示:沉默α-catulin后,TSCCA细胞的增殖能力明显降低;流式细胞术结果证明沉默α-catulin基因后TSCCA的细胞凋亡率明显升高。
综上所述,靶向α-catulin RNA干扰质粒能有效抑制人TSCC的TSCCA细胞中α-catulin表达水平,从而抑制肿瘤细胞的增殖,促进TSCCA细胞的凋亡,显现了高效的抑瘤效应。因此,α-catulin有望成为治疗TSCC的新靶点,而其相关机制的进一步深入研究将为TSCC的基因治疗带来新的希望,并建立新的肿瘤治疗模式。
| [1] | 赵 珍,陈万涛,张建军,等.micro RNA-330-3p调控口腔鳞状细胞癌增殖和凋亡的实验研究[J].中华口腔医学研究杂志:电子版,2015,9(1):14-20. |
| [2] | Bear MD,Li M,Liu Y,et al.The Lbc Rho guanine nucleotide exchange factor α-catulin axis functions in serotonin-induced vascular smooth muscle cell mitogenesis and RhoA/ROCK activation[J].J Biol Chem,2010,285(43):32919-32926. |
| [3] | Wiesner C,Winsauer G,Resch U,et al.Alpha-catulin,a Rho signalling component,can regulate NF-κB through binding to IKK-beta,and confers resistance to apoptosis[J].Oncogene,2008,27(15):2159-2169. |
| [4] | Merdek KD,Nguyen NT,Toksoz D,et al.Distinct activities of the alpha-catenin family,alpha-catulin and alpha-catenin,on beta-catenin-mediated[J].Mol Cell Biol,2004,24(6):2410-2422. |
| [5] | Kreiseder B,Orel L,Bujnow C,et al.α-catulin downregulates E-cadherin and promotes melanoma progression and invasion [J].Int J Cancer,2013(3):521-530. |
| [6] | Liang CH,Chiu SY,Hsu IL,et al.α-catulin drives metastasis by activating ILK and driving an αγβ3 integrin signaling axis[J].Cancer Res,2012,73(1):428-438. |
| [7] | Kreiseder B,Holper-Schichl YM,Muellauer B,et al.Alpha-catulin contributes to drug-resistance of melanoma by acticating NF-κB and AP-1[J].PLoS One,2015,10(3):e0119402. |
| [8] | Xiang Y,Qin XQ,Liu HJ,et al.Identification of transcription factors regulating CTNNAL1 expression in human bronchial epithelial cells[J].PLoS One,2012,7(2):e31158. |
| [9] | Tkés AM,Szász AM,Juhász E,et al.Expression of tight junction molecules in breast carcinomas analysed by array PCR and immunohistochemistry[J].Pathol Oncol Res,2012,18(3):593-606. |
| [10] | de Camargo Cancela M,Voti L,Guerra-Yi M,et al.Oral cavity cancer in developed and in developing countries:population-based incidence[J].Head Neck,2010,32(3):357-367. |
| [11] | Cooper JS,Porter K,Mallin K,et al.National Cancer Database report on cancer of the head and neck:10-year update[J].Head Neck,2009,31(6):748-758. |
| [12] | Gil Z,Fliss DM.Contemporary management of head and neck cancers [J].Isr Med Assoc J,2009,11(5):296-300. |
| [13] | Ssashira T,Ueda N,Yamamoto K,et al.Proxl and FOXC2 act as regulators of lymphangiogenesis and angiogenesis in oral squamous cell carcinoma[J].PLoS One,2014,9(3):e92534. |
| [14] | Janssens B,Staes K,Van Roy F.Human alpha-catulin,a novel alpha-catenin-like molecule with conserved genomic structure,but deviating alternative splicing[J].Biochim Biophys Acta,1999,1447(2):341-347. |
| [15] | Fan LC,Chiang WF,Liang CH,et al.α-catulin knockdown induces senescence in cancer cells[J].Oncogene,2011,30(23):2610-2621. |
| [16] | 万 哲,刘 红,张 真,等.A-NK细胞促口腔鳞状细胞癌凋亡效应的研究[J].中国实验诊断学,2014,18(10):1582-1585. |
 2016, Vol. 42
2016, Vol. 42


