扩展功能
文章信息
- 韩春耀, 张斌, 马雪, 刘明媛, 薛中原, 郝丽静, 葛树卿
- HAN Chunyao, ZHANG Bin, MA Xue, LIU Mingyuan, XUE Zhongyuan, HAO Lijing, GE Shuqing
- 沉默α-catulin基因的人舌鳞状细胞癌TSCCA细胞模型的建立
- Establishment of tongue squamous cell carcinoma TSCCA cell model with silencing α-catulin gene
- 吉林大学学报(医学版), 2016, 42(03): 481-485
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 481-485
- 10.13481/j.1671-587X.20160312
-
文章历史
- 收稿日期: 2015-11-23
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是世界上常见的恶性肿瘤,占口腔癌总数的90%以上[1],其中舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)为最常见的OSCC。目前TSCC的治疗多采用以手术治疗为主、术后辅以放化疗的综合治疗方法,但效果并不理想,预后较差,研究[2, 3]表明:TSCC患者术后5年存活率 < 60%。因此,TSCC的基因治疗成为了近些年来研究的热点。α-catulin蛋白是一种α-连环蛋白相关蛋白(α-catenin-related protein),因其结构类似于黏着斑蛋白(vinculin)和α -连环蛋白(α-catenin)而得名。α-catulin蛋白具有调节信号通路传导、重塑细胞骨架、参与细胞运动及黏附等作用[4, 5]。目前有研究[6, 7]显示:α-catulin蛋白在恶性肿瘤中呈高表达,并且通过调节核转录因子kappa B(nuclear factor-kappa B,NF-κB )、小G蛋白(Rho)等信号通路与肿瘤细胞的侵袭及凋亡有密切关联。目前,有关α-catulin基因与TSCC的研究尚不多,对其作用机制的研究更少见。本研究通过RNA干扰(RNAi)技术构建α-catulin-shRNA表达载体,并将其转染至体外培养的人TSCC的TSCCA细胞中,为探讨α-catulin基因的功能及其在TSCC发生发展中的作用机制提供一个全新的细胞模型,也为TSCC的基因治疗提供实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人TSCC的TSCCA细胞(上海拜力生物公司),转化用大肠杆菌感受态细胞DH5 a(北京Tiangen Biotech公司)。DMEM/F12培养基、胎牛血清和胰蛋白酶(美国Hyclone公司),琼脂糖、琼脂粉和胰蛋白胨、酵母提取物(英国OXOID公司),用于插入shRNA的载体质粒pGPU6/GFP/Neo及阴性对照质粒(北京Biovector Co.,LTD公司),限制性内切酶BbsⅠ和BamHⅠ、T4 DNA连接酶以及RT-PCR试剂盒(日本Takara公司),RNA提取试剂Trizol、质粒提取试剂盒以及LipofectamineTM2000(美国Invitrogen公司),兔抗人α-catulin抗体(美国Thermo公司),全蛋白提取试剂盒(中国凯基生物公司)。二氧化碳恒温细胞培养箱(美国Forma Scientific 公司),荧光显微镜(上海光学仪器厂),荧光定量PCR仪、台式高速离心机和凝胶成像仪(北京六一实验仪器厂)。
1.2 shRNA的设计根据GenBank数据库提供的α-catulin(CTNNAL1)基因的核苷酸序列(NM_003798),按照Tuschl的设计原则[8],选择4个靶点设计4条靶向序列,分别命名为sh-catu1、sh-catu2、sh-catu3和sh-catu4(靶向序列见表 1)。含无义序列shRNA的阴性对照质粒命名为sh-nc。
| Vector | Target sequence(5′-3′) | Target position(bp) |
| sh-catu1 | GAGTATTTGACCGTATGAAAG | 929 |
| sh-catu2 | CACCACGCTTATTAATCATAA | 294 |
| sh-catu3 | GGGAATCCCAAATTAGTGACA | 1 673 |
| sh-catu4 | GACGGAACATGTCCAGTATGG | 1 940 |
2条互补的单链寡核苷酸片段各取10μL,加入10μL的退火缓冲液及20μLddH2O,制成混合液;按照95 ℃、2 min,然后每90 s下降1℃,降至25℃的程序退火,获得双链DNA片段。在T4连接酶的作用下,双链DNA片段与经BbsⅠ和BamHⅠ双酶切的pGPU6/GFP/Neo载体质粒相连。连接产物转化大肠杆菌DH5 a感受态细胞,种板后37℃培养过夜。随机挑取单克隆阳性菌落接种于含氨苄青霉素(终浓度为50 mg·L-1)抗性的LB平板上,37℃恒温摇床(180 r·min-1)培养12~16 h。按质粒提取试剂盒说明书提取质粒,送江阴雨汐生物科技有限公司进行测序鉴定。
1.4 α-catulin-shRNA表达载体的转染TSCCA细胞用含20%胎牛血清的DMEM/F12培养基于37℃、5%CO2的孵箱中培养。取处于对数生长期的TSCCA细胞,以每孔5×105接种于6孔板内,当细胞达到70%~80%融合时进行转染。转染前6 h换成无血清无抗生素的培养基,转染按照LipofectamineTM2000说明书进行。将细胞分为转染组(转染α-catulin-shRNA重组质粒)、阴性对照组(转染sh-nc重组质粒)及空白对照组(未处理)。转染后各组质粒置于37℃、5%CO2条件下培养4~5 h,换成含血清培养基继续培养。转染后48 h在荧光显微镜下观察细胞中绿色荧光蛋白(green fluorescence protein,GFP)的表达情况,流式细胞分选术(FACS)测定转染效率,转染效率=GFP阳性细胞数/筛选细胞总数×100%。
1.5 RT-PCR法检测各组TSCCA细胞中α-catulin mRNA的相对表达水平和沉默效率细胞转染后48 h用Trizol试剂提取细胞总RNA,并按照RT-PCR试剂盒说明书将其逆转录成cDNA。取1 μL模板cDNA,按试剂盒说明书配制反应体系,置于RT-PCR反应仪中:95℃、30 s,55℃、30 s,72℃、1 min,共40个循环。α-catulin基因引物:上游引物F,5′- CATTGGAAGTCATCTTGGAGC -3′;下游引物R,5′- GCTGTGTCGCTGTACTATGA -3′。内参GAPDH引物:上游引物F,5′- CCACTAGGCGCTCACTGTTC -3′;下游引物R,5′- AGGCGCCCAATACGACCAA -3′。引物的合成由江阴雨汐生物科技有限公司完成。2%凝胶电泳观察扩增结果。α-catulin mRNA相对表达水平用2-△△CT表示[9]。α-catulin mRNA的沉默效率=1-(各转染组相对表达水平/空白对照组相对表达水平)×100%。
1.6 Western blotting法检测各组TSCCA细胞中α-catulin蛋白的相对表达水平和沉默效率按全蛋白提取试剂盒配制细胞裂解缓冲液,提取总蛋白,二喹啉甲酸(BCA)法蛋白定量试剂盒检测总蛋白浓度。以10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转至硝酸纤维膜(PVDF)上,5%脱脂奶封闭1 h,洗膜,加入兔抗人α-catulin单克隆抗体(稀释浓度1:500),4℃过夜。洗膜,加入辣根过氧化物酶标记的二抗,温室作用1 h。然后加入ECL显示液,反应3 min,入暗室曝光45 s,显影定影后扫描分析。采用Image-Pro Plus图像分析软件分析灰度值,各组蛋白条带灰度值均以对应的内参照β-action为基准进行校正,计算相对灰度值。α-catulin蛋白的沉默效率=1-(各转染组相对灰度值/空白对照组相对灰度值)×100%。
1.7 统计学分析采用SPSS13.0统计软件进行统计学分析。α-catulin基因的mRNA和蛋白相对表达水平及沉默效率以x±s表示,mRNA和蛋白相对表达水平组间比较采用方差分析,组间两两比较采用q检验;沉默效率组间比较采用χ2 检验。以α=0.05为检验水准。
2 结果 2.1 重组质粒的测序鉴定测序结果:重组质粒中插入的目的序列与设计的α-catulin-shRNA序列完全一致,未发现碱基错配及突变,说明成功构建了表达α-catulin shRNA的真核表达载体。见图 1(插页二)。
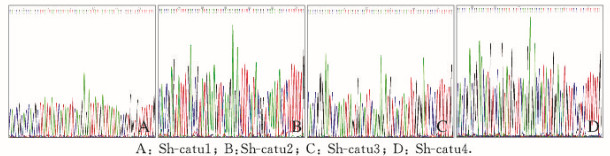
|
| 图 1 重组质粒的测序结果 Fig.1 Sequencing results of recombinant plasmid |
荧光显微镜下观察转染48 h后的TSCCA细胞,荧光主要集中于细胞质中(图 2,见插页二),表明GFP在细胞中成功表达。FACS检测结果显示各组转染效率均在55%以上。
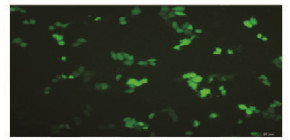
|
| 图 2 重组质粒sh-catu2转染后TSCCA细胞中GFP的表达(×100) Fig.2 Expression of GFP in TSCCA cells after transfected with sh-catu2(×100) |
mRNA和蛋白的相对表达水平和沉默效应RT-PCR检测结果:与阴性对照组及空白对照组比较,转染组TSCCA细胞中α-catulin mRNA表达水平明显降低(P < 0.05),见图 3。与空白对照组比较,阴性对照组细胞中α-catulin mRNA的表达水平差异无统计学意义(P>0.05)。 各转染组TSCCA细胞中 α-catulin mRNA的 沉默效率分别为(43.20±1.32)%、(77.00±1.78)%、(62.70±1.53)%和(72.50±1.69)%,均高于空白对照组(0%)和阴性对照组 (5.00%±0.25%) (P < 0.05) (表 2)。Western blotting检测结果:转染组各条带明显变细(图 4)。与空白对照组比较,阴性对照组TSCCA细胞中α-catulin蛋白的相对表达水平差异无统计学意义(P>0.05)。转染组TSCCA细胞中α-catulin 蛋白相对表达水平低于空白对照组和阴性对照组(P < 0.05)。 各转染组细胞沉默效率分别为(45.60±1.41)%、(58.20±1.63)%、(48.40±1.73)%和(49.30±1.57)%,均高于空白对照组(0%)和阴性对照组(1.50%±0.38%) (P < 0.05) (表 2)。其中靶向sh-catu2对α-catulin基因的沉默效应最高。
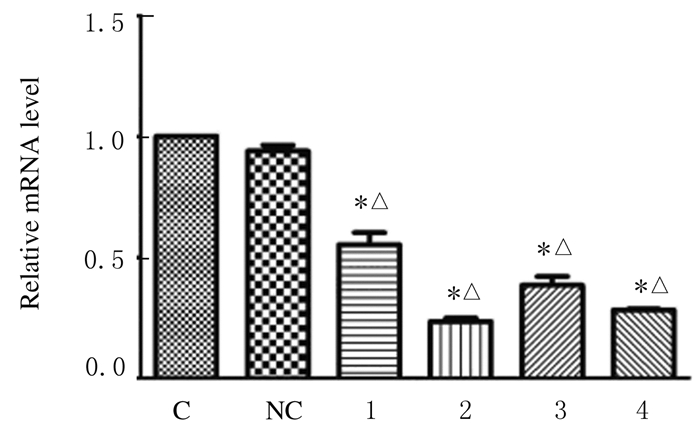
|
| C:Blank control group;NC:Negative control group;1-4:Transfection groups(transfected with sh-catu1,sh-catu2,sh-catu3, and sh-catu4,respectively). * P < 0.05 vs blank control group; △P < 0.05 vs negative control group. 图 3 RT-PCR法检测各组TSCCA细胞中α-catulin mRNA的相对表达水平 Fig.3 Relative expression levels of α-catulin mRNA in TSCCA cells in various groups detected by RT-PCR method |
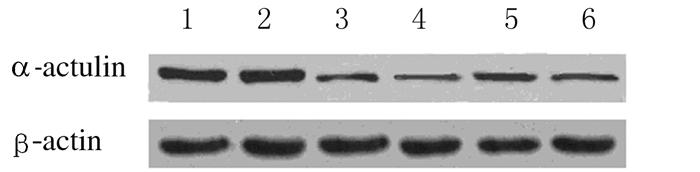
|
| Lane 1:Control group;Lane 2:Negative control group;Lane 3-6:Treatment group(TSCCA cells transfected with sh-catu1,sh-catu2,sh-catu3,and sh-catu4,respectively). 图 4 Western blotting法检测各组TSCCA细胞中α-catulin 蛋白相对表达的电泳图 Fig.4 Electrophoregram of relative expression of α-catulin protein in TSCCA cells in various groups detected by Western blotting method |
| (x±s) | ||||
| Group | α-catulin mRNA | α-catulin protein | ||
| 2-△△CT | Silencing efficiency(η/%) | Relative gray value | Silencing efficiency(η/%) | |
| Blank control | 1 | 0 | 1.488±0.134 | 0 |
| Negative control | 0.950±0.038 | 5.00±0.25 | 1.466±0.129 | 1.50±0.38 |
| Transfection | ||||
| Sh-catu1 | 0.568±0.074*△ | 43.20±1.32*△ | 0.809±0.076*△ | 45.60±1.41*△ |
| Sh-catu2 | 0.230±0.020*△ | 77.00±1.78*△ | 0.622±0.053*△ | 58.20±1.63*△ |
| Sh-catu3 | 0.373±0.052*△ | 62.70±1.53*△ | 0.769±0.067*△ | 48.40±1.73*△ |
| Sh-catu4 | 0.275±0.010*△ | 72.50±1.69*△ | 0.755±0.062*△ | 49.30±1.57*△ |
| * P < 0.05 vs blank control group; △ P < 0.05 vs negative control group. | ||||
由于TSCC具有快速局部侵润、早期颈部淋巴结转移和高复发率等特点,所以TSCC比其他头颈部鳞癌(HNSCC)更具危险性。近些年来,虽然手术及放化疗的疗效不断提高,但患者预后仍较差[10]。因此基因的靶向治疗已经成为了肿瘤治疗的一种新途径。肿瘤的发生是基于基因水平的癌基因的过度激活和(或)抑癌基因的失活或突变,所以,可利用RNA干扰(RNAi)技术沉默过度激活的癌基因,恢复细胞的正常生长表型,从而达到抑制肿瘤发生发展的目的。
α-catulin是一种新发现的癌基因,其促进肿瘤发生发展的作用机制尚不完全清楚。目前研究者[11]认为:敲除癌细胞中的α-catulin基因可激活野生型或突变型p53,从而触发DNA损伤反应,最终诱发体外细胞的衰老及抑制肿瘤的形成。α-catulin下调上皮钙黏蛋白(E-cadherin)的表达,通过上皮-间质转化(EMT)在恶性肿瘤的侵袭及转移过程中起到重要作用。此外,高表达的 α-catulin可使基质金属蛋白酶9(MMP-9)表达水平升高,激活Rho /Rock,从而促进肿瘤的侵袭转移[12]。淋巴增强因子1(lymphoid enhancer factor-1,LEF-1)与细胞生长、变异及凋亡有密切关联。LEF-1能够调控CTNNAL1的表达,表明 CTNNAL1可能在细胞生长及创口愈合中起重要作用 [13]。
RNAi是小片段RNA 分子在mRNA 水平上阻断相应基因表达的过程,即序列特异性的转录后基因沉默(PTGS)过程。RNAi技术目前已广泛用于基因功能及信号传导通路的研究,为肿瘤的基因治疗提供了实验基础。目前,实现RNAi较常用的是化学合成siRNA法及shRNA表达载体法。化学合成siRNA法简单但干扰效果持续时间短,shRNA表达载体法操作较难但干扰效果较siRNA法持久。研究[14, 15]表明:与腺病毒、腺相关病毒等其他表达载体比较,慢病毒介导的RNAi载体能够实现对靶基因的长期而稳定的沉默。但慢病毒表达载体具有实验周期长及对实验人员要求高等特点。因此,本研究选择α-catulin-shRNA 质粒表达载体来建立沉默的细胞模型。
目前,a-catulin基因与OSCC关系的研究尚少见。研究者[16, 17]发现:在TSCC组织中,随着α-catulin蛋白阳性表达率增高,E-cadherin蛋白阳性表达率明显下降,二者呈负相关关系。
本实验成功构建了沉默α-catulin的TSCCA细胞模型,为后续的α-catulin基因功能研究提供了一个全新可操作的细胞模型,有助于揭示α-catulin基因在TSCC发生发展过程中的作用,进一步阐明TSCC的发病机制,同时为TSCC的基因治疗开拓了一个新的潜在靶点。
| [1] | Zou L,Liu TR,Yang AK.Metabolic syndrome is associated with better prognosis in patients with tongue squamous cell carcinoma[J].Chin J Cancer,2015,34(4):184-188. |
| [2] | Ling W,Mijiti A,Moming A.Survival pattern and prognostic factors of patients with squamous cell carcinoma of the tongue:A retrospective analysis of 210 cases[J].J Oral Maxillofac Surg,2013,71(4):775-785. |
| [3] | Sano D,Myers JN.Metastasis of squamous cell carcinoma of the oral tongue[J].Cancer Metastasis Rev,2007,26(3/4):645-662. |
| [4] | Janssens B,Staes K,van Roy F.Human α-catulin,a novel α-catenin-like molecule with conserved genomic structure,but deviating alternative splicing[J].Biochim Biophys Acta,1999,1447(2):341-347. |
| [5] | Merdek KD,Nguyen NT,Toksoz D.Distinct activities of the α-Catenin family,α-Catulin and α-Catenin,on β-Catenin-Mediated signaling[J].Mol Cel Biol,2004,24(6):2410-2422. |
| [6] | Kreiseder B,Holper-Schichl YM,Muellauer B,et al.Alpha-Catulin Contributes to Drug-Resistance of Melanoma by Activating NF-κB and AP-1[J].PLoS One,2015,10(3):e0119402. |
| [7] | Wiesner C,Winsauer G,Resch U,et al.Alpha-Catulin,a Rho signalling component,can regulate NF-κB through binding to IKK-β,and confers resistance to apoptosis[J].Oncogene,2008,27(15):2159-2169. |
| [8] | Pei Y,Tuschl T.On the art of identifying effective and specific siRNAs[J].Nat Methods,2006,3(9):670-676. |
| [9] | Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative CT method [J].Nat Protoc,2008,3(6):1101-1108. |
| [10] | Yan G,Zou R,Chen Z,et al.Silencing RhoA inhibits migration and invasion through Wnt/β-catenin pathway and growth through cell cycle regulation in human tongue cancer[J].Acta Biochim Biophys Sin(Shanghai),2014,46(8):682-690. |
| [11] | Fan LC,Chiang WF,Liang CH,et al.a-Catulin knockdown induces senescence in cancer cells [J].Oncogene,2011,30(23):2610-2621. |
| [12] | Kreiseder B,Orel L,Bujnow C,et al.a-Catulin downregulates E-cadherin and promotes melanoma progression and invasion[J].Int J Cancer,2013,132(3):521- 530. |
| [13] | Xiang Y,Qin XQ,Liu HJ,et al.Identification of transcription factors regulating CTNNAL1 expression in human bronchial epithelial cells[J].PLoS One,2012,7(2):e31158. |
| [14] | Scherr M,Eder M.Gene transfer into hematopoietic stem cells using lentiviral vectors[J].Cur Gene Ther,2002,2(1):45-55. |
| [15] | Nishitsuji H,Ikeda T,Miyoshi H,et al.Expression of small hairpin RNA by lentivirus-based vector confers efficient and stable gene-suppression of HIV-1 on human cells including primary non-dividing cells[J].Microbes Infect,2004,6(1):76-85. |
| [16] | 史 毅,吴伟忠,金晓红,等.α-catulin和E-cadherin在舌鳞状细胞癌组织中的表达及其临床意义[J].吉林大学学报:医学版,2014. |
| [17] | 王晓峰,孔晨飞,王 伟,等.Syndecan1慢病毒干涉质粒的构建及其对舌鳞癌CAL27细胞增殖的影响[J].中国实验诊断学,2015,19(9):1447-1449. |
 2016, Vol. 42
2016, Vol. 42


