扩展功能
文章信息
- 韩玲娜, 王春雷, 张莉
- HAN Lingna, WANG Chunlei, ZHANG Li
- 外侧缰核中5-HT2C受体在帕金森病模型大鼠焦虑行为中的调节作用及其机制
- Regulatory effects of 5-HT2C receptors in lateral habenular nucleus on anxiety behaviors in rat models of Parkinson's disease and their mechanisms
- 吉林大学学报(医学版), 2016, 42(03): 473-480
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 473-480
- 10.13481/j.1671-587X.20160311
-
文章历史
- 收稿日期: 2015-10-29
2. 长治医学院生物医学工程系, 山西 长治 046000;
3. 西安交通大学医学部生理学与病理生理学系, 陕西 西安 710061
2. Department of Bioengineering, Changzhi Medical College, Changzhi 046000, China;
3. Department of Physiology and Pathophysiology, School of Medical Sciences, Xi'an Jiaotong University, Xi'an 710061, China
帕金森病(Parkinson’s disease,PD)是一种以黑质致密部(substantia nigrapars compacta,SNc)多巴胺(dopamine,DA)能神经元变性缺失为主要病理改变的神经系统退行性疾病。临床症状以静止性震颤、肌强直和运动迟缓等运动障碍为主,同时伴有一系列非运动系统症状,如焦虑、抑郁和认知功能障碍,其出现甚至早于运动症状,严重影响患者的生活质量,其中焦虑已经成为PD的危险因素之一[1, 2]。研究[3]证明:黑质-纹状体通路变性可导致脑内5-羟色胺(5-hydroxytryptamine,5-HT)递质系统发生改变,包括5-HT能神经元的缺失、5-HT递质水平的下降和5-HT受体表达的变化等。而5-HT递质系统功能紊乱与焦虑行为的产生有密切关联。外侧缰核(lateral habenular nucleus,LHb)作为上丘脑的重要组成核团,是联系边缘系统和中脑的重要枢纽。研究[4, 5, 6]表明:LHb的过度活动可诱发应激条件下焦虑行为的产生,而抑制LHb的活动可以产生抗焦虑效应。LHb接受中缝中核(median raphe nucleus,MRN)的5-HT能纤维支配,且表达丰富的5-羟色胺2C(5-HT2C)受体[7]。目前5-HT2C受体在焦虑等精神障碍类疾病中发挥的作用得到研究者的关注,研究[8, 9]显示:5-HT2C受体的激活参与了单次延长应激模型焦虑行为的产生,且5-HT2C受体拮抗剂SB242084在高架十字迷宫(elevated plus maze,EPM)和社会干预实验中表现出抗焦虑效应。本研究以PD模型大鼠为研究对象,通过在大鼠LHb中局部微量注射5-HT2C受体激动剂或拮抗剂,观察大鼠焦虑行为的变化以及边缘相关脑区单胺类递质水平的变化,阐明LHb中5-HT2C受体在PD相关焦虑行为中发挥的作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器实验选用雄性成年SD大鼠126只,体质量250~300 g,由西安交通大学实验动物中心提供,动物许可证号:SCXK(陕)2012-003。地昔帕明、阿扑吗啡(apomorphine,APO)、6-羟多巴胺(6-hydroxydopamine,6-OHDA)、Ro60-0175(选择性5-HT2C受体激动剂)和SB242084(选择性5-HT2C受体拮抗剂)均购自美国Sigma公司。地昔帕明溶解于生理盐水,6-OHDA和APO均溶解于含0.02%抗坏血酸的生理盐水中,Ro60-0175和SB242084均溶解于含50%二甲基亚砜的生理盐水中。所有药物均于实验当天配置。动物脑立体定位仪购自日本Narishige公司,冰冻切片机购自美国Thermo Scientific公司,数码摄像机购自日本Sony公司,生物显微镜及图像采集分析软件购自日本Olympus公司。
1.2 实验分组和PD模型的建立大鼠在标准环境下饲养。实验严格执行西安交通大学实验动物使用相关规定。大鼠被随机分为假手术组和SNc损毁组,每组各63只。采用右侧SNc注射6-OHDA建立单侧完全损毁的PD大鼠模型。大鼠经水合氯醛(400 mg·kg-1腹腔注射)麻醉后,将其头部固定于脑立体定位仪上。为了保护去甲肾上腺素(noradrenaline,NA)能神经元,于术前30 min腹腔注射地昔帕明(25 mg·kg-1)。根据大鼠脑立体定位图谱确定右侧SNc坐标(AP:-5.1 mm;L:2.0 mm;D:7.2~7.4 mm)。以缓慢速度将4 μL 6-OHDA溶液(2 g·L-1)注射至右侧SNc。假手术组大鼠注射等量的含0.02%抗坏血酸的生理盐水,其他操作同损毁组大鼠。
模型检测于术后1周进行,采用APO诱导的旋转实验。大鼠颈部皮下注射APO(0.05 mg·kg-1),观察15 min内大鼠的行为,若大鼠出现向健侧(左侧)旋转的行为,且大于20圈/5 min,则为造模成功[10]。本实验所用损毁大鼠旋转圈数均大于25圈/5 min。
1.3 LHb导向套管埋置SNc损毁2周后,对2组大鼠行LHb导向套管埋置术。大鼠经水合氯醛麻醉后固定于脑立体定位仪上。根据大鼠脑立体定位图谱确定右侧LHb坐标(AP:-3.7 mm;L:0.7 mm;D:4.5 mm)。将不锈钢套管(长1.8 mm,直径0.6 mm)缓慢推进至距LHb中心上方1 mm的位置。采用牙科水泥将套管固定于颅骨表面,为防止套管内堵塞,将备好的不锈钢内芯插入套管内。术后恢复1周。
1.4 给药方法行为学检测前10 min,拔出套管内芯,将1 μL微量注射器经套管插入LHb中,通过套管向2组大鼠右侧LHb缓慢注射含50%二甲基亚砜的生理盐水(溶媒组,剂量0.3 μL)、Ro60-0175(Ro60-0175组,剂量0.3 μL ,浓度50 g·L-1)或SB242084(SB242084组,剂量0.3 μL ,浓度1.7 g·L-1)。对于需要联合注射药物(SB242084+Ro60-0175组)的大鼠,需先向LHb注射SB242084(剂量0.3 μL ,浓度1.7 g·L-1),注射完毕,停留5 min,再向LHb注射Ro60-0175(剂量0.3 μL ,浓度50 g·L-1)。
1.5 大鼠行为学检测行为学检测于SNc损毁后第4周进行,所有实验均在安静环境中开始,检测时间为上午8:00~11:00,整个过程用数码摄像机记录。
1.5.1 旷场实验检测大鼠自发运动能力和焦虑行为旷场实验可用来评价6-OHDA损毁和药物对大鼠自发运动能力的影响[11]。实验时将大鼠置于旷场中央,记录5 min内大鼠的穿行格数(水平运动能力)和站立次数(垂直运动能力)。此外,大鼠在旷场的中央区停留时间也可用来反映大鼠的焦虑行为[12]。计算大鼠在中央区停留时间百分比,该值降低标志着焦虑样行为的出现。为了检测6-OHDA损毁和LHb核团内给药对大鼠运动能力和焦虑行为的影响,2组大鼠随机分为以下4个亚组(自发运动能力检测时n = 12,焦虑行为检测时n = 10):溶媒组、Ro60-0175组、SB242084组和SB242084+Ro60-0175组。
1.5.2 EPM实验检测大鼠焦虑行为EPM实验用于大鼠焦虑行为的检测[11, 13]。实验开始时将大鼠面向开放臂置于中央区,记录5 min内大鼠进入开放臂和闭合臂的次数和停留时间。通过进入开放臂次数百分比[开放臂进入次数/(开放臂+闭合臂进入次数)×100%]和开放臂停留时间百分比[开放臂停留时间/(开放臂+闭合臂停留时间)×100%]2个参数反映大鼠的焦虑行为,进入开放臂次数百分比和停留时间百分比降低标志着出现焦虑样反应[11, 13]。同样,为了检测6-OHDA损毁及LHb核团内给药对大鼠焦虑行为的影响,2组大鼠随机分为以下4个亚组(n = 10):溶媒组、Ro60-0175组、SB242084组和SB242084+Ro60-0175组。
1.6 大鼠脑组织中单胺类递质水平测定SNc损毁后第4周,采用高效液相色谱-电化学检测法(high performance liquid chromatography with electrochemical detection,HPLC-ED)分别检测2组大鼠内侧前额叶皮层(medial prefrontal cortex,mPFC)、杏仁核和海马(n = 8)中DA、5-HT和NA的水平。为检测LHb中5-HT2C受体的激活对边缘相关脑区中3种递质水平的影响,通过套管向LHb局部注射溶媒或Ro60-0175(因此分为假手术组、损毁组、假手术+Ro60-0175组和损毁+Ro60-0175组),药物剂量同行为学实验,给药10 min后,迅速断头取脑,在冰台上分离mPFC、杏仁核和海马,分别称质量,按每4 mg组织加1 mL 0.3 mol·L-1高氯酸的比例向组织中加入相应体积的高氯酸,再使用超声粉碎仪将组织匀浆,4℃低温离心(15000 r·min-1、15 min),取上清液按1:2比例与流动相混匀后,吸取20 μL样品放入自动进样器中,通过分析柱将单胺类递质分离,再经电化学检测器定量分析,最后显示储存于软件工作站中。通过标准品的标准曲线确定线性方程,根据出峰时间确定递质种类,曲线下面积定量各种递质水平,通过线性方程计算各种递质水平。
1.7 组织学和免疫组织化学染色行为学检测后,大鼠深度麻醉,经心脏灌注取脑,冰冻连续冠状切片,片厚25 μm,用于以下染色:①尼氏染色用于观察LHb基本结构和套管位置;②酪氨酸羟化酶(tyrosine hydroxylase,TH)免疫组织化学染色用于确认6-OHDA损毁后SNc的DA能神经元的丢失程度。2种染色具体方法如文献[10]所述。
1.8 统计学分析采用SPSS 17.0统计软件进行数据分析。旷场实验中的大鼠穿行格数、站立次数和中央区停留时间百分比,EPM实验中大鼠进入开放臂次数百分比和开放臂停留时间百分比,各种递质水平以及TH染色中DA能神经元的数目均以x±s表示。行为学实验数据分析采用双因素方差分析,验后多重比较采用Bonferroni’s检验;2组大鼠脑组织中单胺类递质水平的比较及给药前后递质水平的比较采用独立样本t检验;TH染色中损毁侧与未损毁侧DA能神经元数目的比较采用配对t检验。以α= 0.05为检验水准。
2 结果 2.1 各组大鼠的自发运动能力与假手术组比较,SNc损毁组大鼠的水平运动(穿行格数)和垂直运动能力(站立次数)明显降低(减少)(水平运动:F1,88 = 244.734,P < 0.001;垂直运动:F1,88 = 67.292,P < 0.001)。与各自溶媒组比较,Ro60-0175、SB242084和SB242084+Ro60-0175组大鼠运动能力均未发生变化。见表 1。
| (n=12,x±s) | ||
| Group | Number of crossed squares | Number of rearings |
| Shamoperation | ||
| Vehicle | 80.33±7.46 | 18.80±2.04 |
| Ro60-0175 | 78.50±7.18 | 18.41±1.50 |
| SB242084 | 72.75±7.58 | 17.83 ±1.85 |
| SB242084+Ro60-0175 | 82.83±7.98 | 14.58 ±1.62 |
| SNc lesion | ||
| Vehicle | 18.67±2.44* | 8.33±1.16* |
| Ro60-0175 | 17.33±2.61 | 8.75±1.45 |
| SB242084 | 16.25±2.32 | 8.33±1.32 |
| SB242084+Ro60-0175 | 14.17±2.23 | 9.17±0.94 |
| *P < 0.001 vs sham operation group. | ||
SNc损毁(F1,72 = 38.678,P < 0.001)和LHb局部给药(F3,72=10.599,P < 0.001)均改变了大鼠中央区停留时间百分比。假手术组和SNc损毁组大鼠中,与各自溶媒组比较,Ro60-0175组大鼠中央区停留时间百分比明显降低(假手术组:P < 0.01;SNc损毁组:P < 0.05),SB242084组大鼠中央区停留时间百分比无明显变化。SB242084+Ro60-0175组大鼠中央区停留时间百分比高于Ro60-0175组(假手术组:P < 0.01;损毁组:P < 0.01)。见表 2。
| (n=10,x±s,η/%) | |
| Group | Percentage of time spending in center region |
| Sham operation | |
| Vehicle | 4.93±0.58 |
| Ro60-0175 | 3.04±0.38△△ |
| SB242084 | 5.11±0.58 |
| SB242084+Ro60-0175 | 5.12±0.52# |
| SNc lesion | |
| Vehicle | 2.83 ±0.35* |
| Ro60-0175 | 1.28 ±0.11△ |
| SB242084 | 3.11±0.42 |
| SB242084+Ro60-0175 | 3.47±0.26# |
| *P < 0.01 vs sham operation group;△P < 0.05,△△ P < 0.01 vs vehicle group;# P < 0.01 vs Ro60-0175 group. | |
SNc损毁(F1,72 = 59.077,P < 0.001)和LHb局部给药(F3,72=7.284,P < 0.001)均改变了大鼠开放臂进入次数百分比。在假手术组和SNc损毁组大鼠中,与各自溶媒组比较,LHb局部给予Ro60-0175明显降低了大鼠开放臂进入次数百分比(假手术组:P < 0.01;SNc损毁组:P < 0.05),而局部给予SB242084并未影响大鼠开放臂进入次数百分比。SB242084+Ro60-0175组大鼠开放臂进入次数百分比高于Ro60-0175组(假手术组:P < 0.05;SNc损毁组:P < 0.05)。见表 3。
| (n=10,x±s,η/%) | ||
| Group | Percentage of number of open arm entries | Percentage of time of open arm staying |
| Sham operation | ||
| Vehicle | 35.98±4.16 | 39.00±2.59 |
| Ro60-0175 | 22.20±3.23△△ | 23.40±1.68△△△ |
| SB242084 | 33.00±3.94 | 39.80±3.90 |
| SB242084+Ro600175 | 34.30±4.39# | 34.80±3.45# |
| SNc lesion | ||
| Vehicle | 17.84±2.37* | 17.67±3.05* |
| Ro60-0175 | 6.10±1.38△ | 7.40±1.86△ |
| SB242084 | 16.70±2.19 | 18.30±3.42 |
| SB242084+Ro600175 | 17.40±1.42# | 18.60±2.40# |
| *P < 0.01 vs sham operation group;△P < 0.05,△△ P < 0.01 vs vehicle group;#P < 0.05 vs Ro60-0175 group. | ||
SNc损毁(F1,72 = 84.245,P < 0.001)和LHb局部给药(F3,72=9.778,P < 0.001)均改变了大鼠开放臂停留时间百分比。在假手术组SNc和损毁组大鼠中,与各自溶媒组比较,LHb局部给予Ro60-0175明显降低了大鼠开放臂停留时间百分比(假手术组:P < 0.001;SNc损毁组:P < 0.05),而局部给予SB242084并未影响大鼠开放臂停留时间百分比。 SB242084+Ro60-0175组大鼠开放臂停留时间百分比高于 Ro60-0175组 (假手术组:P < 0.05;损毁组:P < 0.05)。见表 3。
2.3 各组大鼠边缘相关脑区中单胺类递质水平与假手术组比较,SNc损毁组大鼠损毁侧mPFC、杏仁核和海马中DA水平均明显降低(mPFC:P < 0.01;杏仁核:P < 0.01;海马:P < 0.05),而5-HT和NA水平均无明显变化。见表 4。
| [n=8,x±s,wB/(ng·g-1)] | |||
| Group | DA | ||
| mPFC | Amygdala | Hippocampus | |
| Sham operation | 283.99±30.59 | 1533.27±278.50 | 111.36±26.87 |
| SNc lesion | 152.54±17.62** | 583.35±105.54** | 32.11±4.54* |
| *P < 0.05,** P < 0.01 vs sham operation group. | |||
在mPFC,2组大鼠给予Ro60-0175后,3种递质水平均明显降低(假手术组:DA,P < 0.01;5-HT,P < 0.05;NA,P < 0.01;SNc损毁组:DA,P < 0.01;5-HT,P < 0.05;NA,P < 0.05);在杏仁核中,局部给予Ro60-0175后,除5-HT水平明显变化外,其余2种递质水平均明显下降(假手术组:DA,P < 0.05;NA,P < 0.001;SNc损毁组:DA,P < 0.01;NA,P < 0.05);在海马中,局部给予Ro60-0175后,除假手术组大鼠NA水平未发生改变外,其余均明显下降(假手术组:DA,P < 0.05;5-HT,P < 0.05;SNc损毁组:DA,P < 0.01;5-HT,P < 0.05;NA,P < 0.05)。见表 5。
| [n=7,x±s,wB/(ng·g-1)] | ||||||
| Group | DA | 5-HT | ||||
| mPFC | Amygdala | Hippocampus | mPFC | Amygdala | Hippocampus | |
| Shamoperation | 266.76±31.47 | 1 562.84±310.38 | 117.43±30.22 | 625.23±81.55 | 685.56±61.07 | 506.47±44.14 |
| Sham+Ro60-0175 | 132.47±22.86** | 787.70±59.32* | 38.60±6.39* | 338.37±58.18* | 493.56±114.52 | 348.91±54.28* |
| SNc lesion | 152.87±21.76 | 630.64±108.94 | 36.83±5.13 | 501.46±53.79 | 525.96±55.98 | 496.04±60.16 |
| SNc lesion+Ro60-0175 | 68.77±6.12△ | 154.94±85.08△△ | 18.39±2.62△△ | 364.63±31.23△ | 426.46±44.64 | 311.8±19.57△ |
| Group | NA | |||||
| mPFC | Amygdala | Hippocampus | ||||
| Shamoperation | 734.51±53.60 | 1 711.10±196.69 | 671.59±109.86 | |||
| Sham+Ro60-0175 | 443.16±68.01** | 604.34±81.68** | 548.26±89.46 | |||
| SNc lesion | 457.34±36.62 | 469.84±72.94 | 461.30±39.72 | |||
| SNc lesion+Ro60-0175 | 291.20±51.06△ | 251.27±60.68△△ | 281.81±69.13△ | |||
| * P < 0.05,** P < 0.01 vs sham operation group;△ P < 0.05,△△ P < 0.01 vs SNc lesion group. | ||||||
套管位置尼氏染色图片示:套管尖端位于LHb上方1 mm(图 1A)。假手术和SNc损毁组大鼠SNc的TH免疫组织化学染色图片示:假手术组大鼠两侧SNc和腹侧被盖区(ventral tegmental area,VTA)的DA能神经元数目未发生明显变化,见图 1B;SNc损毁组大鼠损毁侧(右侧)SNc中DA能神经元完全缺失,且损毁侧VTA的DA能神经元数目也较未损毁侧(左侧,100%)明显减少,仅为未损毁侧的(49±8)%(P < 0.001),见图 1C。
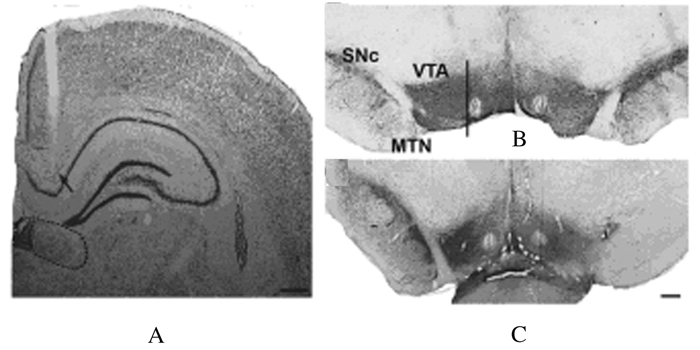
|
| A:Cannula site (arrow) and structure of LHb (dotted circle)(×40); B and C: DA neurons in SNc and VTA of rats in sham operation and SNc lesion groups (bar=400 μm).MTN:Medial terminal nucleus of the accessory. 图 1 套管位置尼氏染色图(A)和大鼠SNc的 TH免疫组织化学染色图(B,C) Fig.1 Photomicrograph of Nissl staining of cannula site(A) and TH immunohistochemical staining photos of SNc (B,C) |
本研究中,6-OHDA单侧损毁SNc后,大鼠的自发运动能力明显下降,这与之前的研究[14]结果一致,表明黑质-纹状体通路的损毁可引起大鼠运动能力的下降。而假手术组和损毁组大鼠LHb中局部注射Ro60-0175或SB242084后,大鼠的自发运动能力未出现明显变化,表明Ro60-0175或SB242084在焦虑行为检测中所产生的效应与大鼠的运动能力无直接关系,排除了运动能力对行为学检测结果的影响。
焦虑是常见于PD的一种非运动系统症状。关于PD模型大鼠是否出现焦虑行为,不同的研究结果不同。有研究[15, 16]显示:单侧PD模型大鼠在社会干预实验和EPM中的焦虑行为增加;还有研究[17, 18]显示:PD模型大鼠在行为学检测中不具有焦虑行为的增加。出现不同结果可能与多种因素有关联,如损毁程度的不同、注射部位的不同、单侧还是双侧损毁以及进行行为学检测的时间点是否相同等。本研究中,SNc单侧损毁后,大鼠在旷场实验和EPM实验中的焦虑行为均明显增加,提示6-OHDA单侧损毁SNc可以诱发大鼠的焦虑行为。
LHb的活动与焦虑行为之间关系密切。LHb的过度活动可诱发焦虑行为的出现[4],而电损毁大鼠LHb后产生抗焦虑效应[5],LHb中局部给予γ-氨基丁酸受体激动剂后可减轻由 NA的α2受体拮抗剂 育亨宾导致的焦虑行为[6]。LHb发出纤维支配缝核、SNc、VTA和胆碱能神经元密集的网状结构,可以通过调节这些区域5-HT、DA以及乙酰胆碱等神经递质的释放,从而影响大鼠的焦虑行为 [19, 20, 21]。已经证明PD状态下,大鼠LHb的电活动增强[14],这是导致PD模型大鼠出现焦虑行为的原因之一。研究[22, 23]显示:动物的焦虑行为与中枢神经系统中单胺类递质水平的变化有关联。本研究结果显示:与假手术组比较,SNc损毁组大鼠mPFC、杏仁核和海马中DA水平明显下降,说明DA水平降低是导致焦虑行为出现的使动因素。
MRN发出5-HT能纤维支配LHb的活动,LHb中表达有丰富的5-HT2C受体。已经证明 5-HT2C受体的激活参与了单次延长应激模型焦虑行为的产生[8, 9],5-HT2C受体拮抗剂SB242084在EPM和社会干预实验中表现出抗焦虑效应。5-HT2C受体已经成为治疗焦虑行为的一个潜在靶点。关于LHb中5-HT2C受体对PD大鼠焦虑行为调节作用的相关研究目前尚未见报道。本研究中,LHb中局部给予5-HT2C受体激动剂Ro60-0175后,2组大鼠中央区停留时间百分比、开放臂进入次数百分比和停留时间百分比均明显降低,提示LHb中5-HT2C受体的激活可以诱发和增强大鼠的焦虑行为;而局部给予5-HT2C受体拮抗剂SB242084后,2组大鼠焦虑行为未见明显改变;但预先给予5-HT2C受体拮抗剂SB242084可以阻断Ro60-0175的效应,进一步说明Ro60-0175是通过5-HT2C受体发挥作用的。
单胺类递质系统紊乱涉及情感障碍的发生发展,包括焦虑与抑郁等[24]。研究[25, 26]表明:大鼠在EPM实验中的焦虑行为与mPFC中的DA水平呈负相关关系,抗焦虑药西酞普兰可以增加杏仁核中的DA水平。此外,在mPFC中注射5,7-双羟色胺耗竭其中82%的5-HT后,可以增加大鼠的焦虑行为[27],这也进一步提示mPFC中5-HT水平的升高可能产生一定的抗焦虑效应[28]。然而,关于激活LHb中5-HT2C受体对边缘相关脑区中单胺类递质水平的影响目前尚未见相关报道。本研究结果显示:LHb中5-HT2C受体的激活可以导致mPFC、杏仁核和海马中的3种单胺类递质水平降低。LHb发出谷氨酸能投射纤维至VTA、SNc和缝核,通过调节其中的GABA能中间神经元的活动而对其中的DA和5-HT能神经元发挥间接抑制作用,故LHb的活动增强可以抑制脑内DA和5-HT的释放[29]。此外,LHb间接影响蓝斑的活动。LHb中局部给予5-HT2C受体激动剂Ro60-0175后,通过兴奋其中的谷氨酸能神经元的活动[14],使其对DA、5-HT及NA的负性调控作用增强,从而调节应激、恐惧刺激引起的焦虑行为,表现为诱导或增强焦虑行为的作用。因此,本文作者认为:激活LHb中5-HT2C受体表现出的诱发或增强大鼠的焦虑行为是由LHb中谷氨酸能神经元的过度活动及边缘相关脑区单胺类递质水平下降导致的。至于LHb中局部注射5-HT2C受体拮抗剂SB242084后大鼠的焦虑行为无明显改变,可能是由于5-HT2C受体在LHb中并未参与内源性5-HT对焦虑行为的调节作用。
本研究结果显示:SNc单侧完全损毁可诱发大鼠出现焦虑行为,LHb中5-HT2C受体的激活可诱发假手术组大鼠的焦虑行为,并且增强损毁组大鼠的焦虑行为。这些结果提示SNc损毁及LHb中5-HT2C受体的激活对大鼠焦虑行为的影响可能与LHb中谷氨酸能神经元活动发生变化、最终导致边缘相关脑区中单胺类递质水平改变有关联。
| [1] | Prediger RD,Matheus FC,Schwarzbold ML,et al.Anxiety in Parkinson'disease:a critical review of experimental and clinical studies [J].Neuropharmacology,2012,62 (1):115-124. |
| [2] | Shiba M,Bower JH,Maraganore DM,et al.Anxiety disorders and depressive disorders preceding Parkinson's disease:a case-control study [J].Mov Disord,2000,15 (4):669-677. |
| [3] | Scholtissen B,Verhey FRJ,Steinbusch HWM,et al.Serotonergic mechanisms in Parkinson's disease:opposing results from preclinical and clinical data [J].J Neural Transm,2006,113 (1):59-73. |
| [4] | Stamatakis AM,Stuber GD.Activation of lateral habenula inputs to the ventral midbrain promotes behavioral avoidance [J].Nat Neurosci,2012,15 (8):1105-1107. |
| [5] | Pobbe RL,Zangrossi H Jr.Involvement of the lateral habenula in the regulation of generalized anxiety- and panic-related defensive responses in rats [J].Life Sci,2008,82 (25/26):1256-1261. |
| [6] | Gill MJ,Ghee SM,Harper SM,et al.Inactivation of the lateral habenula reduces anxiogenic behavior and cocaine seeking under conditions of heightened stress [J].Pharmacol Biochem Behav,2013,111:24-29. |
| [7] | Clemett DA,Punhani T,Duxon MS,et al.Immunohistochemical localisation of the 5-HT2C receptor protein in the rat CNS [J].Neuropharmacology,2000,39 (1):123-132. |
| [8] | Harada K,Yamaji T,Matsuoka N.Activation of the serotonin 5-HT2C receptor is involved in the enhanced anxiety in rats after single-prolonged stress [J].Pharmacol Biochem Behav,2008,89 (1):11-16. |
| [9] | Martin JR,Ballard TM,Higgins GA.Influence of the 5-HT2C receptor antagonist,SB-242084,in tests of anxiety [J].Pharmacol Biochem Behav,2002,71 (4):615-625. |
| [10] | Wang S,Zhang QJ,Liu J,et al.Unilateral lesion of the nigrostriatal pathway induces an increase of neuronal firing of the midbrain raphe nuclei 5-HT neurons and a decrease of their response to 5-HT(1A) receptor stimulation in the rat [J].Neuroscience,2009,159 (2):850-861. |
| [11] | Tadaiesky MT,Dombrowski PA,Figueiredo CP,et al.Emotional,cognitive and neurochemical alterations in a premotor stage model of Parkinson's disease [J].Neuroscience,2008,156 (4):830-840. |
| [12] | Treit D,Fundytus M.Thigmotaxis as a test for anxiolytic activity in rats [J].Pharmacol Biochem Behav,1988,31(4):959-962. |
| [13] | Rodgers RJ,Dalvi A.Anxiety,defence and the elevated plus-maze [J].Neurosci Biobehav Rev,1997,21 (6):801-810. |
| [14] | Han LN,Zhang L,Li LB,et al.Activation of serotonin2C receptors in the lateral habenular nucleus increases the expression of depression-related behaviors in the hemiparkinsonian rat [J].Neuropharmacology,2015,93(1):68-79. |
| [15] | Eskow Jaunarajs KL,Dupre KB,Ostock CY,et al.Behavioral and neurochemical effects of chronic L-DOPA treatment on nonmotor sequelae in the hemiparkinsonian rat [J].Behav Pharmacol,2010,21 (7):627-637. |
| [16] | Jungnickel J,Kalve I,Reimers L,et al.Topology of intrastriatal dopaminergic grafts determines functional and emotional outcome in neurotoxin-lesioned rats [J].Behav Brain Res,2011,216 (1):129-135. |
| [17] | Carvalho MM,Campos FL,Coimbra B,et al.Behavioral characterization of the 6-hydroxidopamine model of Parkinson's disease and pharmacological rescuing of non-motor deficits [J].Mol Neurodegener,2013,8:14. |
| [18] | Delaville C,Chetrit J,Abdallah K,et al.Emerging dysfunctions consequent to combined monoaminergic depletions in Parkinsonism [J].Neurobiol Dis,2012,45 (2):763-773. |
| [19] | Speciale SG,Neckers LM,Wyatt RJ.Habenular modulation of raphe indoleamine metabolism [J].Life Sci,1980,27 (24):2367-2372. |
| [20] | Chastrette N,Pfaff DW,Gibbs RB.Effects of daytime and nighttime stress on Fos-like immunoreactivity in the paraventricular nucleus of the hypothalamus,the habenula,and the posterior paraventricular nucleus of the thalamus [J].Brain Res,1991,563 (1/2):339-344. |
| [21] | Wirtshafter D,Asin KE,Pitzer MR.Dopamine agonists and stress produce different patterns of Fos-like immunoreactivity in the lateral habenula [J].Brain Res,1994,633 (1/2):21-26. |
| [22] | Martijena ID,Lacerra C,Molina VA.Carbamazepine normalizes the altered behavioral and neurochemical response to stress in benzodiazepine-withdrawn rats [J].Eur J Pharmacol,1997,330 (2/3):101-108. |
| [23] | Millan MJ.The neurobiology and control of anxious states [J].Prog Neurobiol,2003,70 (2):83-244. |
| [24] | Ressler KJ,Nemeroff CB.Role of serotonergic and noradrenergic systems in the pathophysiology of depression and anxiety disorders [J].Depress Anxiety,2000,12 (Suppl 1):2-19. |
| [25] | Watt MJ,Burke AR,Renner KJ,et al.Adolescent male rats exposed to social defeat exhibit altered anxiety behavior and limbic monoamines as adults [J].Behav Neurosci,2009,123 (3):564-576. |
| [26] | Kitaichi Y,Inoue T,Nakagawa S,et al.Local infusion of citalopram into the basolateral amygdala decreased conditioned fear of rats through increasing extracellular serotonin levels [J].Prog Neuropsychopharmacol Biol Psychiatry,2014,54:216-222. |
| [27] | Pum ME,Huston JP,Muller CP.The role of cortical serotonin in anxiety and locomotor activity in Wistar rats [J].Behav Neurosci,2009,123 (2):449-454. |
| [28] | Muraki I.Behavioral and neurochemical study on the mechanism of the anxiolytic effect of a selective serotonin reuptake inhibitor,a selective serotonin1A agonist and lithium carbonate [J].Hokkaido Igaku Zasshi,2001,76 (2):57-70. |
| [29] | Ferraro G,Montalbano ME,Sardo P,et al.Lateral habenular influence on dorsal raphe neurons [J].Brain Res Bull,1996,41 (1):47-52. |
 2016, Vol. 42
2016, Vol. 42


