扩展功能
文章信息
- 陈静, 闫振宇, 刘志勇, 赵杰, 贺宝玲
- CHEN Jing, YAN Zhenyu, LIU Zhiyong, ZHAO Jie, HE Baoling
- 力达霉素抑制K562细胞增殖和诱导凋亡作用及其机制
- Inhibitory effect of lidamycin on cell proliferation and induction of apoptosis in human leukemia K562 cells and their mechanisms
- 吉林大学学报(医学版), 2016, 42(03): 467-472
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 467-472
- 10.13481/j.1671-587X.20160310
-
文章历史
- 收稿日期: 2015-12-11
2. 华北理工大学附属医院血液科, 河北 唐山 063000;
3. 华北理工大学附属医院心胸外科, 河北 唐山 063000
2. Department of Hematology, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Cardiothoracic Surgery, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China
慢性粒细胞白血病(chronic myeloid leukemia,CML)是一种影响骨髓正常造血功能的恶性肿瘤。CML患者骨髓中产生大量不成熟的白细胞,这些以粒细胞为主的白细胞在骨髓内无序生长、聚集,抑制骨髓的正常造血,并且通过血液在全身扩散,导致患者产生不同程度的贫血、出血、感染及器官浸润等多种临床症状。一般人群中,每10万人中有1~2人患有该病,占新增成人白血病的15%[1]。多数患者由于对传统的化疗药物产生抗药性而导致治疗失败。目前,治疗CML的唯一有效的方法是骨髓移植或异体干细胞移植,但该治疗方法具有很高的复发率和死亡率[2],其明显的毒副作用和沉重的经济负担使得患者的生活质量和治疗信心受到严重影响[3, 4]。因此寻找高效低毒的治疗药物显得尤为重要。力达霉素(lilamycin,LDM)是从一株放线菌球孢链霉菌(Streptomyces globisporus C-1027)代谢产物中获得的对多种肿瘤细胞有强烈杀伤作用的大分子肽类抗肿瘤抗生素。大量研究[5, 6, 7, 8, 9, 10]表明:LDM具有较强的抗肿瘤活性,目前正在进行临床Ⅱ期试验研究。本研究选用人CML K562细胞作为研究对象,探讨LDM对K562细胞生长的影响,为其在CML的临床治疗上提供新思路和理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人CML K562细胞由本室传代保存。LDM由中国医学科学院医药生物技术研究所甄永苏院士惠赠,RPMI-1640培养液(美国Gibco公司),胎牛血清(美国Biological公司),MTT细胞增殖检测试剂盒(南京凯基生物科技发展有限公司),台盼蓝(天根生物科技有限公司),吖啶橙/溴化乙锭(AO/EB)检测试剂盒(天津润泰科技发展有限公司),Annexin Ⅴ细胞凋亡检测试剂盒(北京宝赛生物技术有限公司),蛋白定量试剂盒(BCATM protein assay kit,美国Pierce公司),宽范围蛋白预染Marker(美国New England Biolabs公司),蛋白质印迹发光液(ECL,美国Santa Cruz公司)和PVDF膜(美国Millipore公司),兔抗人caspase-8、兔抗人caspase-3和β-actin抗体(美国Affinity公司),辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(北京中杉金桥有限公司)。Spectra Max 190酶标仪(美国Molecular Device公司),荧光显微镜(日本尼康公司),流式细胞仪(美国Coulter Electronics公司),凝胶成像仪(美国Alpha Innotech公司)。
1.2 细胞培养K562细胞从液氮中复苏后,用含10%胎牛血清的RPMI-1640培养液在37℃、5% CO2恒温培养箱中培养,所有实验均采用对数生长期细胞。
1.3 台盼蓝染色检测细胞生长抑制率细胞损伤或死亡时,台盼蓝可穿透变性的细胞膜,与解体的DNA 结合,使其着色。而活细胞能阻止染料进入细胞内而拒染,故利用台盼蓝染色可以鉴别死细胞与活细胞。采用0.01、0.10和1.00 nmol·L-1 LDM分别作用K562细胞48 h,作为0.01、0.10和1.00 nmol·L-1LDM组,不加药物的正常细胞为对照组。离心收集细胞,制备单细胞悬液并作适当稀释,细胞悬浮液与台盼蓝溶液按照9:1的比例混合均匀,光学显微镜下每组取5个不同视野,在3 min内分别计数活细胞和死细胞,计算LDM对细胞的生长抑制率。细胞生长抑制率=死细胞数 /(活细胞数+死细胞数)×100%。
1.4 MTT法检测细胞存活率取对数生长期细胞,消化计数后以每孔5 000个细胞的密度接种细胞于96孔细胞培养板中,24 h后加入不同浓度的药物处理48 h,每组至少3个平行孔。采用PBS缓冲液配成5 g·L-1 MTT溶液,每孔加入20 μL,37℃温育4 h。吸出上清液,加入150 μL DMSO,振荡10 min,使结晶物充分溶解。用酶标仪在570 nm处测定每个孔的吸光度(A)值。将各测试孔的A值减去本底A值(完全培养基加MTT,无细胞),各平行孔的A值取平均数,计算细胞的存活率。细胞存活率 =(加药组A值-本底A值)/(对照组A值-本底A值)×100%。实验重复3次。
1.5 AO/EB双荧光染色法观察凋亡细胞的形态表现AO能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。EB仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。凋亡细胞呈现为染色增强,荧光更为明亮,均匀一致的圆状或固缩状、团块状结构。非凋亡细胞核呈现荧光深浅不一的结构样特征。K562细胞经0.01、0.10和1.00 nmol·L-1 LDM分别作用48 h后,离心收集并稀释为细胞悬液,按照25:1的比例与荧光染色液混合,制作临时装片,置于荧光显微镜下观察。
1.6 Annexin Ⅴ-FITC/PI染色结合流式细胞术检测细胞凋亡率按照试剂盒说明书进行操作,采用0.01、0.10和1.00 nmol·L-1 LDM分别作用K562细胞48 h后,离心收集细胞,PBS洗2~3次,1 000 r·min-1、4℃离心10 min,弃上清,细胞重悬于150 μL Binding Buffer中,加入10 μL Annexin Ⅴ-FITC和5 μL PI,轻轻混匀,避光室温反应15 min,再加入150 μL Binding Buffer,采用流式细胞仪测定,采集荧光强度并用自带软件FACScan进行数据处理,结果以细胞凋亡率表示。
1.7 蛋白质提取和Western blotting检测离心收集不同浓度药物作用48 h及未加药处理的K562细胞,用预冷的PBS洗涤2次,加入裂解缓冲液1 mL震荡混匀,冰浴30 min。细胞裂解物在4℃、12 000 r·min-1离心5 min,收集上清液,采用BCA蛋白定量试剂盒测定蛋白表达水平。取等量蛋白样品用10%的分离胶进行SDS-PAGE聚丙烯酰胺凝胶电泳。用半干转膜仪将蛋白转移到PVDF膜上,用含5% 脱脂奶粉的TBS缓冲液(含0.05% Tween 20)封闭1 h,用TBST洗膜5次,每次5 min,加入一抗4℃孵育过夜。按上述方法洗膜,加入二抗,室温孵育2 h,洗膜后用Western印记发光液显色,通过凝胶成像系统捕获图像,并通过图像分析系统对所得区带进行扫描,比较各组的积分A值。目的条带与β-actin条带积分A值的比值即为该目的蛋白的相对表达量。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。各组K562细胞生长抑制率、存活率、凋亡率和各组细胞中蛋白相对表达量以x±s表示,组间比较采用单因素方差分析。以α= 0.05为检验水准。
2 结果 2.1 各组K562细胞生长抑制率台盼蓝染色结果:对照组细胞透明无色,死细胞呈蓝色,不同浓度LDM作用于K562细胞48 h后对其生长均有一定的影响。见图 1(插页二)。
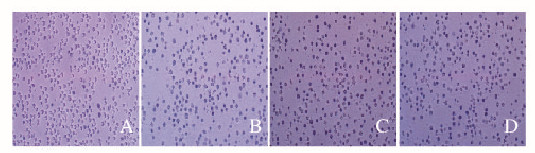
|
| 图 1 各组K562细胞形态表现(台盼蓝, ×200) Fig.1 Morphology of K562 cells in various groups (Trypan blue, ×200) |
各浓度LDM组K562细胞生长抑制率明显高于对照组,组间比较差异有统计学意义(P<0.05)。见表 1。
| (n=5,x±s,η/%) | |
| Group | Inhibitory rate of growth |
| Control | 0.00±0.00 |
| LDM(nmol·L-1) | |
| 0.01 | 37.50±0.88* |
| 0.10 | 52.10±1.24** |
| 1.00 | 64.50±1.61** |
| *P<0.05,**P<0.01vs control group. | |
不同浓度LDM作用K562细胞48 h后,随着LDM浓度的升高,细胞存活率明显降低,呈浓度-效应依赖关系。LDM对K562细胞作用的半数抑制浓度(IC50)为(0.1±3.2)nmol·L-1。见图 2。
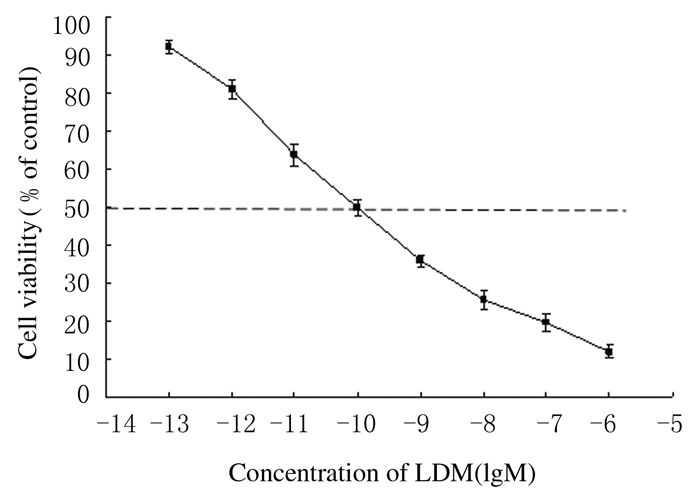
|
| 图 2 MTT法检测各组K562细胞存活率 Fig.2 Cell viabilities of K562 cells in various groups detected by MTT assay |
经AO/EB染色后,荧光显微镜下可见:①正常细胞,细胞呈圆形,核质体被均匀染成绿色,大小形状均一;②坏死细胞,细胞呈椭圆形,核质体被染为橙红色,大小形状较单一;③凋亡早期细胞,核质体呈绿色,细胞形状不规则,呈新月形;④凋亡晚期细胞,核质体呈橙红色,染色质浓缩,细胞核碎裂成点状,大小不一,可见胞质芽状突起。K562细胞经LDM处理后,细胞形状发生改变,有的胞质出现芽状突起,细胞核碎裂成点状,出现明显的凋亡细胞形态。见图 3(插页二)。
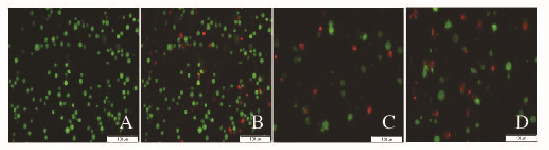
|
| 图 3 各组K562细胞凋亡形态表现(AO/EB, ×200) Fig.3 Apoptotic morphology of K562 cells in various groups (AO/EB, ×200) |
流式细胞术检测结果:K562细胞经0.01、0.10和1.00 nmol·L-1 LDM处理48 h后细胞凋亡率分别为58.69%,56.16% 和 79.20%,与对照组(0%)比较差异均有统计学意义(P<0.01)。见图 4。
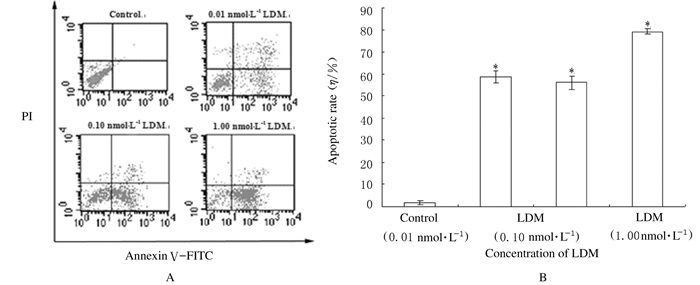
|
| *P<0.01 vs control group. 图 4 Annexin Ⅴ-FITC/PI双染(A)结合流式细胞术(B)检测各组K562细胞凋亡率 Fig.4 Apoptotic rates of K562 cells in various groups detected by Annexin Ⅴ-FITC/PI double staining method(A) and flow cytometry(B) |
与对照组比较,0.01 nmol·L-1 LDM组K562细胞中caspase-8和caspase-3蛋白相对表达量无明显变化(P>0.05),0.10和1.00 nmol·L-1 LDM组细胞中caspase-8和caspase-3蛋白相对表达量明显升高(P<0.01)。见图 5。
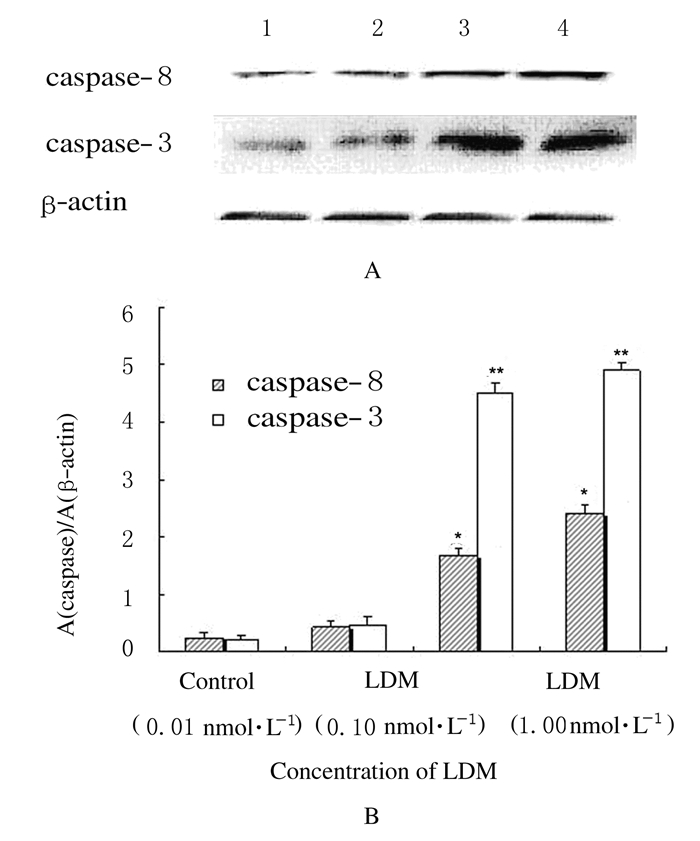
|
| A:Electrophoregram;Lane 1:Control group;Lane 2-4:0.01,0.10, and 1.00 nmol·L-1 LDM groups.B:Histogram; *P<0.01,**P<0.001 vs control group. 图 5 Western blotting法检测各组K562细胞中caspase-8和caspase-3相对表达量 Fig.5 Relative expression levels of caspase-8 and caspase-3 in K562 cells in various groups detected by Western blotting method |
CML是一类发生在造血干细胞上以粒细胞慢性增殖为主要特征的恶性克隆性疾病。该病进展缓慢,早期患者症状不明显。随着疾病的进展,白细胞破坏骨髓正常造血功能,浸润器官,引起贫血等临床症状[11]。目前针对CML的治疗方法包括化疗、免疫治疗、异体干细胞移植和分子治疗等多种手段[12],但随之产生的毒副作用和耐药性及昂贵的治疗费用给患者带来沉重精神压力和经济负担,该病也是长期困扰医学工作者的一个难题。
LDM是我国具有自主知识产权的烯二炔类抗生素,能引起核苷酸碱基和序列特异性的DNA单链和双链断裂[13]。大量研究[5, 6, 7, 8, 9, 10]证实:LDM能够引起多种肿瘤细胞发生凋亡,改变细胞周期进程,具有较强的抗肿瘤活性。本研究结果显示:LDM具有较强的抑制人CML K562细胞生长的能力,同时低浓度LDM可以诱导K562细胞发生凋亡。
肿瘤发生与细胞增殖和细胞凋亡的平衡失调有关联。细胞凋亡是细胞在内源性基因调控下的生理性细胞死亡方式,是机体清除衰老与死亡细胞的有效方式,如果细胞凋亡失去控制,则会引起细胞过度增殖或凋亡减少,从而增加细胞恶变的潜能。许多研究[14, 15, 16, 17]证实:恶性肿瘤的发生与细胞凋亡途径受到抑制有关联,而抗肿瘤药的作用机制之一即为诱导肿瘤细胞凋亡,所以诱导肿瘤细胞发生凋亡也是化疗药物治疗白血病的重要机制之一。
细胞凋亡是由于内外多因子复杂的相互作用诱导产生凋亡信号引起细胞主动死亡的过程,以核酸内切酶活化后将DNA分解为200 bp整倍数的片断DNA为主要特征。在细胞发生凋亡的过程中,半胱氨酸蛋白酶(caspase)家族在凋亡的起始和执行阶段发挥重要作用[18]。在正常的细胞内,每一种caspase都是以非活性的状态存在。当起始caspases(initiator caspases)如caspase-8和caspase-9在外来信号的作用下被切割激活,继而对执行者caspase(executioner caspases)如caspase-3、caspase-6及caspase-7进行切割并使之激活,被激活的执行者caspase通过对下游靶蛋白的水解增强核酸内切酶活性,将核内DNA有规律地降解,导致DNA片段化,引起细胞凋亡[19]。本研究结果显示:K562细胞经LDM处理后,细胞中caspase-8和caspase-3蛋白的相对表达量明显高于对照组。
本研究通过台盼蓝染色和MTT法观察LDM对人CMLK562细胞增殖的抑制作用,得到其IC50值为(0.1±3.2)nmol·L-1,提示LDM对K562细胞有极强的杀伤作用。人CMLK562细胞经0.01、0.10和1.00 nmol·L-1 LDM处理后,细胞出现核碎裂、染色质浓缩和细胞形状不规则等明显的细胞凋亡形态变化,药物处理后的细胞凋亡率亦有明显升高,这可能与LDM提高细胞中caspase-8和 caspase-3酶系的表达有关联,其详细作用机制有待于进一步深入研究。
| [1] | Jabbour E,Kantarjian H.Chronic myeloid leukemia:2012 update on diagnosis,monitoring,and management [J].Am J Hematol,2012,87(11):1037-1045. |
| [2] | Dickinson AM,Pearce KF,Norden J,et al.Impact of genomic risk factors on outcome after hematopoietic stem cell transplantation for patients with chronic myeloid leukemia [J].Haematologica,2010,95(6):922-927. |
| [3] | Rousselot P,Charbonnier A,Cony-Makhoul P,et al.Loss of major molecular response as a trigger for restarting tyrosine kinase inhibitor therapy in patients with chronic-phase chronic myelogenous leukemia who have stopped imatinib after durable undetectable disease [J].J Clin Oncol,2014,32(5):424-430. |
| [4] | Song P,Ye L,Fan J,et al.Asparaginase induces apoptosis and cytoprotective autophagy in chronic myeloid leukemia cells [J].Oncotarget,2015,6(6):3861-3873. |
| [5] | Zhen YS,Xue YC,Shao RG.Antitum activity of the new enediyne antibiotic C-1027 [J].Chin J Antib,1994,19(2):164-168. |
| [6] | Chen J,Ouyang ZG,Zhang SH,et al.Down-regulation of the nuclear factor-kappa B by lidamycin in association with inducing apoptosis in human pancreatic cancer cells and inhibiting xenograft growth [J].Oncol Rep,2007,17(6):1445-1451. |
| [7] | Zhong GS,Guo XF,Zhang SH,et al.Optimization of the assembly efficiency for lidamycin chromophore bound to its aporotein:a case study using orthogonal array [J].Biomed Environ Sci,2011,24(6):602-607. |
| [8] | Zhen HY,He QH,Zhen YZ,et al.Inhibition of mouse embryonic carcinoma cell growth by lidamycin through down-regulation of embryonic stem cell-like genes Oct 4,Sox 2 and Myc [J].Invest New Drugs,2011,29(6):1188-1197. |
| [9] | Zhang Q,Liu XJ,Hu L,et al.Factor Ⅶ light chain-targeted lidamycin targets tissue factor-over expressing tumor cells for cancer therapy [J].Int J Mol Med,2012,29(3):409-415. |
| [10] | Zhang SH,Zhang H,He HW,et al.Lidamycin up-regulates the expression of thymidine phosphorylase and enhances the effects of capecitabine on the growth and pulmonary metastases of murine breast carcinoma[J].Cancer Chemother Pharmacol,2013,72(4):777-788. |
| [11] | Deininger MW,Goldman JM,Melo JV.The molecular biology of chronic myeloid leukemia [J].Blood,2000,96(10):3343-3356. |
| [12] | von Bubnoff N,Duyster J.Chronic myelogenous leukemia treatment and monitoring [J].Dtsch Arztebl Int,2010,107(7):114-121. |
| [13] | Dziegielewski J,Beerman TA.Cellular responses to the DNA strand-scission enediyne C-1027 can be independent of ATM,ATR,and DNA-PK kinases [J].J Biol Chem,2002,277(23):20549-20554. |
| [14] | Plati J,Bucur O,Khosravi-Far R.Apoptotic cell signaling in cancer progression and therapy [J].Integr Biol (Camb),2011,3(4):279-296. |
| [15] | Mukhtar E,Adhami VM,Khan N,et al.Apoptosis and autophagy induction as mechanism of cancer prevention by naturally occurring dietary agents [J].Curr Drug Targets,2012,13(14):1831-1841. |
| [16] | Sastry KSR,Al-Muftah MA,Li P,et al.Targeting proapoptotic protein BAD inhibits survival and self-renewal of cancer stem cells [J].Cell Death Differ,2014,21(12):1936-1949. |
| [17] | Giussani P,Tringali C,Riboni L,et al.Sphingolipids:key regulators of apoptosis and pivotal players in cancer drug resistance [J].Int J Mol Sci,2014,15(3):4356-4392. |
| [18] | Chang HY,Yang X.Proteases for cell suicide:functions and regulation of caspases [J].Microbiol Mol Biol Rev,2000,64(4):821-846. |
| [19] | Zhao Y,Lei M,Wang Z,et al.TCR-induced,PKC-mediated NF-κB is regulated by a caspase-8-caspase-9-caspase-3 cascade[J].Biochem Biophys Res Commun,2014,450(1):526-531. |
 2016, Vol. 42
2016, Vol. 42


