扩展功能
文章信息
- 姚金丹, 韩光红, 胡敏
- YAO Jindan, HAN Guanghong, HU Min
- IL-17对破骨细胞中MMP-9表达水平的影响及其意义
- Effects of IL-17 on expressions of MMP-9 in osteoclasts and their significances
- 吉林大学学报(医学版), 2016, 42(03): 462-466
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 462-466
- 10.13481/j.1671-587X.20160309
-
文章历史
- 收稿日期: 2016-03-08
牙根吸收是常见的正畸治疗并发症之一[1],是一系列炎症反应和免疫反应的结果。白细胞介素17(interleukin-17,IL-17)与正畸牙根吸收密切相关,但其具体机制尚不明确[2]。IL-17是一种强大的前炎症细胞因子,能诱导某些化学趋化因子、细胞因子、基质金属蛋白酶(matrix metalloproteinase,MMP)和抗菌肽的释放[3],并可与多种细胞因子产生协同作用,放大炎症反应。IL-17被认为是正畸牙根吸收的重要调控因子,可以直接促进破骨细胞的分化[4],还可以作为核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)的诱导剂间接调控破骨细胞的分化[5],在骨质破坏活动中对破骨细胞活化和骨质吸收方面发挥重要作用。MMP-9属于MMPs家族成员,又称明胶酶B,是一种在破骨细胞中高度表达的胞外蛋白酶[6],参与降解骨基质和影响破骨细胞的迁移,对破骨细胞迁移的影响作用比降解骨基质的作用更明显[7]。动物实验和临床研究[8]显示:正畸力作用下牙髓组织中MMP-9的表达呈时间不均衡和力值依赖性升高的特点,提示其可能参与正畸力引起的牙髓组织改建。血管改建研究[9]显示:IL-17可激活激活蛋白1(activator protein-1,AP-1)信号通路,刺激颈动脉血管平滑肌细胞中MMP-9的表达。但IL-17能否通过调控破骨细胞中MMP-9的表达进而参与正畸牙根吸收的发生发展过程,目前尚未见报道。本研究探讨IL-17对破骨细胞中MMP-9表达水平的影响,为研究IL-17在正畸力致牙根吸收过程中的作用提供参考。
1 材料与方法 1.1 细胞、主要试剂和仪器小鼠单核/巨噬系细胞RAW264.7(美国菌种保藏中心)。RPMI1640培养液(美国Hyclone公司),胎牛血清(美国Gibco公司),磷酸盐缓冲液(phosphate buffer solution,PBS)、地塞米松和 抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(美国Sigma-Aldrich 公司),IL-17(美国Proteintech公司),ELISA试剂盒(中国朗顿生物技术有限公司),逆转录试剂盒(日本TaKaRa公司)。MMP-9引物由苏州金唯智生物技术有限公司设计合成。PCR 扩增仪(中国博日生物科技有限公司),酶标仪(美国Bio-Rad公司)。
1.2 RAW264.7 细胞的培养培养小鼠RAW264.7细胞,以每孔5×104接种于24孔板,培养于含10%胎牛血清的RPMI1640培养液中。将细胞分为实验组和对照组,将细胞培养液中加入IL-17的细胞作为实验组,不加入IL-17的细胞作为对照组,实验组细胞根据IL-17的浓度分为0.1 μg·L-1 IL-17组、1.0 μg·L-1 IL-17组、10.0 μg·L-1 IL-17组和100.0 μg·L-1 IL-17组。将培养板置于37℃、5%CO2培养箱中培养,隔天换液1次。
1.3 破骨细胞的诱导诱导液的成分为含10%FBS和1%双抗的RPMI1640培养液中,加入10-8 mol·L-11α,25-二羟维生素D3[1α,25-(OH)2VitD3]和10-7 mol·L-1地塞米松[10]。使用一次性无菌细胞刮将培养皿中的各组RAW264.7细胞轻轻刮下,并制成单细胞悬液。经细胞计数板计数,将1×105个细胞接种于6孔板,加入2 mL 诱导液,置于37℃、5%CO2培养箱中,培养5 d,隔天换液1次。
1.4 破骨细胞的TRAP染色固定液由25 mL枸橼酸、65 mL丙酮和8 mL 37%甲醛组成,染色液由1 mL快速石榴石型碱溶液、0.5 mL萘酚AS-BI 磷酸溶液、2 mL醋酸盐溶液、1 mL酒石酸盐溶液和45 mL、37℃预热的去离子水组成。吸弃破骨细胞培养液,采用 PBS 液冲洗细胞2 ~3次,固定液置于18~26℃环境中固定 30 s,以去离子水冲洗;将0.5 mL快速石榴石型碱溶液和0.5 mL亚硝酸钠溶液混匀后静置 2 min,加入染色液,37℃避光孵育;1 h后以PBS 液冲洗,苏木精溶液复染 2 min,碱性自来水冲洗 3 min,直至出现蓝色细胞核;常温自然晾干,倒置显微镜下观察。TRAP 染色阳性结果为细胞质内含酒红色沉淀,细胞核呈阴性。破骨细胞为 TRAP 染色阳性的含有 3 个或多于 3 个细胞核的多核细胞。
1.5 ELISA法检测破骨细胞诱导第5天时各组RAW264.7细胞培养液中MMP-9表达水平对RAW264.7细胞进行破骨细胞诱导,采用ELISA竞争抑制法检测破骨细胞诱导第5天时各组RAW264.7细胞培养液中MMP-9表达水平。具体操作步骤按照说明书进行,在酶标仪450 nm处测得吸光度(A)值。根据各自标准品的浓度和A 值绘制标准曲线,并得出相应的计算公式:Y=35.211e-4.2644X,代入各样品的A 值计算各样品中MMP-9表达水平。
1.6 RT-PCR法检测破骨细胞诱导第5天时各组RAW264.7细胞培养液中MMP-9 mRNA表达水平对RAW264.7细胞进行破骨细胞诱导,采用RT-PCR法检测破骨细胞诱导第5天时各组RAW264.7细胞培养液中MMP-9 mRNA表达水平,MMP-9上游引物:5′-CCCTGTGTGTTCCCGTTC-3′,下游引物:5′-TCCTGGTCATAGTTGGCT-3′,产物大小约为110 bp。PCR反应条件:94℃、1 min;94℃、30 s;60℃、30 s;72℃、30 s;72℃、5 min,30个循环。所得PCR 产物经1% 琼脂糖凝胶电泳,Bio-rad 成像系统采集图像。采用Quantity One软件检测条带灰度值,以条带灰度值代表MMP-9 mRNA 表达水平。
1.7 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析。各组RAW264.7细胞培养液中MMP-9和MMP-9 mRNA表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 破骨细胞的TRAP染色结果RAW264.7细胞诱导培养第5天时,可见TRAP染色阳性细胞,体积大,多核(细胞核≥3个),形状不规则,边缘呈云雾状,有伪足,镜下细胞核呈紫蓝色,胞浆中TRAP活性部位呈紫红色颗粒,表明RAW264.7细胞成功向破骨细胞分化。见图 1(插页一)。
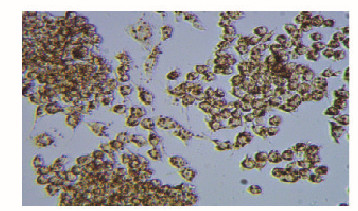
|
| 图 1 诱导成功的破骨细胞形态表现(TRAP,×200) Fig.1 Morphology of successfully induced osteoclasts(TRAP, ×200) |
与对照组(0.203±0.011)比较,1.0 μg·L-1 IL-17组(0.442±0.035)、10.0 μg·L-1 IL-17组(0.744±0.058)和100.0 μg·L-1 IL-17组(1.700±0.098)RAW264.7细胞培养液中MMP-9表达水平升高(P < 0.05),其中10.0 和100.0 μg·L-1 IL-17组细胞培养液中MMP-9表达水平明显升高 (P < 0.05) ;10.0 μg·L-1IL-17组RAW264.7细胞培养液中MMP-9表达水平高于1.0 μg·L-1 IL-17组(P < 0.05);100.0 μg·L-1IL-17组细胞培养液中MMP-9表达水平高于10.0 μg·L-1IL-17组(P < 0.05)。
2.3 破骨细胞诱导第5天时各组RAW264.7细胞培养液中MMP-9 mRNA 的表达水平琼脂糖凝胶电泳可见长度约为110 bp条带,第1~5泳道光亮度逐渐增强。与对照组(0.125±0.005)比较,0.1 μg·L-1 IL-17组(0.196±0.009)、1.0 μg·L-1 IL-17组(0.406±0.023)、10.0 g·L-1 IL-17组(0.419±0.016)和100.0 μg·L-1 IL-17组(0.756±0.046)RAW264.7细胞培养液中MMP-9 mRNA表达水平均升高(P < 0.05),其中1.0、10.0和100.0 μg·L-1IL-17组细胞培养液中MMP-9 mRNA表达水平明显升高;各实验组间MMP-9 mRNA 表达水平比较差异均有统计学意义(P < 0.05),MMP-9 mRNA表达水平由高到低的顺序为100.0μg·L-1IL-17组> 10.0 μg·L-1 IL-17组>1.0 μg·L-1 IL-17组>0.1 μg·L-1 IL-17组 。见图 2。

|
| M: Marker; Lane 1: Control group; Lane 2: 0.1 μg·L-1IL-17 group; Lane 3: 1.0 μg·L-1IL-17 group; Lane 4: 10.0 μg·L-1IL-17 group; Lane 5: 100.0 μg·L-1IL-17 group. 图 2 RT-PCR法检测破骨细胞诱导第5 天时各组RAW264.7细胞培养液中MMP-9 mRNA表达电泳图 Fig.2 Electrophoregram of expressions of MMP-9 mRNA in RAW264.7 cells after inducing to osteoclasts for 5 din various groups detected by RT-PCR method |
研究[11, 12]显示:正畸力可能引起牙髓炎性根吸收。正畸力作用下,牙髓组织的缺血缺氧环境引发炎性免疫应答,活化的巨噬细胞分泌炎性细胞因子,辅助性T 细胞17(T helper cell 17,Th17)细胞产生IL-17、RANKL和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)。IL-17能诱导活化T细胞和刺激成纤维细胞、巨噬细胞和上皮细胞分泌前炎症因子及趋化因子,促进白细胞迁移、破骨细胞的活化和骨质的吸收。已经证实IL-17与牙周病[13]和根尖周病[14, 15]的炎症反应及骨吸收相关。牙周病损中Th17细胞存在时IL-17的表达水平明显增加[16]。免疫组织化学和原位杂交等研究[17]证实:牙根吸收组织中存在MMP-9,成牙本质细胞和牙周膜细胞、破牙骨质细胞均可产生MMP-9。因此,探讨IL-17对破骨细胞中MMP-9表达水平的影响,有利于明确两者间是否存在一定的联系,为今后研究正畸牙髓炎性根吸收的机制奠定基础。
牙根吸收主要由破牙骨质细胞与体内各种调节因子协同完成,由于破牙骨质细胞的细胞形态、细胞活性和破骨功能特性与破骨细胞相似[18],牙根的吸收机制与骨吸收类似。因此,本实验选择对小鼠单核/巨噬系细胞RAW264.7进行破骨细胞诱导,并成功诱导出破骨细胞。研究[14]显示:应用10-8 mol·L-1 1α,25-(OH)2VitD3和10-7 mol·L-1地塞米松联合诱导RAW264.7细胞时,在诱导第4~5 天时可见大量具有典型破骨细胞特征的细胞产生。本实验应用该方法诱导RAW264.7细胞时同样发现在诱导第4~5 天时有大量破骨细胞产生,但诱导第5 天时产生的破骨细胞量多于第4 天。因此本实验选择在破骨细胞诱导第5 天时检测培养液中MMP-9表达水平,可以更明显地反映IL-17对破骨细胞中MMP-9表达水平的影响。为避免漏检较低浓度IL-17对破骨细胞中MMP-9表达水平的影响,将实验组IL-17浓度设计为0.1、1.0、10.0和100 .0μg·L-1。
本研究结果显示:IL-17促进RAW264.7细胞培养液中MMP-9表达水平的升高,且IL-17升高MMP-9表达水平的能力随着IL-17浓度的升高而增强。对照组与0.1μg·L-1IL-17组 、0.1与1.0 μg·L-1 IL-17组MMP-9表达水平比较差异均无统计学意义,表明IL-17只有达到一定浓度才能促进破骨细胞中MMP-9表达水平的升高。其中10.0和100.0 μg·L-1 IL-17组RAW264.7 细胞培养液中MMP-9表达水平明显升高表明:较高浓度IL-17对MMP-9表达水平升高的促进作用明显。RT-PCR检测结果显示:IL-17促进RAW264.7细胞培养液中MMP-9 mRNA表达水平升高,且IL-17升高MMP-9 mRNA表达水平的能力随着IL-17浓度的升高而增强。其中1.0、10.0和100 .0μg·L-1 IL-17组RAW264.7 细胞培养液中MMP-9 mRNA表达水平明显升高,表明较高浓度IL-17对MMP-9 mRNA表达水平升高的促进作用明显。
ELISA和RT-PCR检测结果显示:在IL-17的作用下,MMP-9和MMP-9 mRNA表达水平变化趋势基本一致,充分说明IL-17可以促进破骨细胞中MMP-9的表达,且其促进作用随着IL-17浓度的升高而增强。在0.1 μg·L-1 IL-17的作用下,破骨细胞中MMP-9表达水平未增加,而 MMP-9 mRNA表达水平升高。这种蛋白和mRNA表达不一致的原因可能与蛋白质的翻译有关,从mRNA水平到蛋白质的产生存在翻译的过程,此外还可能与mRNA的稳定性、转录后调节和翻译后加工有关,mRNA极易降解,且mRNA翻译为蛋白质的过程中受多种因素的调节[19],所以会出现转录水平和翻译水平并不完全一致的情况。
综上所述,本研究从基因和蛋白水平上明确了正畸牙髓炎性根吸收的热点因子IL-17和MMP-9之间有关联,并阐明了IL-17对MMP-9的促进作用呈浓度依赖性增强的特点。本研究结果提示IL-17对破骨细胞的调控作用除直接促进破骨细胞的分化和作为RANKL诱导剂以外,还可能通过促进MMP-9表达,进而影响破骨细胞的迁移和增强其降解骨基质的能力。
| [1] | Albaker BK, Wong RW. Diagnosis and management of root resorption by erupting canines using cone -beam computed tomography and fixed palatal appliance: a case report [J].J Med Case Rep, 2010, 4(1):399. |
| [2] | 范瑞贤, 李晓智. 白细胞介素-17与正畸牙根吸收相关性研究进展[J]. 现代口腔医学杂志, 2013, 27 (3):167-169. |
| [3] | Xu S, Cao X. Interleukin-17 and its expanding biological functions [J]. Cell Mol Immunol, 2010, 7(3):164-174. |
| [4] | Hayashi N, Yamaguchi M, Nakajima R, et al. T-helper 17 cells mediate the osteo/odontoclastogenesis induced by excessive orthodontic forces [J]. Oral Dis, 2012, 18(4):375-388. |
| [5] | Ota M, Yanagisawa M, Tachibana H, et al. A significant induction of neutrophilic chemoattractants but not RANKL in synoviocytes stimulated with interleukin 17[J]. J Bone Miner Metab, 2014, 33(1):40-47. |
| [6] | Wucherpfennig AL, Li YP, Stetler-Stevenson WG, et al. Expression of 92 kD type IV collagenase/gelatinase B in human osteoclasts [J]. J Bone Miner Res, 2009, 9(4): 549- 556. |
| [7] | Colnot C, Thompson Z, Miclau T, et al. Altered fracture repair in the absence of MMP9 [J]. Development, 2003, 130(17):4123-4133. |
| [8] | 韩光红. 不同正畸力值对牙髓活力、Fos和MMP-9蛋白表达变化作用的实验研究[D].长春: 吉林大学, 2012. |
| [9] | Cheng G, Wei L, Xiurong W, et al. IL-17 stimulates migration of carotid artery vascular smooth muscle cells in an MMP-9 dependent manner via p38 MAPK and ERK1/2-dependent NF-κB and AP-1 activation [J]. Cell Mol Neurobiol, 2009, 29(8):1161-1168. |
| [10] | 张 祎. 牙龈卟啉单胞菌脂多糖对成骨细胞-破骨细胞间EphB4-ephrinB2双向传导信号的影响[D]. 长春: 吉林大学, 2013. |
| [11] | Haug SR, Brudvik P, Fristad I, et al. Sympathectomy causes increased root resorption after orthodontic tooth movement in rats: immunohistochemical study [J]. Cell Tissue Res, 2003, 313(2):167-175. |
| [12] | Shimizu M, Yamaguchi M, Fujita S, et al. Interleukin-17/T-helper 17 cells in an atopic dermatitis mouse model aggravate orthodontic root resorption in dental pulp [J]. Eur J Oral Sci, 2013, 121(2): 101-110. |
| [13] | Takahashi K, Azuma T, Motohira H, et al. The potential role of interleukin-17 in the immunopathology of periodontal disease [J]. J Clin Periodontal, 2005, 32(4): 369-374. |
| [14] | Xiong H, Wei L, Peng B. Immunohistochemical localization of IL-17 in induced rat periapical lesions [J]. J Endod, 2009, 35(2):216-220. |
| [15] | Yang S, Zhu L, Xiao L, et al. Imbalance of interleukin-17+ T-cell and Foxp3+ regulatory T-cell dynamics in rat periapical lesions [J]. J Endod, 2014, 40(1):52-62. |
| [16] | Zhu L, Wu Y, IL-17R activation of human periodontal ligament fibroblasts induces IL-23 p19 production: Differential involvement of NF-κB versus JNK/AP-1 pathways [J]. Mol Immunol, 2011, 48(4):647-656. |
| [17] | Ohba Y, Ohba T, Terai K, et al. Expression of cathepsin K mRNA during experimental tooth movement in rat as revealed by in situ hybridization [J]. Arch Oral Biol, 2000, 45(1):63-69. |
| [18] | Oshiro T, Shibasaki Y, Martin TJ, et al. Immunolocalization of vacuolar-type H+-ATPase, cathepsin K, matrix metalloproteinase-9, and receptor activator of NFkappaB ligand in odontoclasts during physiological root resorption of human deciduous teeth [J]. Anat Rec, 2001, 264(3):305-311. |
| [19] | Abreu RD, Penalva LO, Marcotte EM, et al. Global signatures of protein and mRNA expression levels [J]. Mol Biosyst, 2009, 5(12):1512-1526. |
 2016, Vol. 42
2016, Vol. 42


