扩展功能
文章信息
- 王晓菲, 秦再生
- WANG Xiaofei, QIN Zaisheng
- 厄洛替尼对脂多糖诱导的巨噬细胞炎症反应和小鼠急性肺损伤的影响
- Effects of erlotinib on inflammatory response of marcrophages and ALIinduced by lipopolysaccharides in mice
- 吉林大学学报(医学版), 2016, 42(03): 457-461
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 457-461
- 10.13481/j.1671-587X.20160308
-
文章历史
- 收稿日期: 2016-03-21
巨噬细胞是机体的固有免疫细胞,当外来病原体进入机体后,可以被细菌内毒素激活而产生肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β((interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)等。急性肺损伤(acute lung injury,ALI)是以肺部炎症和微血管通透性增加为特征的临床综合征,可以由肺炎、脓毒血症、严重创伤和急性胰腺炎等引起[1]。巨噬细胞产生的炎症因子TNF-α和IL-1β对于诱发ALI具有重要影响[2, 3, 4]。其中,TNF-α是炎症反应过程中最早期的炎症因子。减少由脂多糖(lipopolysaccharides,LPS)诱导产生的TNF-α,不仅能明显降低小鼠全身或者局部炎症反应[5],同时也能减轻肺泡上皮细胞和血管内皮细胞的损伤[6, 7]。促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)参与了炎症反应和肺上皮细胞的损伤[8]。研究[9, 10]显示:表皮生长因子受体 (epithermal growth factor receptor ,EGFR)抑制剂可以降低TNF-α表达水平,能减轻由LPS诱导产生的内毒素血症的临床症状。厄洛替尼是一种EGFR选择性抑制剂,可用于非小细胞肺癌的分子靶向治疗[11, 12]。本实验探讨厄洛替尼对LPS诱导巨噬细胞的炎症反应及其对ALI的作用,以期为ALI患者的治疗及改善预后提供依据。
1 材料与方法 1.1 动物、主要试剂和仪器健康SPF级C57BL/6小鼠26只,均为雄性,6~8周龄,购自南方医科大学实验动物中心,实验动物生产许可证号:SYXK(粤)2010-0056。小鼠TNF-α ELISA试剂盒(美国eBioscience 公司),DMEM培养基和胎牛血清(美国Gibco公司),LPS(4391,美国Sigma公司),磷酸化EGFR和ERK1/2抗体(美国Cell Signaling Technology公司),厄洛替尼(美国Selleck 公司),重组小鼠巨噬细胞集落刺激因子(美国Peprotech公司)。全波长酶标仪(美国Thermo公司),全光谱多功能活体成像系统(美国柯达公司)。
1.2 动物分组和给药取16只小鼠随机分为4组,每组4只。对照组:小鼠灌胃给予生理盐水,每天1次,共3 d,并于第3天灌胃后腹腔注射生理盐水1次;厄洛替尼组:仅用厄洛替尼(45 mg·kg-1)预处理,小鼠灌胃给药,每天1次,共3 d,于第3天灌胃后腹腔注射生理盐水1次;LPS组:生理盐水灌胃3 d,每天1次,并于第3天灌胃后腹腔注射LPS (5 mg·kg-1);LPS+厄洛替尼组:采用厄洛替尼(45 mg·kg-1)预处理,每天1次,连续灌胃共3 d,并于第3天灌胃后腹腔注射LPS (5 mg·kg-1)。6 h后LPS组小鼠出现呼吸频率加快、躁动不安、紫绀时麻醉处死各组所有小鼠,取肺组织行HE染色,检测各组小鼠血清中TNF-α水平。
1.3 巨噬细胞的分离、培养和分组 1.3.1 小鼠骨髓来源巨噬细胞的分离和培养取10只小鼠,断颈处死后分离股骨和胫骨,在超净台去骨骺,用低糖DMEM培养基将小鼠骨髓腔内的骨髓冲出,吹打成单细胞悬液后,1500 r·min-1离心5 min后,低糖DMEM培养基重悬并计数细胞,按1×105~1×106将细胞置于低糖DMEM培养基6孔板(含10%胎牛血清和终浓度10 nmol·L-1巨噬细胞集落刺激因子),置于37℃、5% CO2的孵箱中培养。第3天更换培养基,集落刺激因子浓度加倍,第6天更换培养基进行分组实验。
1.3.2 细胞分组将巨噬细胞分为4组:对照组,细胞给予PBS缓冲液;厄洛替尼组,细胞给予厄洛替尼(20 μmol·L-1)预处理30 min,再给予PBS缓冲液;LPS组,以LPS(500μg·L-1)刺激细胞;LPS+厄洛替尼组,厄洛替尼预处理30 min后加入LPS(500μg·L-1)刺激细胞。
1.4 ELISA法检测各组小鼠血清和巨噬细胞中TNF-α水平各组小鼠麻醉状态下心脏取血,抗凝处理后2 500 r·min-1离心10 min,吸取血清。原代培养小鼠骨髓来源的巨噬细胞,收集细胞培养基,稀释至适宜浓度。采用ELISA法检测小鼠血清和细胞培养基中TNF-α水平。具体步骤参考ELISA试剂盒说明书。
1.5 聚丙烯酰胺凝胶电泳(SDS-PAGE)法检测小鼠肺组织和巨噬细胞中ERK1/2、p38磷酸化水平用PBS缓冲液清洗4组巨噬细胞2次;提取小鼠肺组织后用生理盐水冲洗数次,加液氮研磨成粉状。分别向细胞和组织粉末中加入适量裂解液,提取蛋白并进行BCA定量,上样,行SDS-PAGE,转膜,用磷酸化p38和ERK1/2一抗及二抗孵育后,通过显色和图片灰度值分析,对相应蛋白表达水平进行半定量,评估其磷酸化水平。磷酸化水平以灰度值表示,根据计算公式进行计算。相对灰度值=平均灰度值×面积-背景灰度值。
1.6 HE染色观察各组小鼠肺组织病理形态表现分别取各组小鼠小块肺组织,经10%甲醛固定24 h,常规石蜡包埋,5μm 切片,行HE染色,光镜下观察小鼠肺组织病理形态表现。
1.7 统计学分析采用SPSS13.0统计软件进行数据分析。各组小鼠血清和巨噬细胞培养基中TNF-α水平以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett’s检验。以α=0.05为检验水准。
2 结果 2.1 各组巨噬细胞中TNF-α水平各组巨噬细胞中TNF-α水平为:对照组(12.33±9.08)ng·L-1;厄洛替尼组(11.42±0.63)ng·L-1;LPS组(1 470.29±43.09)ng·L-1;LPS+厄洛替尼组(1 048.89±43.71)ng·L-1。与对照组比较,厄洛替尼组巨噬细胞中TNF-α水平无明显变化(P>0.05)。与厄洛替尼组比较,LPS组巨噬细胞中TNF-α水平明显升高(P < 0.05)。与LPS组比较,LPS+厄洛替尼组巨噬细胞中TNF-α水平明显降低(P < 0.05)。
2.2 各组巨噬细胞中ERK1/2和p38的磷酸化水平与对照组比较,厄洛替尼组巨噬细胞中ERK1/2和p38的磷酸化水平无明显变化(P>0.05);与厄洛替尼组比较,LPS组巨噬细胞中ERK1/2和p38的磷酸化水平明显升高(P < 0.05);与LPS组比较,LPS+厄洛替尼组巨噬细胞中ERK1/2和p38的磷酸化水平明显降低(P < 0.05)。见图 1。
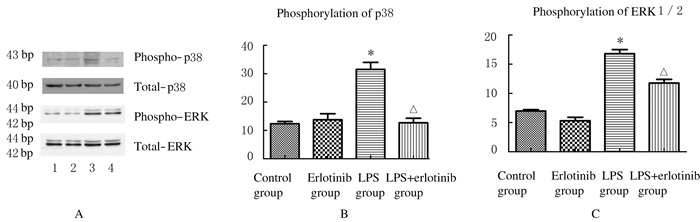
|
| *P < 0.05 compared with erlotinib group;△P < 0.05compared with LPS group. A:Electrophoregram; Lane 1:Control group; Lane 2:Erlotinib group; Lane 3:LPS group; Lane 4:LPS+erlotinib group.B,C:Histogram. 图 1 Westernblotting法检测各组巨噬细胞中ERK1/2和p38磷酸化水平 Fig.1 Phosphorylation levels of ERK1/2 and p38 in macrophagocytes in various groups detected by Westernblotting method |
腹腔注射LPS(5 mg·kg-1)后小鼠肺组织中有巨噬细胞的特异性改变,如炎性细胞浸润、肺泡壁水肿增厚、毛细血管充血、有出血和炎性渗出。巨噬细胞的特征性改变说明小鼠ALI模型造模成功。小鼠肺组织HE染色结果:对照组和厄洛替尼组小鼠肺泡囊、肺泡腔和肺间质组织结构清晰,无炎症细胞浸润(图 2A和B,见插页一)。LPS组小鼠肺泡壁增厚,毛细血管充血,有大量炎症细胞浸润,肺泡腔内有出血和炎性渗出(图 2C,见插页一)。LPS+厄洛替尼组小鼠肺间质充血和水肿减轻,炎症细胞浸润减轻(图 2D,见插页一)。
|
| A: DC cells; B: DC cells transfected by recombinant eukaryotic expression vector. 图 2 重组真核表达载体转染的靶细胞形态表现(×400) Fig.2 Morphology of target cells transfected by recombinant eukaryotic expression vector(×400) |
各组小鼠血清中TNF-α水平分别为:对照组(6.99±1.42)ng·L-1;厄洛替尼组(8.70±2.43)ng·L-1;LPS组(191.41±3.93)ng·L-1;LPS+厄洛替尼组(32.26±2.60)ng·L-1。对照组和厄洛替尼组小鼠血清中TNF-α水平比较差异无统计学意义(P>0.05)。而LPS组小鼠血清中TNF-α水平高于对照组和厄洛替尼组(P < 0.05)。与LPS组比较,LPS+厄洛替尼组小鼠血清中TNF-α的水平明显降低(P < 0.05)。
2.5 各组小鼠肺组织中ERK1/2和p38的磷酸化水平对照组和厄洛替尼组小鼠肺组织中ERK1/2和p38磷酸化水平比较差异无统计学意义 (P>0.05)。与厄洛尼组比较,LPS组小鼠肺组织中ERK1/2和p38磷酸化水平明显升高(P < 0.05)。与LPS组比较,LPS+厄洛替尼组小鼠肺组织中ERK1/2和p38磷酸化水平明显降低(P < 0.05)。见图 3。
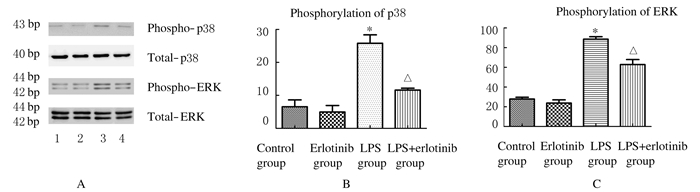
|
| 图 3 Western blotting法检测各组小鼠肺组织中ERK1/2和p38磷酸化水平 Fig.3 Phosphorylation levels of ERK1/2 and p38 in mice in various groups detected by Western blotting method |
内毒素血症是临床常见的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)。严重创伤、感染,烧伤、机体免疫力下降,甚至机械通气均有可能导致内毒素血症的发生[13]。如未能及时有效诊断和治疗,将可能发展成脓毒性休克甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。ALI是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,可造成弥漫性肺间质及肺泡水肿,导致急性低氧性呼吸功能不全。ALI往往是MODS中最先出现的器官功能障碍,在MODS的发病过程中起到决定性的作用[14]。细菌微生物由损伤部位进入,固有免疫系统中的巨噬细胞可以被细菌的LPS激活,吞噬细菌开始产生TNF-α、IL-1β和IL-6等炎症因子。有研究[3, 4]显示:炎症因子TNF-α和IL-1β水平的变化与ALI的发生有密切关联。
革兰阴性菌的LPS跟宿主免疫反应细胞例如巨噬细胞膜上的Toll样受体4(Toll-like receptors 4,TLR4)结合,传递信号到细胞内部,通过NF-κB产生促炎症因子如TNF-α、IL-1 和IL-6等[15]。近年来,EGFR参与炎症反应信号通路的调控作用逐渐被发现并受到重视。研究[9]显示:在小鼠原代心肌细胞中,LPS与TLR4结合后,通过激活EGFR/MAPK信号通路最终产生TNF-α,EGFR的抑制剂厄洛替尼可抑制EGFR磷酸化,降低心肌细胞中TNF-α的产生。
作为病原微生物侵入机体最先产生免疫应答的巨噬细胞,受到LPS刺激后产生TNF-α,其是否通过EGFR产生作用尚未明确。作为抗肿瘤药物,厄洛替尼是一种EGFR的可逆性抑制剂,在ALI的治疗中是否具有抗炎作用尚少有报道。本研究通过培养原代巨噬细胞发现:其受到LPS刺激后产生TNF-α的效应呈时间依赖性,4 h后TNF-α水平达到峰值。采用厄洛替尼(20 μmol·L-1)预处理巨噬细胞[9]可以明显抑制LPS刺激巨噬细胞分泌TNF-α,即巨噬细胞受到LPS刺激后产生的TNF-α是通过激活EGFR而产生的。本研究检测MAPK信号通路中ERK1/2和p38的磷酸化水平结果显示:厄洛替尼可通过抑制巨噬细胞中EGFR磷酸化,从而降低下游ERK1/2和p38的磷酸化水平。
腹腔注射LPS的小鼠肺组织HE染色结果显示:肺泡壁增厚、毛细血管充血和大量炎症因子浸润,肺泡腔中有炎症细胞渗出可代表小鼠ALI造模成功。厄洛替尼(45 mg·kg-1)预处理后的ALI小鼠肺泡壁水肿和充血情况减轻。检测ALI小鼠血清中TNF-α水平结果显示:厄洛替尼可明显降低ALI小鼠血清中TNF-α水平,同时厄洛替尼又可以抑制ALI小鼠肺组织中MAPK信号通路ERK1/2和p38的磷酸化水平。综上所述,厄洛替尼抗炎作用的机制为通过抑制巨噬细胞中EGFR的激活,抑制MAPK信号通路,减少血清中TNF-α的释放,抑制ALI小鼠肺组织中MAPK通路进而减轻肺组织损伤。
目前临床上除了支持治疗和肺保护策略,治疗ALI的特效药物较少[16],因此厄洛替尼可能作为一种用于治疗ALI、降低巨噬细胞产生炎症介质及改善ALI预后的备选药物。但在ALI小鼠体内,厄洛替尼能否抑制肺巨噬细胞的聚集和释放炎症因子,还有待进一步研究。
| [1] | Kim YS, Hwang J, Jang JH, et al. Trapa japonica pericarp extract reduces LPS-induced inflammation in macrophages and acute lung injury in mice[J]. Molecules, 2016, 21(3): 392. |
| [2] | Atabai K, Matthay MA. The pulmonary physician in critical care. 5: Acute lung injury and the acute respiratory distress syndrome: definitions and epidemiology[J]. Thorax, 2002, 57(5): 452-458. |
| [3] | Thomas G, Kamran A, Pierre HJ, et al. Pulmonary edema fluid from patients with acute lung injury augments in vitro alveolar epithelial repair by an IL-1 β-dependent mechanism[J].Am J Respir Crit Care Med, 2001,163(6):1384-1388. |
| [4] | Gao M, Xie B, Gu C, et al. Targeting the proinflammatory cytokine tumor necrosis factor-alpha to alleviate cardiopulmonary bypass-induced lung injury (review)[J]. Mol Med Rep,2015, 11(4): 2373-2378. |
| [5] | Merrill JC, You J, Constable C, et al. Whole-body deletion of LPS-induced TNF-alpha factor (LITAF) markedly improves experimental endotoxic shock and inflammatory arthritis[J]. Proc Natl Acad Sci U S A, 2011, 108(52): 21247-21252. |
| [6] | Wang W, Guan WJ, Huang RQ, et al. Carbocisteine attenuates TNF-alpha-induced inflammation in human alveolar epithelial cells in vitro through suppressing NF-kappaB and ERK1/2 MAPK signaling pathways[J]. Acta Pharmacol Sin, 2016,doi:10.1038/aps.2015.150. |
| [7] | Maloney JP, Gao L. Proinflammatory cytokines increase vascular endothelial growth factor expression in alveolar epithelial cells[J]. Mediat Inflamm, 2015, 2015: 1-7. |
| [8] | Chen Y, Chang L, Li W, et al. Thioredoxin protects fetal type Ⅱ epithelial cells from hyperoxia-induced injury[J]. Pediatr Pulmonol, 2010, 45(12): 1192-1200. |
| [9] | Sun X, Liang J, Yao X, et al.The activation of EGFR promotes myocardial tumor necrosis factor- α production and cardiac failure in endotoxemia[J]. Oncotarget,2015,6(34):35478-35495. |
| [10] | De S, Zhou H, Desantis D, et al. Erlotinib protects against LPS-induced Endotoxicity because TLR4 needs EGFR to signal[J]. Proc Natl Acad Sci U S A,2015, 112(31): 9680-9685. |
| [11] | Sculier JP, Berghmans T, Meert AP. Advances in target therapy in lung cancer[J]. Eur Respir Rev, 2015, 24(135): 23-29. |
| [12] | De Greve J, Van Meerbeeck J, Vansteenkiste JF, et al. Prospective evaluation of first-line erlotinib in advanced non-small cell lung cancer (NSCLC) carrying an activating EGFR mutation: A multicenter academic phase Ⅱ study in caucasian patients (FIELT)[J]. PLoS One,2016, 11(3): e147599. |
| [13] | Tang J, Chen X, Tu W, et al. Propofol inhibits the activation of p38 through up-regulating the expression of annexin A1 to exert its anti-inflammation effect[J]. PLoS One, 2011, 6(12): e27890. |
| [14] | Guo H, Suo DW, Zhu HP, et al. Early blood purification therapy of severe acute pancreatitis complicated by acute lung injury[J]. Eur Rev Med Pharmacol Sci, 2016, 20(5): 873-878. |
| [15] | Beutler B. TLR4 as the mammalian endotoxin sensor[J]. Curr Top Microbiol Immunol, 2002, 270: 109-120. |
| [16] | Fodor RS, Georgescu AM, Cioc AD, et al. Time- and dose-dependent severity of lung injury in a rat model of sepsis[J]. Rom J Morphol Embryol, 2015, 56(4): 1329-1337. |
 2016, Vol. 42
2016, Vol. 42


