扩展功能
文章信息
- 麦莉, 韦建瑞, 华兴
- MAI Li, WEI Jianrui, HUA Xing
- IRF5基因慢病毒表达载体的构建及其在巨噬细胞RAW264.7中的表达
- Construction of IRF5 gene lentiviral vector and its expression in macrophages RAW264.7
- 吉林大学学报(医学版), 2016, 42(03): 452-456
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 452-456
- 10.13481/j.1671-587x.20160307
-
文章历史
- 收稿日期: 2015-11-16
- 网络出版时间: 2016-05-17 14:09:21
2. 暨南大学医学院附属广州红十字会医院病理科, 广东 广州 510515
2. Department of Pathology, Affiliated Guangzhou Red Cross Hospital, College of Medical Sciences, Jinan University, Guangzhou 510515, China
动脉粥样硬化(atherosclerosis,AS)是一种严重威胁人类健康的进行性疾病,其发生发展涉及多种因素,其中炎症反应与AS有关联,而巨噬细胞也起关键作用[1]。干扰素调节因子5(interferon regulatory factor 5,IRF5)作为干扰素调节因子家族(IRF)的一员,以其活化Toll样受体介导的先天性免疫反应而为人所知。近年来研究[2, 3]显示:IRF5基因对巨噬细胞的极化起重要作用,进而加速AS的进程,是目前心血管病领域新兴的研究热点。
干扰素(interferon,IFN)是一类能够抵抗病毒感染、抑制细胞周期并行使免疫调节功能的细胞因子。IRF是一类结构特征保守且功能丰富的转录因子家族,其成员能够在病毒感染时与IFN启动子结合,在诱导、调节干扰素转录、先天性免疫和适应性免疫调控、Th细胞分化等方面均有重要作用[4]。IRF广泛表达于各类细胞中,目前为止,已经发现了9种哺乳动物来源的IRF(IRF1~IRF9)及多个病毒来源的IRF(v-IRF),但对IRF家族成员中IRF5基因功能的研究尚处于起步阶段,其在AS局部微环境下对巨噬细胞极化及功能的研究尚未见报道。研究[5, 6]显示:IRF5可以调节Ⅰ型IFN的产生,通过TLR-9通路激活IFN下游靶基因,参与系统性红斑狼疮和类风湿性关节炎等自身免疫性疾病的发生,且IRF5是一种肿瘤抑制因子,能够通过阻滞细胞周期抑制细胞凋亡和激发免疫活性;同时,活化的IRF5能够激活胱天蛋白酶级联反应,促进DNA断裂和细胞凋亡[7, 8]。
2011年Krausgruber等[9]研究显示:IRF5在炎症的发生发展中发挥双重调控作用——既能够促炎症反应也能够抑制炎症反应:阻断巨噬细胞生成IRF5可以抑制机体免疫反应,可用于治疗多种自身免疫性疾病,如类风湿性关节炎、炎性肠病、红斑狼疮以及多发性硬化症等;反之,提高巨噬细胞中IRF5蛋白水平有利于治疗免疫系统受损的患者。研究者[9]进一步提出IRF5是巨噬细胞功能的关键分子开关,对巨噬细胞的基因表达谱起决定作用。
本研究通过构建携带IRF5基因的重组慢病毒载体,感染巨噬细胞RAW264.7,使IRF5基因在RAW264.7细胞中得到稳定表达,为探讨IRF5基因在AS发生发展中的作用机制提供可靠的细胞模型和实验基础。
1 材料与方法 1.1 细胞、主要试剂和仪器小鼠巨噬细胞RAW264.7、293FT包装细胞和DH5α感受态细胞均由本课题组保存。cDNA表达载体LV11(美国Promega公司),LipofectamineTM2000、Opti-MEM培养基(美国Invitrogen公司),EcoR Ⅰ、BamH Ⅰ内切酶、Taq酶和DNA相对分子质量标准(美国TaKaRa公司),IRF5单克隆抗体、GAPDH单克隆抗体(美国Santa Cruz公司),质粒提取试剂盒、胶回收试剂盒及其他常规化学试剂(北京鼎国生物有限公司)。PCR仪(杭州朗基科学仪器有限公司),电热恒温培养箱(上海福玛实验设备有限公司),电泳仪电泳槽(上海Tanon公司),PowerPac TMHC电泳仪(美国Bio-Rad公司)。
1.2 引物设计与合成根据NCBI IRF5基因序列(NCBI登录号为NM_001098629.2)全长设计并合成引物: IRF5-F,5′-GATTGGAATTCGCC-A CCATGAACCAGTCCATCCCAGTGGCTC-3′;IRF5-R,5′-CTAGAGGGATCCTTATTGCATGCCAGCTGGGTGCATAGG-3′,在上下游引物5′端分别加上限制性内酶切酶(EcoR Ⅰ和BamH Ⅰ)位点和保护碱基,该部分工作由广州复能基因有限公司完成。
1.3 重组慢病毒表达载体LV11-cmv-neo-IRF5的构建以基因库存中的质粒cDNA为模板,进行PCR反应。反应完成后利用Agarose电泳并切胶回收IRF5基因片段,采用限制性内切酶EcoR Ⅰ和BamH Ⅰ分别对IRF5基因片段及载体LV11进行双酶切,回收酶切产物,采用T4 DNA ligase连接双酶切得到的IRF5基因片段和线性化的载体,22℃连接2 h。连接后命名为LV11-cmv-neo-IRF5。重组质粒转化感受态大肠杆菌DH5α,次日随机挑取转化生长的阳性克隆菌落,分别摇菌过夜,采用PCR和双酶切法对重组表达载体进行鉴定,同时取阳性克隆送华大基因公司测序。
1.4 慢病毒包装并感染RAW264.7细胞通过脂质体LipofectamineTM 2000介导将慢病毒表达载体与辅助质粒共转染293FT包装细胞,培养48 h后收集病毒上清液。转染前1天将RAW264.7细胞接种至24孔板中,待培养细胞达到80%~85%汇合时去除孔内培养基,将含5 g·L-1聚凝胺的病毒上清稀释培养基加入细胞培养孔中,感染完毕后换为1 mL完全培养基过夜;筛选G418细胞最小致死浓度,以1 g·L-1浓度的G418抗性筛选获得RAW264.7-NC和RAW264.7-IRF5稳定株细胞,后期以低浓度G418维持筛选后的稳转株。
1.5 感染后细胞的鉴定维持抗性浓度的G418培养液扩增稳定感染的RAW264.7-NC(对照组)和RAW264.7-IRF5细胞(实验组),以每孔5×105接种于6孔板,24 h后收集细胞提取总RNA及总蛋白质。
1.6 RT-qPCR法检测2组细胞中IRF5 mRNA表达水平每孔加入1 mL Trizol提取2组细胞总RNA,采用核酸分光光度法定量并测定其纯度,采用MMLV-RT逆转录酶合成cDNA,采用普通PCR反应进行条件探索及优化,SYBR Premix Ex Taq Kit进行qPCR检测细胞中IRF5 mRNA表达水平。以GADPH作为内参,所需引物序列如下:IRF5-F,5′-TATGCCATCCGCCTGTGT-3′;IRF5-R,5′-TCCCCAAAGCAGAAGAAGAT- 3′,扩增产物片段长度为200 bp;GAPDH-F,5′-AGGTCGGTGTGAACGGATTTG-3′;GAPDH-R,5′ -TGTAGACCATGTAGTTGAGGTCA- 3′,扩增产物片段长度为123 bp。
计算目的基因mRNA相对拷贝数,即IRF5基因与内参基因的表达差异倍数和实验组与对照组细胞中IRF5 mRNA的表达差异倍数。
1.7 Western blotting法检测2组细胞中IRF5蛋白表达水平收集RAW264.7-NC和RAW264.7-IRF5细胞,用1 mL预冷PBS洗涤2次,加入全蛋白裂解液后冰上裂解10 min。枪头吹打以充分裂解细胞后提取总蛋白,经BCA法检测蛋白浓度后行10%SDS-PAGE电泳,分离后电转移至PVDF膜上,将PVDF膜浸入5%脱脂奶粉/TBST,室温摇床缓慢摇动,封闭60 min,IRF5一抗4℃孵育过夜(1∶2 000稀释)、GADPH二抗37℃孵育1 h(1∶5 000稀释),用ECL底物进行化学发光,在暗室中经压片、显影、定影。结果用凝胶成像分析系统拍照,采用条带灰度分析软件ImageJ分析2组细胞中IRF5蛋白的表达水平,以目标蛋白条带与内参条带灰度的比值表示。
1.8 统计学分析采用SPSS 20.0软件进行统计学分析。RAW264.7-NC和RAW264.7-IRF5细胞中IRF5 mRNA表达水平以x± s 表示,组间样本均数比较采用t检验。以α=0.05为检验水准。
2 结 果 2.1 重组慢病毒表达载体LV11-cmv-neo-IRF5的鉴定目的基因片段经扩增和双酶切后,1%琼脂糖电泳结果:在约1595 bp处有明显的目的条带(图 1A),大小与理论一致,表明IRF5正确插入LV11载体中。将阳性克隆进行测序分析,将测序结果与GenBank中登录的IRF5基因(NCBI,NM_001098629.2)标准序列进行比对,所获得的扩增序列完全正确(图 1B)。
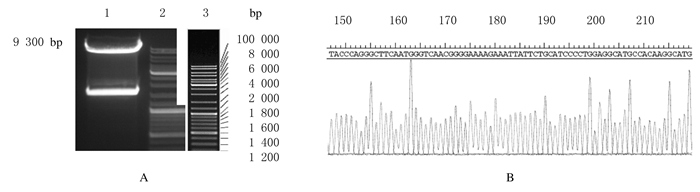
|
| A:Recombinant plasmid identified by EcoR Ⅰ and BamH(Lane 1: LV11-cmv-neo-IRF5;Lane 2-3: Marker fermentas SM0331);B:Sequences of positive clones identified by enzyme digestion. 图 1 LV11-cmv-neo-IRF5慢病毒表达载体的构建和鉴定 Fig. 1 Construction and identification of LV11-cmv-neo-IRF5 lentiviral expression vector |
与对照组细胞(1.00±0.00)比较,实验组细胞中IRF5 mRNA表达水平(40299.16±7518.69)升高(P<0.001)。
2.3 Western blotting法检测2组细胞中IRF5蛋白表达水平2组细胞中IRF5蛋白相对分子质量为55000,经条带灰度分析软件测量:实验组细胞中IRF5蛋白的表达水平明显高于对照组。见图 2。

|
| A:Electrophoregram;B:Histogram. 图 2 Western blotting法检测2组细胞中IRF5 蛋白表达水平 Fig. 2 Expression levels of IRF5 protein in cells in two groups detected by Western blotting method |
AS是一种由多因素造成的在多年内不断进展的终生性疾病,其因素各自作用于不同的环节,包括性别、年龄、吸烟、高血压、糖尿病、肥胖、高胆固醇血症和高甘油三酯血症为主的血脂异常以及家族遗传等[1]。目前,AS是一种特殊的慢性炎症疾病的观点已被普遍认可,巨噬细胞作为第一个被认为与AS有关联的炎症细胞,最新的研究[9]显示:其具有可塑性,即表现不同的极性(M1型与M2型),并且两者之间可相互转化。目前倾向于认为:M1型(经典极化型)为促炎类型,可分泌促炎细胞因子,能够加重AS的炎症反应,并增加机体对氧化低密度脂蛋白(ox-LDL)的摄取及沉积,加快动脉粥样斑块的形成,同时也会对粥样斑块的纤维帽进行破坏,弱化纤维帽的稳定性,而增加斑块破裂形成血栓的风险;与之相反,M2型(选择性极化型)为抗炎类型,能抑制促炎细胞因子的生成,具有组织修复功能,能够促进斑块纤维帽形成,进而稳定斑块,减少斑块破裂出血的风险[10]。因此2种亚型巨噬细胞的形成及平衡与AS的进展有关联。研究[11]显示:斑块中存在不同亚型的巨噬细胞,M2型(CD68+/CD206+)巨噬细胞分布于远离脂核的斑块肩部以及斑块周边,而M1型(CD68+/CCL2+)巨噬细胞恰好相反,主要分布于AS斑块的脂质核心区。
IRF5作为IRF的一员能够介导抗病毒反应,能够引起IFN依赖性基因以及细胞凋亡基因的表达,并同时能对IFNα/β的产物进行调节[12]。同时IRF5是一种转录因子,能够与目标基因的调节区相结合并调整该基因的表达,并能够激活Ⅰ型IFN、炎症细胞因子[肿瘤坏死因子(TNF-α)、白细胞介素12(IL-12)、白细胞介素6(IL-6)、一氧化氮合酶(iNOS)和白细胞介素23(IL-23)等]以及肿瘤抑制因子等基因的编码。人体IRF5基因多态性会导致自身免疫抗体及促炎症细胞因子分泌异常,IRF5基因的多态性与系统性红斑狼疮、类风湿性关节炎、多发性硬化以及炎症性结肠病等自身免疫性疾病的发病有关联。IRF基因多态性也是急性冠脉综合征重要因素,且IRF5 mRNA可在人AS组织中表达[13]。研究[9]显示:IRF5可对促进炎症反应基因和抑制炎症反应基因发挥双重调控作用。研究者进一步提出IRF5是巨噬细胞功能的关键分子开关,对巨噬细胞的基因表达谱起决定作用。但该研究小组还无法确定IRF5是通过直接影响DNA还是与其他相关蛋白互相作用而实现对各类基因的调控的。IRF5基因敲除的小鼠对于LPS诱导的内毒素休克耐受[9],而IRF5缺失的巨噬细胞M1分子标志物的表达水平明显降低[14]。研究[15, 16]显示:IRF5能够使巨噬细胞向M1型巨噬细胞极化,加快AS进程。本研究旨在构建重组慢病毒表达载体LV11-cmv-neo-IRF5并转染巨噬细胞RAW264.7,观察其转染效率及其在RAW264.7细胞中的表达。采用PCR、EcoR Ⅰ和BamH Ⅰ双酶切技术成功构建重组慢病毒质粒LV11-cmv-neo-IRF5,病毒上清液可高效感染RAW264.7细胞并筛选G418细胞最小致死浓度,最终以1 g·L-1G418抗性筛选获得RAW264.7-NC和RAW264.7-IRF5稳定株细胞,后期以低浓度的G418维持筛选后的稳转株。提取细胞总RNA后行RT-qPCR检测细胞中IRF5 mRNA表达水平结果显示:与对照组比较,实验组细胞中IRF5 mRNA表达水平升高。收集RAW264.7-NC和RAW264.7-IRF5细胞裂解液作为样本,以Western blotting法检测IRF5蛋白表达结果显示:IRF5蛋白相对分子质量为55000,实验组细胞中IRF5蛋白的表达水平明显高于对照组。
本研究成功构建了携带IRF5基因的慢病毒表达载体LV11-cmv-neo-IRF5,并利用慢病毒感染技术成功获得了稳定表达IRF5的巨噬细胞株RAW264.7-IRF5,为IRF5对AS局部巨噬细胞极化的调节及其机制的研究奠定了基础,为从分子水平探讨AS的发生发展机制提供了理想的细胞模型。
| [1] | 邢宝鹏,纪 莉. 冠状动脉粥样硬化性心脏病相关危险因素及临床特点分析[D].长春:吉林大学,2012. |
| [2] | 黄 燕. 炎性因子在动脉粥样硬化形成中的作用[D]. 天津:天津医科大学, 2012. |
| [3] | Shirai T, Hilhorst M, Harrison DG,et al. Macrophages in vascular inflammation-From atherosclerosis to vasculitis[J]. Autoimmunity, 2015,48(3): 139-151. |
| [4] | Eames HL, Saliba DG, Krausgruber T,et al. KAP1/TRIM28: an inhibitor of IRF5 function in inflammatory macrophages[J]. Immunobiology, 2012,217(12):1315-1324. |
| [5] | Kim K, Cho SK, Han TU,et al. A redundant epistatic interaction between IRF5 and STAT4 of the type Ⅰ interferon pathway in susceptibility to lupus and rheumatoid arthritis[J]. Lupus,2013,22(13):1336-1340. |
| [6] | Maalej A, Hamad MB, Rebai A, et al. Association of IRF5 gene polymorphisms with rheumatoid arthritis in a Tunisian population[J]. Scand J Rheumatol, 2008,37(6):414-418. |
| [7] | Gestermann N, Koutero M, Belkhir R, et al. Methylation profile of the promoter region of IRF5 in primary Sjogren's syndrome[J]. Eur Cytokine Netw, 2012,23(4):166-172. |
| [8] | Krausgruber T, Saliba D, Ryzhakov G, et al. IRF5 is required for late-phase TNF secretion by human dendritic cells[J]. Blood,2010,115(22):4421-4430. |
| [9] | Krausgruber T, Blazek K, Smallie T, et al. IRF5 promotes inflammatory macrophage polarization and TH1-TH17 responses[J]. Nat Immunol, 2011,12(3):231-238. |
| [10] | Mantovani A, Sozzani S, Locati M, et al.Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends Immunol, 2002,23(11),549-555. |
| [11] | Chinetti-Gbaguidi G, Baron M, Bouhlel MA, et al. Human atherosclerotic plaque alternative macrophages display low cholesterol handling but high phagocytosis because of distinct activities of the PPARγ and LXRα pathways[J]. Circ Res, 2011, 108(8) :985-995. |
| [12] | Malarstig A, Sigurdsson S, Eriksson P, et al. Variants of the interferon regulatory factor 5 gene regulate expression of IRF5 mRNA in atherosclerotic tissue but are not associated with myocardial infarction[J]. Arterioscler Thromb Vasc Biol, 2008,28(5):975-982. |
| [13] | Suzuki M, Pritchard DK, Becker L, et al. High-density lipoprotein suppresses the type I interferon response,a family of potentantiviral immunoregulators,in macrophages challenged with lipopolysaccharide[J].Circulation,2010,122(19):1919-1927. |
| [14] | Takaoka A,Yanai H,Kondo S,et al. Integral role of IRF-5 in the gene induction programme activated by Toll-like receptors[J]. Nature,2005,434(7030): 243-249. |
| [15] | Courties G, Heidt T, Sebas M, et al. In vivo silencing of the transcription factor IRF5 reprograms the macrophage phenotype and improves infarct healing[J]. J Am Coll Cardiol, 2014,63(15): 1556-1566. |
| [16] | Xu WD, Pan HF, Xu Y,et al. Interferon regulatory factor 5 and autoimmune lumps[J]. Expert Rev Mol Med, 2013,15:e6. |
 2016, Vol. 42
2016, Vol. 42


