扩展功能
文章信息
- 周贺, 刘军, 柳雅玲, 王丽, 李开济, 门秀丽
- ZHOU He, LIU Jun, LIU Yaling, WANG Li, LI Kaiji, MEN XiuLi
- 塞来昔布联合紫杉醇诱导乳腺癌细胞凋亡的协同作用及其机制
- Synergistic effect of celecoxib combined with taxol on apoptosis of breast cancer cells and its mechanism
- 吉林大学学报(医学版), 2016, 42(03): 446-451
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 446-451
- 10.13481/j.1671-587x.20160306
-
文章历史
- 收稿日期: 2015-01-15
2. 山东省中西医结合大学病理学教研室, 山东 泰安 271000;
3. 泰山医学院病理学教研室, 山东 泰安 271000
2. Department of Pathology, University of Shandong Integrated Traditional Chinese and Western Medicine, Taian 271000, China;
3. Department of Pathology, Taishan Medical College, Taian 271000, China
乳腺癌是发生在乳腺上皮组织的恶性肿瘤[1],是妇女最常见的恶性肿瘤之一,其发病率和死亡率较高[2, 3],且发病者年龄日趋年轻。全世界女性中,乳腺癌的发病率以每年3%的速度递增[4],每死亡36人中有1人病因为乳腺癌。因此,研制有效的抗乳腺癌药物具有十分重大的意义。
研究[5]证明:环氧化酶2(Cox-2)在包括乳腺癌在内的多种恶性肿瘤中高表达,规律应用某些Cox-2抑制剂可对肿瘤的发生发展起一定的抑制作用,因此,Cox-2抑制剂在乳腺癌治疗中的应用受到广泛关注。塞来昔布(商品名为西乐葆)是一种高选择Cox-2抑制剂,可以选择性阻断Cox-2,其靶向性强,副作用小。紫杉醇是一种有效的植物抗肿瘤药,已应用于各种恶性肿瘤的治疗。临床经常采用联合用药的原则进行化疗,因此,本实验通过观察塞来昔布、紫杉醇以及两者联合应用对乳腺癌MCF-7细胞增殖和凋亡的影响,探讨二者联合用药防治乳腺癌的临床价值。
1 材料与方法 1.1 细胞和主要试剂人乳腺癌MCF-7细胞由山东大学病理实验研究所提供。RPMI1640培养液、胎牛血清、胰蛋白酶和塞来昔布胶囊(辉瑞制药有限公司),紫杉醇注射液(北京华素制药股份有限公司),β-actin抗体、细胞外调节蛋白激酶(ERK)抗体和磷酸化细胞外调节蛋白激酶(p-ERK)抗体(美国Santa Cruz公司),B淋巴细胞瘤2(bcl-2)抗体和Western blotting二抗(北京中杉金桥生物技术有限公司),Annexin Ⅴ-FITC细胞凋亡检测试剂盒、细胞凋亡荧光Hoechst33258检测试剂盒(江苏凯基生物公司),PCR试剂盒(大连宝生物工程有限公司)。
1.2 试剂配制塞来昔布悬液配制:将200 mg/粒的塞来昔布剥去胶囊外壳,粉剂溶于0.9%生理盐水中,过滤。溶剂现用现配。紫杉醇试剂配制:采用0.9%生理盐水将紫杉醇配制成实验所需浓度,过滤。试剂现用现配。
1.3 实验分组将乳腺癌MCF-7细胞分为4组:空白对照组,不含药物作用的培养基;塞来昔布组,含塞来昔布质量浓度分别为10、25、50、75和100 mg·L-1;紫杉醇组,含紫杉醇质量浓度分别为10、20、30、40和50 μg·L-1;塞来昔布联合紫杉醇组,将2种药物5组浓度按由低到高梯度依次联合作用。
1.4 细胞收集将进行药物实验的细胞分组铺于6孔板贴壁培养,每组细胞活性、数量相当。24 h后MCF-7细胞贴壁牢固。6 h后弃去培养液,每孔PBS洗1次,0.25%胰蛋白酶消化5 min,每孔再加入培养液,轻轻吹打细胞转移至离心管,800 r·min-1离心5 min收集细胞。
1.5 Hoechst 33258染色观察各组MCF-7细胞凋亡形态将洁净盖玻片置于6孔板中,种入MCF-7细胞培养过夜,使其长满50%~80%。加药刺激MCF-7细胞发生凋亡,约12 h后吸尽培养基。冷BufferA洗涤细胞2次,加入1 mL 4%甲醛溶液固定10 min。去除固定液,采用BufferA洗2次,在洁净的载玻片上盖上贴有细胞的盖玻片,加入100 μL Hoechst 33258工作液染色10 min,水冲净晾干,滴1滴甘油。以紫外光340 nm波长激发,荧光显微镜下观察各组MCF-7细胞经不同药物作用后的凋亡形态。实验重复3次。
1.6 MTT法检测各组MCF-7细胞不同时间点细胞存活率96孔板分组分药物浓度培养MCF-7细胞,每孔加入15 μL 0.5%MTT溶液。继续培养4 h,弃去培养液,每孔加入150 μL DMSO,震荡仪震摇10 min,酶标仪在570 nm波长下检测各孔的吸光度(A)值。细胞存活率=实验组A值/空白对照组A值×100%。实验重复3次。
1.7 流式细胞术检测各组细胞周期分布和细胞凋亡率分别收集各组细胞,PBS洗涤2次,弃去上清,加入1 mL 70%预冷乙醇固定,4℃过夜。PBS洗涤、离心去上清,每管加入100 μL RNA酶37℃孵育,加入500 μL PI避光,上机检测细胞周期分布。分别收集各组细胞(包括收集已经悬浮的发生凋亡或坏死的细胞),离心弃上清,加入500 μL1×Binding Buffer轻轻重悬细胞,加入5 μL Annexin Ⅴ-FITC,5 μL PI染色液轻轻混匀,室温、避光反应15 min。1 h内上流式细胞仪检测细胞凋亡率。实验重复3次。
1.8 Western blotting法检测各组MCF-7细胞中bcl-2、ERK2和p-ERK蛋白的表达量收集细胞,PBS洗涤离心,每个EP管加入200 μL RIPA,冰浴30 min,4℃、 12000 r·min-1离心30 min,收集上清。采用BCA法测定蛋白表达量,将蛋白存储在-20℃。将样品与Loading Buffer按5∶1的比例混匀,煮沸10 min,存储于-20℃备用。上样体积为10~20 μL,根据上样量,计算所需蛋白样品体系,采用Loading Buffer补齐至上样体积。电泳条件:浓缩胶80 V、30 min,分离胶160 V、30 min;电转条件:100 V、1 h。将2mL一抗用封闭液按1∶1 000比例稀释,将2mL二抗采用封闭液按1∶500比例稀释,进行ECL免疫检测。实验重复3次。
1.9 统计学分析采用SPSS13.0统计软件进行数据分析。各组MCF-7细胞存活率和早期凋亡率以x±s表示,多组间均数比较采用单因素方差分析。以α=0.05为检验水准。
2 结 果 2.1 各组MCF-7细胞凋亡形态表现Hoechst33258染色结果显示:药物刺激细胞12 h后,空白对照组的正常癌细胞胞浆分布均匀,无深染的亮点(图 1A,见插页一)。紫杉醇组MCF-7细胞胞浆浓缩,细胞核变成颗粒状无固定形状的碎片,为凋亡细胞(图 1B,见插页一)。塞来昔布组,随着浓度增加,凋亡细胞的比例呈剂量依赖性升高(图 1C和D,见插页一)。塞来昔布联合紫杉醇组细胞体积变圆,胞浆浓缩,核DNA固缩深染,碎裂成蓝色不均匀荧光,贴壁能力很差,有的已经脱落游离至培养液中,并且随着塞来昔布浓度增加凋亡比例逐渐升高(图 1E和F,见插页一)。
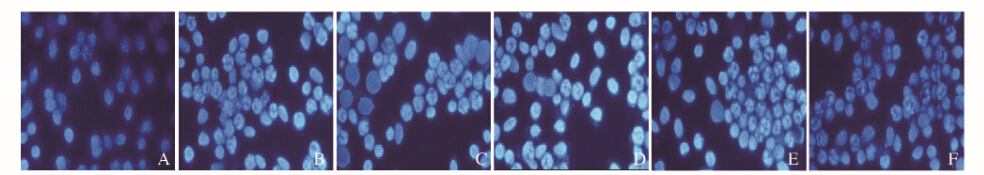
|
| A:Blank control group; B:Taxol (30 μg · L ) group; C, D: Cclccoxib(50, 100 mg · L ) groups; E: Cclccoxib (50 mg · L ) + Taxol (30 pg · L ) group; F: Cclccoxib(100 mg · L )+Taxol(30 μg · L ) group.A:Blank control group; B:Taxol (30 μg · L ) group; C, D: Cclccoxib(50, 100 mg · L ) groups; E: Cclccoxib (50 mg · L ) + Taxol (30 μg · L ) group; F: Cclccoxib(100 mg · L )+Taxol(30 μg · L ) group. 图 1 药物处理12 h后各组MCF-7细胞的凋亡形态表现(荧光,×200) Fig. 1 Apoptotic morphology of MCF-7 cells in various groups 12 h after drug treatment(Fluorescence, ×200) |
MTT检测结果: 12、24和48 h时,塞来昔布组和紫杉醇组MCF-7细胞存活率随药物作用时间的延长而逐渐下降;而在相同时间段中,50或100mg·L -1塞来昔布联合30 μg·L -1紫杉醇组MCF-7细胞存活率明显低于塞来昔布组和紫杉醇组。见表 1。
| (x± s ,η/%) | |||
| Group | Survival rate of MCF-7 cells | ||
| (t/h) 12 | 24 | 48 | |
| Celecoxib(50 mg·L-1) | 0.890±0.004 | 0.610±0.008* | 0.370±0.007* |
| Celecoxib(100 mg·L-1) | 0.780±0.008△ | 0.480±0.008*△ | 0.250±0.004*△ |
| Taxol(30 μg·L-1) | 0.540±0.013△ | 0.270±0.002*△ | 0.120±0.009*△ |
| Celecoxib ( 50 mg·L-1)+ Taxol(30 μg·L-1) | 0.260±0.02△# | 0.180±0.005△# | 0.080±0.022△# |
| Celecoxib (100 mg·L-1)+ Taxol(30 μg·L-1) | 0.140±0.018△# | 0.110±0.019△# | 0.030±0.006△# |
| *P<0.05 vs 12 h;△P<0.05 vs celecoxib (50 mg·L-1) group;# P<0.05 vs toxol (30 μg·L-1) group. | |||
流式细胞术结果:塞来昔布、紫杉醇及两者联合均可诱导MCF-7细胞凋亡,影响细胞周期的分布,出现凋亡峰。塞来昔布组细胞阻滞于G0/G1期,紫杉醇组细胞阻滞于G2/M期,与空白对照组比较,塞来昔布联合紫杉醇组细胞周期分布改变最明显,在G0/G1期及G2/M期细胞的比例均有明显升高,S期细胞比例下降。见图 2。
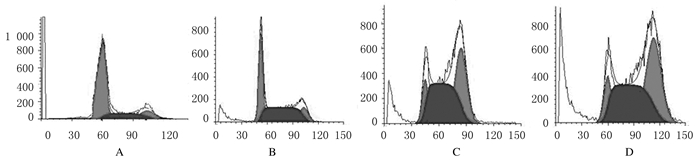
|
| A:Blank control group; B:Celecoxib(100 mg·L-1) group; C:Taxol(30 μg·L-1) group; D:Celecoxib(100 mg·L-1)+ Taxol(30 μg·L-1) group. 图 2 流式细胞术检测各组MCF-7细胞经药物作用6 h后的细胞周期分布图 Fig. 2 Diagram of cell cycle of MCF-7 cells in various groups after 6 h drug treatment detected by flow cytometry |
Annexin Ⅴ-FITC/PI双染结果显示:药物诱导人乳腺癌MCF-7细胞6 h后,早期自然凋亡率约为4.04%,塞来昔布或紫杉醇单药诱导6 h后MCF-7细胞早期凋亡率(约5.85和约6.98%)均高于无药物诱导时(0%,P<0.05)。塞来昔布联合紫杉醇组细胞的早期凋亡率约为19.65%,明显高于塞来昔布组和紫杉醇组(P<0.05)。见图 3和表 2。
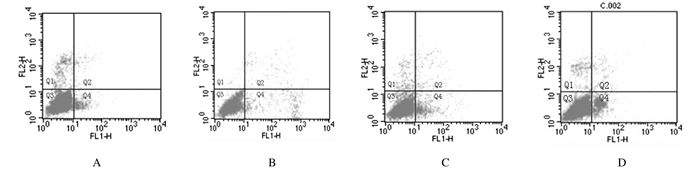
|
| A:Blank control group; B:Celecoxib(100 mg·L-1) group; C:Taxol(30 μg·L-1) group; D:Celecoxib(100 mg·L-1)+Taxol(30 μg·L-1) group. 图 3 流式细胞术检测各组MCF-7细胞经药物处理6 h后细胞凋亡情况 Fig. 3 Apoptosis of MCF-7 cells in various groups 6 h after drug treatment detected by flow cytometry |
| (x± s ,η/%) | |
| Group | Early apoptotic rate |
| Blank control | 4.04±0.51 |
| Celecoxib(100 mg·L-1) | 5.85±1.12* |
| Taxol(30 μg·L-1) | 6.98±0.87* |
| Celecoxib (100 mg·L-1) + Taxol(30 μg·L-1) | 19.65±1.37*△# |
| *P<0.05 vs blank control group; △P<0.05 vs celecoxib (100 mg·L-1) group;#P <0.05 vs taxol (30 μg·L-1) group. | |
与空白对照组比较,塞来昔布组和紫杉醇组MCF-7细胞中bcl-2蛋白表达量下降,塞来昔布联合紫杉醇组细胞中bcl-2蛋白表达量比塞来昔布组和紫杉醇组下降更明显;与空白对照组比较,塞来昔布组、紫杉醇组和塞来昔布联合紫杉醇组细胞中ERK2蛋白表达量无明显变化;与空白对照组比较,塞来昔布组和紫杉醇组细胞中p-ERK蛋白表达量下降,塞来昔布联合紫杉醇组其表达量下降更明显。见图 4。
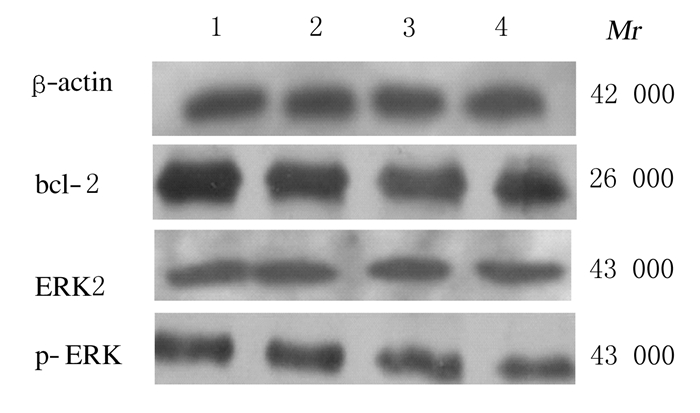
|
| Lane 1:Blank control group; Lane 2:Celecoxib(100 mg·L-1); Lane 3:Taxol(30 μg·L-1) group; Lane 4:Celecoxib(100 mg·L-1)+ Taxol(30 μg·L-1). 图 4 各组MCF-7细胞中bcl-2、ERK2和p-ERK蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of bcl-2,ERK2, and p-ERK proteins in MCF-7 cells in various groups |
乳腺癌是一种常见的的恶性肿瘤,是全球女性死亡的一个重要原因[6, 7]。化疗在其治疗中占有重要地位,然而乳腺癌细胞对单一化疗药物的耐药性成为化疗失败的重要原因。因此,本研究通过联合应用塞来昔布和紫杉醇观察二者联合用药对乳腺癌细胞凋亡的影响。
环氧合酶(Cox)是前列腺素合成的关键酶,目前发现Cox有多个亚型,其中Cox-2是诱导型酶,在正常组织中表达水平较低,但在炎症、创伤和肿瘤的生长及转移等刺激下表达上调。有研究[8, 9]证实:Cox-2高表达与肿瘤大小、分化程度、病理分期、淋巴结转移、患者预后和生存率有关联。37%的乳腺癌患者中出现Cox-2高表达,且这些患者均预后不良,出现淋巴结转移。因此,有效抑制Cox-2的表达可能对抑制肿瘤发生发展具有重要意义[10]。塞来昔布是一种选择性Cox-2抑制剂,可以抑制乳腺癌细胞的能动性和侵袭性[11]。紫杉醇类药物是目前乳腺癌患者化疗最常用的药物,但50%~70%的患者会出现明显耐药。本研究结果显示:塞来昔布组和紫杉醇组均有细胞凋亡,塞来昔布联合紫杉醇组MCF-7细胞凋亡数明显增多,并呈现塞来昔布浓度依赖性,而且联合用药时细胞增殖抑制明显,表明塞来昔布和紫杉醇均可不同程度抑制细胞增殖、诱导MCF-7细胞凋亡,二者联合应用时效果更加明显。塞来昔布和紫杉醇在促进乳腺癌MCF-7细胞凋亡方面有协同作用。
正常情况下细胞中抑制凋亡的bcl-2基因与促进凋亡的bax基因的表达比例是固定的,bcl-2和bax通过形成同源或异源二聚体来调节细胞凋亡[12],在一些肿瘤发生过程中可改变bcl-2-bax与bax-bax二聚体表达量,随着bcl-2表达上调,bax-bax二聚体分开,形成bcl-2-bax异源二聚体,从而抑制了bax-bax促进凋亡的作用[13]。因此,抑制bcl-2表达可促进细胞凋亡。ERK在肿瘤侵袭和转移过程中起中介和放大信号的作用,一方面接受大量来自生长因子、丝裂原和环境刺激等的信号,另一方面通过ERK信号级联反应激活的ERK(即p-ERK)促进细胞质靶蛋白磷酸化或调节其他蛋白激酶的活性,p-ERK进入核中,促进多种转录因子磷酸化,引发多种癌基因的相继激活,从而导致细胞的恶性转化[14, 15]。本研究结果显示:塞来昔布和紫杉醇可协同阻断ERK的磷酸化,下调bcl-2表达,进而促进MCF-7细胞凋亡,提示塞来昔布联合紫杉醇诱导乳腺癌细胞凋亡的机制可能与下调bcl-2和p-ERK蛋白表达有关。但体外实验与体内实际效果可能有一定差别,详细作用机制还有待于深入研究。
| [1] | Elsberger B.Translational evidence on the role of Src kinase and activated Src kinase in invasive breast cancer[J].Crit Rev Oncol Hematol,2014,89(3):343-351. |
| [2] | Vyas A,Dandawate P,Padhye S,et al.Perspectives on new synthetic curcumin analogs and their potential anticancer properties[J].Curr Pharm Design,2013,19(11):2047-2069. |
| [3] | Nagalingam A,Kuppusamy P,Singh SV,et al.Mechanistic elucidation of the antitumor properties of withaferin A in breast cancer[J].Cancer Res,2014,74(9):2617-2629. |
| [4] | 刘 力,刘国文,谭米多.乳腺癌的综合治疗现状[J].中国肿瘤外科杂志,2013,5(1):60-63. |
| [5] | LeeJA,Bae JW,Woo SU,et al.Correlation between Cox-2 expression and hormone receptors in invasive ductal breast cancer[J].J Korean Surg Soc,2010,78(3):140-148. |
| [6] | Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108. |
| [7] | Downs-Holmes C,Silverman P.Breast cancer:overview & updates[J].Nurse Pract,2011,36(12):20-26. |
| [8] | Ristimaki A,Sivula A,Lundin J,et al.Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer[J].Cancer Res,2002,62(3):632-635. |
| [9] | Holmes MD,Chen WY,Schnitt SJ,et al.COX-2 expression predicts worse breast cancer prognosis and does not modify the association with aspirin[J].Breast Cancer Res Treat, 2011,130(2):657-662. |
| [10] | Denkert C,Winzer KJ,Hauptmann S.Prognostic impact of cyclooxygenase-2 in breast cancer[J].Clin Breast Cancer,2004,4(6):428-433. |
| [11] | Qin G,Xu F,Qin T,et,al.Palbociclib inhibits epithelial-mesenchymal transition and metastasis in breast cancer via c-Jun/Cox-2 signaling pathway [J].Oncotarget,2015,6(39):41794-41808. |
| [12] | Singh B,Irving LR,Tai K,et al.Overexpression of COX-2 in celecoxib-resistant breast cancer cell lines[J].J Surg Res,2010,163(2):235-243. |
| [13] | Cory S,Adams JM.Killing cancer cells by flipping the Bcl-2/ Bax switch[J].Cancer Cell,2005,8(1):5-6. |
| [14] | 赵明哲,刘靖华,李玉花,等.ERK信号通路的信号转导调控机制[J].国际病理科学与临床杂志,2009,29(1):15-19. |
| [15] | Santen RJ,Song RX,McPherson R,etal.The role of mitogen-activated protein (MAP) kinase in breast cancer [J].J Steroid Biochem Mol Biol,2002,80(2):239-256. |
| [16] | 张 莹,李春艳,崔泽实,等.TSG101与HIF-1α在乳腺癌组织中的表达及意义[J].中国实用内科杂志,2014,34(Suppl1):96-98. |
 2016, Vol. 42
2016, Vol. 42


