扩展功能
文章信息
- 王垚, 王秀, 张弨, 刘畅, 张凯, 张建国, 杨海峰
- WANG Yao, WANG Xiu, ZHANG Chao, LIU Chang, ZHANG Kai, ZHANG Jianguo, YANG Haifeng
- 利莫那班对颅脑外伤模型大鼠癫痫易感性的影响
- Effect of rimonabant on susceptibility of epilepsy in rat models after head injury
- 吉林大学学报(医学版), 2016, 42(03): 435-438
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 435-438
- 10.13481/j.1671-587x.20160304
-
文章历史
- 收稿日期: 2015-02-11
2. 首都医科大学附属北京天坛医院神经外科, 北京 100050;
3. 北京市神经外科研究所, 北京 100050
2. Department of Neurosurgery, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China;
3. Beijing Neurosurgical Institute, Beijing 100050, China
据统计,外伤后癫痫占症状性癫痫的16.3%,其患病率在症状性癫痫的全部病因中居首位[1]。目前的抗癫痫药物只能起到治疗癫痫的作用,而不能阻止外伤后癫痫的发生。近年的研究[2, 3]表明:内源性大麻素系统可能对癫痫的发生有一定的抑制作用。在颅内,内源性大麻素系统主要通过大麻素受体1型(cannabinoid receptor type 1,CB1)受体发挥作用。目前研究[4, 5, 6]证实CB1受体在多种癫痫动物模型的发生中均有较明确的抗惊厥作用。但对于外伤后癫痫,CB1受体的具体作用及其机制尚不明确。利莫那班作为CB1受体的拮抗剂,可能有预防外伤后癫痫的作用,但目前仍存在一定争议[4]。本研究观察CB1受体和利莫那班对大鼠外伤后癫痫易感性的影响,并对其可能的机制进行探讨。
1 材料与方法 1.1 动物、主要试剂和仪器8周龄SD大鼠105只,雄性,体质量280~320g,购于北京维通利华公司,动物合格证号:11400700119829。利莫那班(美国R&D公司),戊四唑(美国Sigma公司)。大鼠脑立体定向仪(德国KOPF公司)。大鼠颅脑液压打击仪(美国AmSien公司)。
1.2 动物分组和给药105只大鼠分为3组:模型处理组(接受液压打击,腹腔注射利莫那班和戊四唑)45只、模型组(接受液压打击,腹腔注射生理盐水及戊四唑)45只和空白对照组(只接受腹腔注射戊四唑)15只。
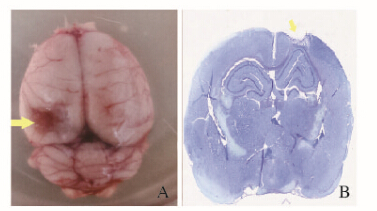
1.3 液压打击制备大鼠颅脑外伤模型将大鼠采用10%水合氯醛麻醉后固定于立体定向仪上,切开皮肤并分离皮下组织暴露前囟及颅骨,于左侧中线外1 mm,冠状缝后1 mm处钻开颅骨,去骨瓣直径为3~5 mm,保留完整的硬膜。将大鼠头部骨窗对准液压打击仪出水口,给予2.8~3.3 atm液压打击造成重度脑外伤。打击时瞬时压力通过外接压力传感器记录[5]。对模型处理组和模型组大鼠制备颅脑外伤模型(图 1,见插页一),并在打击后2 min分别在腹腔内注射利莫那班(2 mg·kg-1)[4, 6]和生理盐水(2 mg·kg-1),空白对照组大鼠只进行颅骨钻孔而不打击。
|
| 图 1 液压打击后大鼠大脑组织(A)及其病理切片图(B) Fig. 1 Brain tissue(A) and pathological section (B) of rats after FPI |
大鼠经过外侧液压打击后,通过向腹腔注射戊四唑(65 mg·kg-1)诱导癫痫发生[7]。注射后大鼠一般经过以下3个过程:开始时出现肢体短暂抽搐,一段时间后出现肌阵挛性癫痫,继而部分大鼠发展为GTCS。将从腹腔注射结束戊四唑到出现肌阵挛性癫痫的时间定义为癫痫发生的潜伏期。模型处理组和模型组大鼠,分别在打击后24 h、1周和6周时分别腹腔注射戊四唑(每个时间点注射15只);空白对照组大鼠,颅骨钻孔24h后腹腔注射戊四唑,观察各组大鼠癫痫发生的潜伏期和出现GTCS大鼠的数量。
1.5 统计学分析采用SPSS18.0统计软件进行统计学分析。打击后相同时间点的各组大鼠癫痫发生的潜伏期以x± s 表示,组间比较采用独立样本t检验,组内不同时间点大鼠癫痫发生的潜伏期比较采用单因素方差分析;各组发生GTCS大鼠数量比较采用χ2检验,在χ2检验频数小于5时采用Fisher确切概率法。以α=0.05为检验水准。
2 结 果 2.1 各组大鼠癫痫发生的潜伏期组内比较:模型组大鼠在打击后6周时,癫痫发生的潜伏期较24h(F=12.93,P=0.023)和1周时缩短(F=11.80,P=0.016)。模型处理组大鼠在打击后24 h时癫痫发生的潜伏期较1周时(F=22.51,P=0.001)和6周时(F=14.69,P=0.024)缩短。组间比较:与空白对照组比较,模型组6周时(F=14.74,P=0.03)和模型处理组24h时(F=18.33,P=0.007)大鼠癫痫的发生潜伏期均有明显缩短;打击后24 h时,模型组大鼠癫痫发生的潜伏期较模型处理组延长(t=2.97,P=0.009);打击后6周时,模型组大鼠癫痫发生的潜伏期较模型处理组(6周时)缩短(t=2.31,P=0.033);而打击后1周时,模型组与模型处理组大鼠癫痫潜伏期比较差异无统计学意义(t=1.06,P=0.306)。见表 1。
| (x± s ,t/s) | ||
| Group | n | Latency |
| Blank control group | 15 | 78.44±14.33 |
| Model | 45 | |
| 24 h after FPI | 70.62±8.64○ | |
| 1 week after FPI | 75.50±8.42 | |
| 6 weeks after FPI | 63.75±6.46*△#▲ | |
| Model-management | 45 | |
| 24 h after FPI | 60.11±6.45* | |
| 1 week after FPI | 85.67±18.78○ | |
| 6 weeks after FPI | 74.80±13.73○ | |
| *P<0.05 compared with blank control group;△P<0.05 compared with 24 h after FPI in model group;#P<0.05 compared with 1 weeks after FPI in model group;○P<0.05 compared with 24h after FPI in model-management group;▲P<0.05 compared with 6 weeks after FPI in model-management group. | ||
打击后24h和1周时,模型组和模型处理组发生GTCS的大鼠数量比较差异无统计学意义(P>0.05);而打击后6周时,模型处理组发生GTCS大鼠的数量较模型组明显减少(χ2=6.67,P=0.033)。见表 2。
| Group | n | Number of GTCS rats |
| Blank control group | 15 | 11 |
| Model | 45 | |
| 24 h after FPI | 12 | |
| 1 week after FPI | 13 | |
| 6 weeks after FPI | 14 | |
| Model-management | 45 | |
| 24 h after FPI | 14 | |
| 1 week after FPI | 11 | |
| 6 weeks after FPI | 8* | |
| *P<0.05 compared with 6 weeks after FPI in model group. | ||
已有研究[2, 3, 4, 6, 8]证明:在多种癫痫动物模型中,CB1受体的水平会发生改变,CB1受体在癫痫的发生过程中可能发挥重要作用。CB1受体同时存在于谷氨酸能和GABA能神经纤维末梢的突触前膜,对突触递质的释放起到负反馈抑制作用[9, 10, 11],但其在癫痫发生中的作用尚存在争议。目前多数研究[6, 8, 12]认为:激动CB1受体产生的是抗惊厥作用;而利莫那班作为CB1受体的拮抗剂,可起到增加大鼠癫痫易感性的作用;只有少数研究[4]提出相反意见。但目前关于外伤后大鼠的行为学表现、CB1受体和利莫那班作用的研究尚少且结论仍有争议,本研究就相关问题进行了分析。
本研究建立了大鼠颅脑外伤模型,利用戊四唑诱导癫痫发生,观察外伤后的癫痫易感性。本研究结果显示:外伤后大鼠的癫痫易感性逐渐变化,而利莫那班在外伤急性期和慢性期的作用也不同。打击后24 h腹腔注射戊四唑,模型组大鼠癫痫发生的潜伏期与空白对照组比较差异无统计学意义,而模型处理组大鼠癫痫发生的潜伏期则明显缩短,说明外伤急性期时大鼠的癫痫易感性并未发生明显变化,此时应用利莫那班可以增加大鼠的癫痫易感性。本文作者推测:由于利莫那班为CB1受体的拮抗剂,其增加癫痫易感性的作用可能是通过拮抗CB1受体、导致受体失活所致;进而推测外伤急性期CB1受体发挥了降低癫痫易感性的作用,这与既往对其他大鼠癫痫模型的研究[13, 14]结论相同。本文作者推测:在外伤急性期,CB1受体主要分布在谷氨酸能纤维末梢,CB1受体的激活可产生抑制谷氨酸递质释放的作用,从而产生降低癫痫易感性的作用。而利莫那班拮抗了CB1受体的活性,降低了其对谷氨酸能纤维的负反馈抑制作用,谷氨酸递质的增加导致了大鼠兴奋性的上升,增加了癫痫易感性。当然,这一推测还需要对CB1受体表达水平进行检测来证实。
本研究结果显示:在打击后6周时,大鼠行为学的结果较打击后24 h发生了明显变化,模型组大鼠癫痫发生的潜伏期明显缩短,提示颅脑外伤慢性期时大鼠癫痫易感性较之急性期增加。而模型处理组大鼠癫痫发生的潜伏期则较之前延长,且发生GTCS的大鼠数量亦较模型组明显减少,说明外伤后早期应用利莫那班可以降低慢性期时癫痫发生的易感性。这与Echegoyen等[4]的研究结论相似。综合以上结果本文作者认为:①外伤后大鼠的癫痫易感性随着时间的延长逐渐增加;②早期应用利莫那班虽然可短暂地增加癫痫易感性,但可以降低外伤慢性期的癫痫易感性,利莫那班可能阻断外伤后慢性期癫痫发生的病理生理过程;③这种阻断癫痫发生的作用通过早期1次用药即可实现。
液压打击后大鼠癫痫易感性和利莫那班的作用是逐渐变化的。模型组大鼠的癫痫易感性随着时间延长而逐渐增加,而模型处理组大鼠的癫痫易感性则逐渐下降,本文作者推测这一效应可能是由于利莫那班改变了外伤后的一些病理生理反应所致。本文作者推测:大鼠颅脑外伤后CB1受体的分布可能发生了一系列的变化。外伤急性期CB1受体主要分布在谷氨酸能神经末梢,抑制谷氨酸的释放,降低癫痫易感性。由于外伤的影响,其分布可能发生了改变。外伤后6周时,CB1受体主要分布在GABA能神经末梢,抑制GABA递质的释放,促进慢性期癫痫的发生,但其具体机制仍需进一步对CB1受体分子学及组织学的研究来证实。
综上所述,本研究建立了大鼠颅脑外伤模型,并成功地利用戊四唑诱导癫痫发生,测定外伤后大鼠的癫痫易感性,证实了该方法的可行性,为后续的实验提供了方法学基础。对大鼠颅脑外伤后癫痫模型研究显示:外伤后早期应用利莫那班可以降低外伤慢性期癫痫的易感性和阻断癫痫的发生,这可能是由于其改变了外伤后导致癫痫的病理生理反应,为后续实验提供了支持。利莫那班目前在多个国家批准作为减肥药上市,而尚无国家将其应用为预防外伤后癫痫的药物。利莫那班虽然在动物实验中可以发挥一定的预防癫痫的作用,但由于其必须在外伤后尽快给药才有效,因此在临床上将其作为外伤后癫痫的预防用药的意义仍需继续探索;而上述结果的可能机制也有待于对CB1受体的分子学和组织学的研究来进一步揭示。
| [1] | 丁成赟,赵永青,李志梅,等.448例症状性癫痫的病因分析[J].中华神经外科杂志,2006,22(9):541-543. |
| [2] | Marsicano G,Goodenough S,Monory K,et al.CB1 cannabinoid receptors and on-demand defense against excitotoxicity[J].Science,2003,302(5642):84-88. |
| [3] | Bojnik E,Turunc E,Armagan G,et al.Changes in the cannabinoid (CB1) receptor expression level and G-protein activation in kainic acid induced seizures[J].Epilepsy Res,2012,99(1/2):64-68. |
| [4] | Echegoyen J,Armstrong C,Morgan RJ,et al.Single application of a CB1 receptor antagonist rapidly following head injury prevents long-term hyperexcitability in a rat model[J].Epilepsy Res,2009,85(1):123-127. |
| [5] | 孙振兴,张 凯,张 弨.外侧液压打击诱导大鼠外伤后癫痫模型的制作[J].立体定向和功能性神经外科杂志,2010,23(3):146-150. |
| [6] | Wallace MJ,Blair RE,Falenski KW,et al.The endogenous cannabinoid system regulates seizure frequency and duration in a model of temporal lobe epilepsy[J].J Pharmacol Exp Ther,2003,307(1):129-137. |
| [7] | Huang Q,Liu L,Hu B,et al.Decreased seizure threshold in an eclampsia-like model induced in pregnant rats with lipopolysaccharide and pentylenetetrazol treatments[J].PLoS One,2014,9(2):e89333. |
| [8] | Vinogradova LV,Shatskova A,van Rijn CM.Pro-epileptic effects of the cannabinoid receptor antagonist SR141716 in a model of audiogenic epilepsy[J].Epilepsy Res,2011,96(3):250-256. |
| [9] | Armstrong C,Morgan RJ,Soltesz I.Pursuing paradoxical proconvulsant prophylaxis for epileptogenesis[J].Epilepsia,2009,50(7):1657-1669. |
| [10] | Lutz B.On-demand activation of the endocannabinoid system in the control of neuronal excitability and epileptiform seizures[J].Biochem Pharmacol,2004,68(9):1691-1698. |
| [11] | Tantimonaco M,Ceci R,Sabatini S,et al.Physical activity and the endocannabinoid system:an overview[J].Cell Mol Life Sci,2014,71(14):2681-2698. |
| [12] | Deshpande LS,Sombati S,Blair RE,et al.Cannabinoid CB1 receptor antagonists cause status epilepticus-like activity in the hippocampal neuronal culture model of acquired epilepsy[J].Neurosci Lett,2007,411(1):11-16. |
| [13] | Kozan R,Ayyildiz M,Agar E.The effects of intracerebroventricular AM-251,a CB1-receptor antagonist,and ACEA,a CB1-receptor agonist,on penicillin-induced epileptiform activity in rats[J].Epilepsia,2009,50(7):1760-1767. |
| [14] | Chen K,Neu A,Howard A,et al.Prevention of plasticity of endocannabinoid signaling inhibits persistent limbic hyperexcitability caused by developmental seizures[J].J Neurosci,2007,27(1):46-58. |
 2016, Vol. 42
2016, Vol. 42


