扩展功能
文章信息
- 王珺, 张利剑, 夏鹤春, 梁雪云, 王亚平
- WANG Jun, ZHANG Lijian, XIA Hechun, LIANG Xueyun, WANG Yaping
- 低氧诱导的大鼠嗅黏膜来源嗅鞘细胞自噬及其对细胞增殖能力的影响
- Effect of autophagy inducedby hypoxia on cell proliferation in olfactory ensheathing cells from olfactory mucosa of rats
- 吉林大学学报(医学版), 2016, 42(03): 430-434
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 430-434
- 10.13481/j.1671-587x.20160303
-
文章历史
- 收稿日期: 2015-12-02
2. 宁夏医科大学总医院神经外科, 宁夏 银川 750004;
3. 宁夏医科大学总医院干细胞研究所, 宁夏 银川 750004
2. Department of Neurosurgery, General Hospital, Ningxia Medical University, Yinchuan 750004, China;
3. Institute of Human Stem Cells, General Hospital, Ningxia Medical University, Yinchuan 750004, China
目前临床针对脊髓损伤仍无理想的治愈方法。脊髓原发性损伤后可触发一系列继发性损伤,包括局部缺血、血管破裂、神经性炎症、氧化应激、兴奋性中毒、脱髓鞘和细胞死亡等,这一系列继发性损伤的微环境会影响周围神经元的存活及神经元功能的恢复。嗅鞘细胞(olfactory ensheathing cells,OECs)移植已经成为治疗脊髓损伤最有前途的策略之一[1]。OECs是一种来源于嗅黏膜和嗅球的特殊类型的神经胶质细胞,是嗅觉系统神经元的延续。研究[2]表明:OECs展现出促进脊髓损伤轴突再生的独特能力,并且OECs能分泌大量的神经营养因子,促进神经元分化及分化后神经元轴突的生长[3]。还有研究[4, 5]将OECs移植入脊髓损伤鼠模型,其促进了中枢神经系统神经元轴突和髓鞘再生,并且有部分的运动功能恢复[6, 7]。目前已有研究者[8]尝试采用一种无创的方法从嗅黏膜获取细胞并自体移植入患者体内进行治疗。移植的OECs很好地整合到了宿主脊髓并能够使脊髓再生和功能恢复[2]。然而OECs移植入脊髓损伤微环境后增殖与存活的机制尚不明确。研究[9]表明:脊髓损伤后细胞自噬是一种细胞保护机制,可以拮抗脊髓损伤后的细胞凋亡。但损伤后的微环境是否可以诱导移植的OECs发生自噬,从而影响其细胞生物学特性等相关研究报道较少。本研究探讨低氧条件是否可以诱导OECs发生自噬及自噬对OECs增殖能力的影响,为临床OECs移植治疗脊髓损伤提供依据。
1 材料与方法 1.1 动物、主要试剂和仪器实验动物为2~3 d SD新生鼠4只,由宁夏医科大学实验动物中心提供,动物合格证号:SCXK(宁)2011-0001,雌雄不限,实验过程中对动物的处置符合动物伦理学标准。DEME/F12培养基和胎牛血清购自美国Gibco公司,多聚左旋赖氨酸(Poly-L-lysine,PLL)和3-甲基腺嘌呤(3-MA)购自美国Sigma公司,4%多聚甲醛和DAPI购自中国Solarbio公司,D-Hank’s液购自美国Hyclone公司,Anti-p75 NGF Receptor抗体、Anti-GFAP抗体、FITC驴抗兔IgG和Cy5驴抗山羊IgG购自美国Abcam公司,自噬标志蛋白LC3Ⅰ/Ⅱ、自噬标志基因Beclin 1、β-actin和低氧诱导因子1α(hypoxia inducible factor-1,HIF-1α)购自美国Cell Signaling Technology公司。二氧化碳培养箱Gal-axy170R和离心机45430R购自德国Eppendorf公司,倒置相差显微镜和激光共聚焦显微镜FV1000购自日本Olympus公司。
1.2 OECs的分离、纯化和培养将新生鼠脱颈法处死,采用75%乙醇消毒,矢状纵切开,钳取鼻黏膜上鼻甲处和鼻中隔上部两侧尽可能多的黏膜,放入预冷的D-Hank’s液中,清洗2~3次,去除表面血污,在解剖显微镜下仔细剥离鼻黏膜表面的黏膜组织。将剥离好的黏膜组织转移至新的培养皿中并滴加预冷的DMEM/F12培养基,用眼科剪将黏膜组织剪碎,800 r·min-1离心5 min,弃上清,加入Triple Express消化液吹打制成嗅黏膜细胞悬液,37℃培养箱中消化1 h。用含10%FBS的DMEM/F12培养基终止消化,800 r·min-1离心5 min,弃上清,加入完全培养基吹打混匀,接种于未包被的培养皿中,置于37℃、5%培养箱内培养。根据改良的Nash差速贴壁法[10],在12和24h时2次差速贴壁,将OECs培养液转种至用0.1g·L-1 PLL包被的培养皿内继续培养。48 h后半量换液,继续培养,期间每48 h全量换液1次。每天在相差显微镜下观察细胞增殖情况,定期摄片,待细胞长满培养皿,进行传代,冻存。以正常条件下培养的OECs作为对照组,采用氧浓度为2%低氧条件培养的OECs作为低氧处理组,采用自噬抑制剂3-MA处理后继续在低氧条件下培养的OECs作为3-MA低氧处理组,在相差显微镜下观察各组细胞形态。
1.3 免疫细胞化学染色法鉴定OECs和测定纯度选取增殖情况较好的第5代OECs接种至含有盖玻片的24孔板中培养,24 h后用PBS清洗3次,每次2 min;4%多聚甲醛室温固定15 min,PBS清洗3次,每次5 min;0.3%TritonX-100细胞破膜20 min,3%过氧化氢处理10 min,PBS清洗3次,每次5 min;5%BSA室温封闭1 h;加入兔单克隆抗体NGFR P75(1:200),山羊多克隆抗体GFAP(1:200),4℃冰箱过夜;PBS洗3次,每次10 min,加入驴抗兔FITC(1:500)和驴抗山羊Cy5(1:1 000),避光室温孵育1 h,PBS洗3次,每次10 min,DAPI染色3 min,PBS洗3次,每次10 min,防淬灭剂封片,激光共聚焦显微镜下观察并记录结果。随机选取10个非重复视野,根据纯度公式计算OECs纯度。OECs纯度=FITC和Cy5双阳性的细胞数/DAPI标记的总细胞数×100%。
1.4 Western blotting法检测各组OECs中HIF-1α、LC3Ⅰ/Ⅱ和Beclin 1表达水平将OECs分为对照组、4h低氧处理组(氧浓度为2%的细胞培养条件模拟脊髓损伤后低氧内环境)和8h低氧处理组。提取各组OECs总蛋白。按照BCA蛋白定量试剂盒进行蛋白定量,加入SDS上样buffer(loading buffer),95~100℃煮沸5 min。采用检测蛋白质的SDS-PAGE凝胶电泳技术,80 V电压转膜1h,加封闭液(5%脱脂奶粉溶于PBST中),室温封闭1 h,加入一抗LC3Ⅰ/Ⅱ、Beclin 1、β-actin和HIF-α(1:1 000)溶液,4℃过夜;TBST液洗膜3次,每次10 min,加辣根过氧化物酶标记的二抗(1:5 000),室温孵育2 h,TBST液洗膜3次,每次10 min。采用ECL发光试剂盒曝光,经Quantityone图像分析软件计算目的条带和内参条带的灰度值。实验重复3次,取平均值。
1.5 CCK-8检测细胞增殖曲线将OECs分为对照组、3-MA处理组(终浓度5μmol·L -1的3-MA处理2 h后同对照组)、低氧处理组(氧浓度为2%的细胞培养条件模拟脊髓损伤后低氧内环境)、3-MA低氧处理组(终浓度5μmol·L-1的3-MA处理2 h后同低氧处理组)。取增殖情况较好的第5代OECs,按每孔2×102个OECs接种于96孔板,每组设5个复孔。分别于第1、2、3、4和5天,每孔加入10 μL CCK-8溶液,培养箱中孵育1 h,吸上清与酶标板中,采用酶联免疫检测仪于450 nm波长处测定其吸光度(A)值,并绘制生长曲线,A值越大,细胞增殖能力越强。
1.6 统计学分析采用SPSS17.0统计软件进行统计学分析。各组OECs中HIF-1α、LC3Ⅰ/Ⅱ和Beclin 1表达水平以x± s 表示,组间比较采用t检验。以α=0.05为检验水准。
2 结 果 2.1 SD新生鼠嗅黏膜来源OECs形态经原代分离、提纯培养的第3代SD新生鼠嗅黏膜来源OECs的生物学特性:大多数细胞呈梭形,表现为典型的双极、三极细胞形态(图 1A)。低氧处理组和3-MA低氧处理组OECs在相差显微镜下的对比图像显示细胞形态无明显差异(图 1B和C)。

|
| A: Control group; B: Hypoxia group; C: 3-MA+hypoxia group. 图 1 经原代分离、提纯培养的第3代SD新生鼠OECs形态(×10) Fig. 1 Morphology of OECs at P3 of SD neonatal rats after primary isolation and purification(×10) |
DAPI染料染细胞核,共聚焦显微镜下核染呈蓝色(图 2A,见插页一),FITC二抗标记染色,神经系统星形胶质细胞活化标志物GFAP镜下呈绿色,且与细胞核共染(图 2B,见插页一);Cy5二抗标记染色OECs特异免疫性细胞表面标志物NGFRp75镜下呈红色,且与细胞核共染(图 2C,见插页一);DAPI、GFAP、NGFRp75共染(图 2D,见插页一)。共聚焦显微镜下FITC和Cy5双染阳性的为OECs。随机选取10个非重复视野,根据计算公式,其纯度达87%。
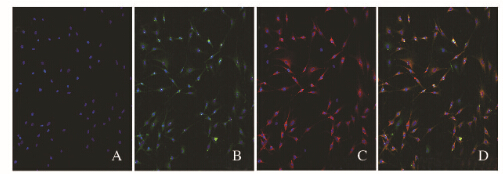
|
| A: Nucieus stained by DAPI; B: protein(GFAP)stained by FITC; C: protein (NGFRp75) stained by Cy5;D: Nucleus and Proteins co-stained by FITC and Cy5. 图 2 共聚焦显微镜下观察FITC和Cy5双染阳性OECs形态表现(×10) Fig. 2 Morphology of OECs stained by FITC and Cy5 under confocal laser scanning confocal microscope(×10) |
与对照组(1.00±0.00)比较,4 h(2.27±0.13)和8 h(3.22±0.08)低氧处理组OECs中HIF-1α的表达水平明显升高(P<0.05)。见图 3。
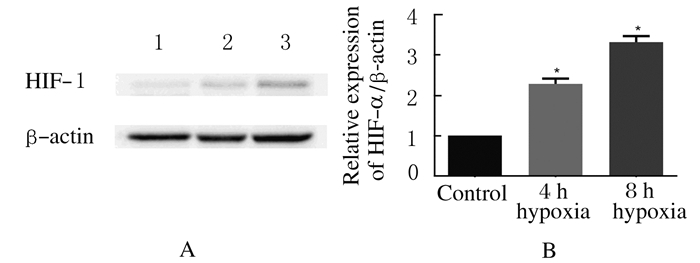
|
| A:Electrophoregram;Lane 1: Control group; Lane 2: 4 h hypoxia group; Lane 3: 8 h hypoxia group.B:Histogram;*P<0.05vs control group. 图 3 各组OECs中HIF-1α表达水平 Fig. 3 Expression levels of HIF-1α in OECs in various groups |
与对照组(1.00±0.00)比较,4 h(1.45±0.04)和8 h(1.60±0.02)低氧处理组OECs中LC3Ⅰ向LC3Ⅱ的转化明显,即LC3Ⅰ/Ⅱ表达水平升高(P<0.05);与对照组(1.00±0.00)比较,4 h(1.48±0.01)和8 h(1.56±0.04)低氧处理组OECs中Beclin-1的表达水平升高(P<0.05)。见图 4。
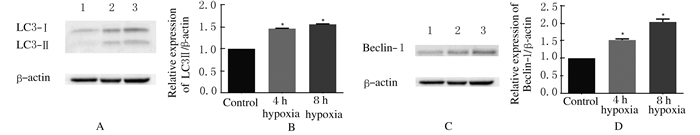
|
| A, B: LC3Ⅰ/Ⅱ; C, D: Beclin-1.A, C: Electrophoregram;Lane 1: Control group; Lane 2: 4 h hypoxia group; Lane 3: 8 h hypoxia group.B,D:Histogram;*P<0.05vs control group. 图 4 各组OECs中LC3Ⅰ/Ⅱ和Beclin-1表达水平 Fig. 4 Expression levels of LC3Ⅰ/Ⅱand Beclin-1 in OECs in various groups |
与对照组比较,3-MA处理组OECs的增殖能力无明显变化;与低氧处理组比较,3-MA低氧处理组中OECs增殖能力降低。见图 5。
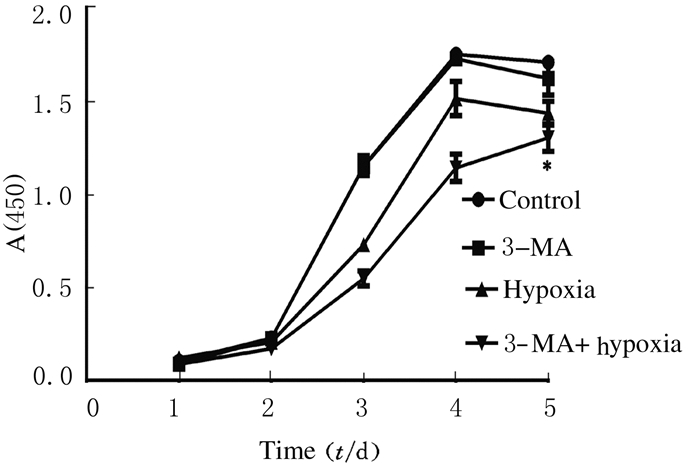
|
| 图 5 各组OECs的增殖曲线 Fig. 5 Proliferation curves of OECs in various groups |
由于各种原因造成的脊髓损伤严重影响患者生活质量,目前临床尚无理想的治疗手段。研究[11]表明:OECs因其具有多种细胞学的特性,OECs移植已经成为临床治疗脊髓损伤最具有应用前景的治疗手段之一。临床和体内实验的数据[12, 13]表明:脊髓损伤往往伴随着一个级联的继发性损伤,包括缺氧、炎症、氧自由基诱导的细胞死亡、细胞骨架的降解和诱导的细胞凋亡。此外,缺氧诱导几种神经递质的释放,如谷氨酸可以导致兴奋性神经元死亡[14]。在近十年里,一些细胞类型如胚胎干细胞、神经干细胞、雪旺细胞和OECs已经用于移植。最近有研究[15]表明:OECs移植后,OECs在脊髓损伤部位的迁移距离更长,迁移能力优越,同时移植后的OECs展现出了其在受损部位突出的促进受损神经轴突再生的能力。一些学者认为:OECs不直接作用于轴突使其再生,但能够创造一个良好的环境有利于损伤部位的修复。总之,针对OECs移植入脊髓损伤微环境后其增殖与存活机制的相关研究,目前尚无明确的结论。
自噬是细胞中物质成分利用溶酶体被降解过程的统称。某些情况下,细胞可启动自噬来清除受损的线粒体,提高细胞对低氧的耐受力,对细胞起到一定的保护作用。自噬与许多疾病的发生有关联,研究[16, 17]表明:细胞自噬的水平升高是神经组织细胞对损伤的保护性反应,这已经在脑缺血和脑外伤的动物实验中得到了验证。还有研究[19]表明:脊髓损伤后脊髓神经元细胞及胶质细胞中均有细胞自噬表达,自噬相关基因Beclin1和LC3B在脊髓损伤后表达水平升高,并呈现一定的时间依赖性。脊髓损伤后细胞自噬的表达是神经细胞拮抗凋亡的自我保护机制。但是,关于脊髓损伤后的微环境是否可以诱导移植的OECs发生自噬,从而影响其细胞生物学特性等相关研究报道较少。
本研究采用体外低氧细胞培养模型模拟脊髓继发性损伤中的缺氧状态,研究缺氧状态是否能够诱导OECs自噬并探索自噬对OECs增殖能力的影响。本研究结果表明:低氧状态下,SD新生鼠嗅黏膜来源OECs表达自噬相关蛋白,证明低氧状态能够诱导OECs发生自噬。此外,本文作者发现:自噬抑制剂3-MA可有效抑制低氧状态SD新生鼠嗅黏膜来源OECs的增殖能力,提示低氧诱导的自噬对SD新生鼠嗅黏膜来源的OECs的增殖能力具有调控作用。
深入研究OECs移植治疗脊髓损伤的作用和机制,必将促进临床OECs移植治疗的应用。本研究结果为临床应用OECs移植治疗疾病提供了一定的理论依据。
| [1] | Tabakow P,Jarmundowicz W,Czapiga B,et al.Transplantation of autologous olfactory ensheathing cells in complete human spinal cord injury [J].Cell Transplant,2013.doi:10.3727/096368913×663532. |
| [2] | Dlouhy BJ,Awe O,Rao RC,et al.Autograft-derived spinal cord mass following olfactory mucosal cell transplantation in a spinal cord injury patient:Case report [J].J Neurosurg Spine,2014,21(4):618-622. |
| [3] | Sethi R,Sethi R,Redomod A,et al.Olfactory ensheathing cells promote differerntiation of neural stem cells and robust neurite extension [J].Stem Cell Rev,2014,10(6):772-785. |
| [4] | Brenner C,Kroemer G.Apoptosis.Mitochondria-the death signal integrators [J].Science,2000,289(5482):1150-1151. |
| [5] | Cao L,Liu L,Chen ZY,et al.Olfactory ensheathing cells genetically modified to secrete GDNF to promote spinal cord repair [J].Brain,2004,127(Pt 3):535-549. |
| [6] | Cui Q,Pollett MA,Symons NA,et al.A new approach to CNS repair using chimeric peripheral nerve grafts [J].J Neurotrauma,2003,20(1):17-31. |
| [7] | Takami T,Oudega M,Bates ML,et al.Schwann cell but not olfactory ensheathing glia transplants improve hindlimb locomotor performance in the moderately contused adult rat thoracic spinal cord[J].J Neurosci,2002,22(15):6670-6681. |
| [8] | Kachramanoglou C,Law S,Andrews P,et al.Culture of olfactory ensheathing cells for central nerve repair:the limitations and potential of endoscopic olfactory mucosal biopsy [J].Neurosurgery,2013,72(2):170-179. |
| [9] | 潘文明.大鼠脊髓损伤后细胞自噬的表达及作用的实验研究 [D].苏州:苏州大学,2010. |
| [10] | Nash HH,Borke RC,Anders JJ.New method of purification for establishing primary cultures of ensheathing cells from the adult olfactory bulb [J].Glia,2001,34(2):81-87. |
| [11] | Roet KC,Verhaagen J.Understanding the neural repair-promoting properties of olfactory ensheathing cells [J].Exp Neurol,2014,261:549-609. |
| [12] | Engel DC,Slemmer JE,Vlug AS,et al.Combined effects of mechanical and ischemic injury to cortical cells:secondary ischemia increases damage and decreases effects of neuroprotective agents [J].Neuropharmacology,2005,49(7):985-995. |
| [13] | Paspala SA,Vishwakarma SK,Murthy TV,et al.Potential role of stem cells in severe spinal cord injury:current perspectives and clinical data [J].Stem Cells Cloning,2012,5:15-27. |
| [14] | Sun C,Meng Q,Zhang L,et al.Glutamate attenuates IGF-1 receptor tyrosine phosphorylation in mouse brain:possible significance in ischemic brain damage [J].Neurosci Res,2012,74(3/4):290-297. |
| [15] | Su Z,He C.Olfactory ensheathing cells:biology in neural development and regeneration [J].Prog Neurobiol,2010,92(4):517-532. |
| [16] | Diskin T,Tal-Or P,Erlich S,et al.Closed head injury induces upregulation of Beclin 1 at the cortical site of injury [J].J Neurotrauma,2005,22(7):750-762. |
| [17] | Adhami F,Liao G,Morozov YM,et al.Cerebral ischemia-hypoxia induces intravascular coagulation and autophagy [J].Am J Pathol,2006, 169(2):566-583. |
 2016, Vol. 42
2016, Vol. 42


