扩展功能
文章信息
- 朱伟, 黎桂仙, 陈洪浪, 尹金宝, 姜恩平
- ZHU Wei, LI Guixian, CHENG Honglang, YIN Jinbao, JIANG Enping
- CSF2A融合基因真核表达载体的构建及其对EBV+肿瘤细胞增殖和凋亡的影响
- Construction of CSF2A fusion gene recombinant eukaryotic expression vector and its effect on proliferation and apoptosis of EBV+ tumor cells
- 吉林大学学报(医学版), 2016, 42(03): 424-429
- Journal of Jilin University (Medicine Edition), 2016, 42(03): 424-429
- 10.13481/j.1671-587x.20160302
-
文章历史
- 收稿日期: 2015-10-06
2. 广东医学院药理学教研室, 广东 东莞 523808
2. Department of Phamacology, Guangdong Medical University, Dongguan 523808, China
爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)是一种重要的致瘤病毒,与伯基特淋巴瘤和何杰金病等多种淋巴系统恶性肿瘤的发生发展有密切关联。研究[1, 2, 3]显示:该病毒也参与上皮性肿瘤的发生,如鼻咽癌和部分胃癌组织中发现有EBV基因组的存在。EBV阳性(EBV+)肿瘤组织和正常组织的差别在于肿瘤组织均有EBV基因的表达而正常组织无EBV基因的表达,可以利用这一特点对肿瘤细胞进行特异性杀伤同时又不损害正常细胞。文献[4]报道:将EBV潜伏膜蛋白2A(latent membrane protein 2A,LMP2A)基因的表达载体转染抗原提呈细胞如树突状细胞(dendritic cells,DC)等,可诱导特异性细胞毒性T淋巴细胞(cytotoxic Tlymphocyte,CTL)杀伤肿瘤细胞。粒细胞-巨噬细胞集落刺激因子(gramulocyte-macrophase colony stimulating factor,GM-CSF)是调节DC作用最强的细胞因子,对DC的分化与增殖、体内的分布和各种抗原提呈功能均有重要作用。研究[5, 6]表明:GM-CSF转移至肿瘤细胞中可以增强机体对肿瘤细胞的免疫,提高机体特异性的抗肿瘤反应能力。本课题组曾将该2组基因进行融合构建腺病毒载体研究结果显示:腺病毒载体感染效率虽较高,但是仅瞬时表达且会诱发强烈的炎症反应和免疫反应。因此,本课题组选用pIRES2-eGFP质粒载体,消除了腺病毒载体的缺点,转染真核细胞后能够方便检测和筛选,并且目的基因可长期稳定表达。采用LMP2A和GM-CSF融合基因杀伤EBV+肿瘤的相关研究尚未见报道。本课题组构建的融合基因可协同发挥LMP2A诱导特异性CTL和GM-CSF抗肿瘤细胞的免疫增强作用,从而更有效杀伤EBV+肿瘤细胞,以期为EBV+肿瘤的治疗提供有效的靶点。
1 材料与方法 1.1 细胞、主要试剂和仪器携带eGFP荧光报告基因的空载质粒pIRES2-eGFP、DH5α菌株和EBV+鼻咽癌CNE2细胞均为本实验室保存。抽取人外周静脉血,用于分离并纯化外周血单个核细胞(peripheral blood monouclear cell,PBMC)与T淋巴细胞。限制性内切酶EcoR Ⅰ和BamH Ⅰ购自美国NEB公司,DNA marker和T4 DNA连接酶购自大连Takara公司,GM-CSF抗体购自美国Abcam公司,脂质体2000购自美国Invitrogen公司,质粒抽提试剂盒购自德国Qiagen公司,RPMI 1640培养基和胎牛血清购自美国Gibco公司,淋巴细胞分离液购自挪威Axis-shield公司,重组人IL-4、重组人GM-CSF和TNF-α购自美国PeproTech公司。SW-CJ-2D(2G)净化工作台购自苏州净化设备公司,GIS-2008天能凝胶成像分析仪购自上海天能科技有限公司,立式电泳仪购自江苏海门市麒麟医用仪器厂,酶标仪Synger2购自美国Biotek公司。
1.2 目的基因扩增根据LMP2A和GM-CSF开放读码框序列[7, 8]分别设计引物,引物由上海生工生物工程技术服务有限公司合成。LMP2A上游引物P1:5′-GGCGAATTCATGGGGTCCCTAGA-AATGGTG-3′;下游引物P2:5′- GCTGCCGCCACCGCCGCTTCCGCCACCGCCGCTTCCACC-GCCACCTACAGTGTTGCGATATGGGGT-3′;GM-CSF上游引物P3:5′-GGTGGCGGTGGAAGCGGCGGTGGCGGAA GCGGCGGTGGCG- GCAGCCTCCTGGACTGGCTCCCA-3′;下游引物P4:5′-GCGATATCTCACTCCTGGACTGGCTC-3′。另外设计LMP2A下游引物P5:5′-GC- GATATCTCAAGTGTTGCGATATGGGGT-3′。上述引物序列下划线部分为linker,斜体部分表示酶切位点。Trizol法提取RNA后采用RevertAid First Strand Cdna Synthesis Kit-K1622试剂盒合成,按照说明书步骤操作。25 μL PCR反应体系中含上下游引物各0.3 mmol·L-1,Taq 1U,cDNA 2 μL。反应条件:94℃、5 min;94℃、 60 s,55℃、60 s,72℃、90 s,35个循环;72℃、10 min。产物于0.8%琼脂糖凝胶电泳30 min后检测结果。
1.3 基因克隆和真核表达载体构建PCR扩增获得LMP2A和带有linker互补序列的LMP2A和GM-CSF。而后以重叠延伸原理[9]进行基因重组得到CSF2A并将之插入TA载体。将真核表达载体pIRES2-eGFP与大量扩增的目的基因CSF2A回收产物分别同时进行双酶切。双酶切反应体系容量为50 μL,包括限制性内切酶EcoR Ⅰ和BamH Ⅰ各1 μL,10×NEBBuffer5 μL,DNA 1 μg,以无菌去离子水补至50 μL。目的基因CSF2A酶切产物用PCR产物回收试剂盒纯化,将真核表达载体pIRES2-eGFP酶切产物行凝胶电泳,凝胶回收试剂盒纯化回收。将回收产物用T4 DNA连接酶连接,连接反应体系容量为10 μL,包括T4 DNA Ligase 1 μL,10×T4 DNA Ligase Buffer 1 μL,CSF2A和pIRES2-eGFP的比例为10:1,置于PCR仪上16℃连接过夜。
1.4 pIRES2-CSF2A真核表达载体的鉴定将连接产物转化入DH5α感受态细胞,将转化的DH5α感受态菌液涂布于含30 g·L-1卡那霉素的LB平板上,37℃培养12~16 h,长出的单个菌落即为转化的菌落。挑取单克隆,在含30 g·L-1卡那霉素的LB液体培养基中37℃振荡培养12~16 h。将含符合目的基因大小的菌液用碱裂解法小量提取质粒DNA,PCR法扩增质粒上的目的基因,凝胶电泳鉴定扩增产物。
1.5 Western blotting法检测DC中CSF2A融合蛋白的表达根据文献[10]分离培养和鉴定并获取DC与T淋巴细胞进行后续实验。设pIRES2-eGFP空质粒转染组和pIRES2-LMP2A质粒转染组为对照组,pIRES2-CSF2A质粒转染组为实验组,分别转染DC 48 h后收集细胞提取总蛋白。10% SDS-PAGE电泳,转至PVDF膜后5%脱脂奶粉4℃过夜,然后,融合基因CSF2A编码产物与GM-CSF的抗体室温孵育3~4 h,二抗室温孵育2 h,ECL系统显色反应。
1.6 MTT法检测细胞增殖抑制率将经鉴定后的成熟DC离心,加入RPMI1640调整细胞浓度为1×105mL-1,加入96孔板中,每孔100 μL。转染pIRES2-CSF2A重组质粒,以pIRES2-eGFP空质粒转染组和pIRES2-LMP2A质粒转染组为对照组。转染48 h后,加入T淋巴细胞,每孔100 μL,共培养72 h。将EBV+ CNE2细胞用RPMI 1640培养液稀释成1×104 mL-1,接种至96孔细胞培养板中,每孔200 μL培养基,并于37℃、5%CO2培养箱中静置培养;每组设6个复孔,每孔分别于贴壁的EBV+ CNE2肿瘤细胞中加入200 μL上述DC与T淋巴细胞共培养细胞培养液上清,作用12、24、48和72 h后分别取出培养板,每孔加入20 μL MTT(5 g·L-1),继续培养4 h后小心弃去上清,然后每孔加入150 μL DMSO,于酶标板振荡器上振摇10 min后于490 nm处测定各孔吸光度(A)值,计算各组细胞增殖抑制率。细胞增殖抑制率=(对照组A值-实验组A值/对照组A值)×100%。
1.7 Hochest法检测细胞凋亡形态表现各组质粒转染的DC细胞与T淋巴细胞共培养后72 h,分别加入至贴壁的EBV+ CNE2细胞培养48 h,然后用4%多聚甲醛固定,放在4℃环境中固定2 h。以0.05 mol·L-1 pH7.0 PBS冲洗3次,自然晾干,1:1 000 Hochest 33342染色,荧光显微镜观察并拍照。
1.8 统计学分析采用SPSS13.0统计软件进行统计学分析。各组EBV+肿瘤细胞增殖抑制率以x± s 表示,组间比较采用单因素方差分析,组间两两比较采用SNK法。以α=0.05为检验水准。
2 结 果 2.1 pIRES2-CSF2A质粒的构建和鉴定pIRES2-CSF2A质粒经EcoR Ⅰ和BamH Ⅰ酶切后电泳,获得长约2 015和5 300bp的目的片段,符合预期结果,表明融合基因已经被正确插入pIRES2-eGFP质粒中(图 1)。测序结果与CSF2A核苷酸序列一致。
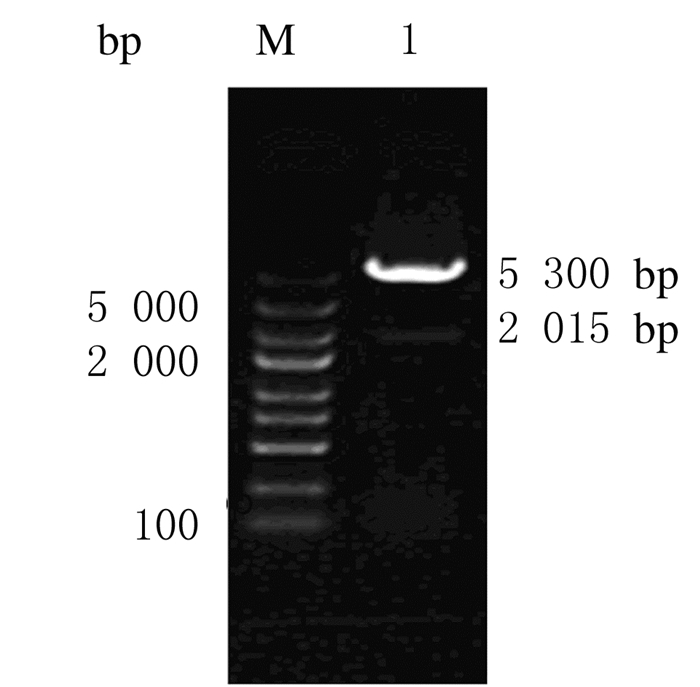
|
| M:5 000 bp DNA marker;Lane 1:PCR product. 图 1 pIRES2-CSFA双酶切产物电泳图 Fig. 1 Electrophoregram of double enzyme digestion product of pIRES2-CSFA |
将pIRES2-CSF2A质粒转染DC。48 h后,荧光显微镜下可见细胞中出现绿色荧光,提示质粒转染成功,目的基因阳性表达。见图 2(插页一)。
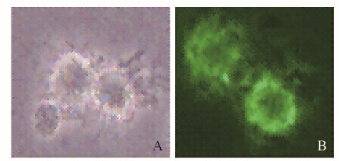
|
| A:DC cells; B: cells transfected by recombinant eukaryotic expression vextor 图 2 重组真核表达载体转染的靶细胞形态表现(×400) Fig. 2 Morphology of target cells transfected by recombinant eukaryotic expression vextor (×400) |
RT-PCR结果:CSF2A融合基因可在DC中扩增,将获取的PCR产物进行琼脂糖电泳,得到长度约2 015 bp的片段,与预期片段长度一致。见图 3。
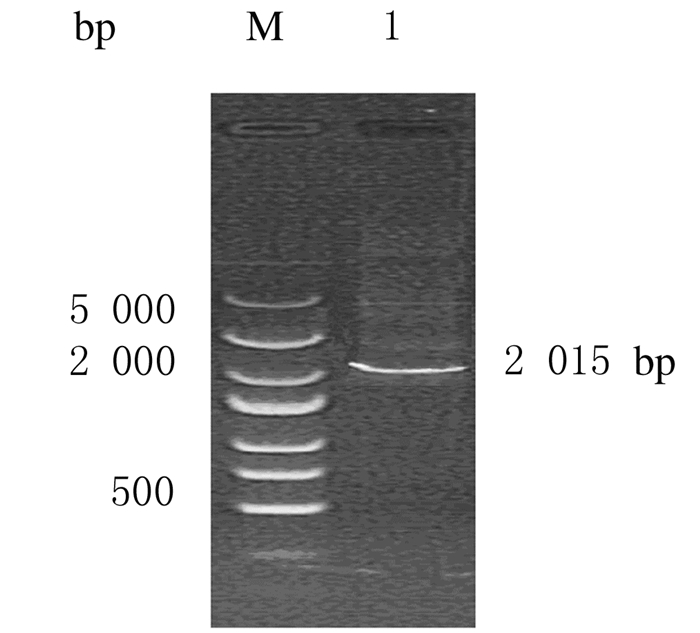
|
| M:5 000 bp DNA marker;Lane 1:PCR product. 图 3 pIRES2-CSF2A转染靶细胞后PCR产物电泳图 Fig. 3 Electrophoregram of PCR product of target cells after pIRES2-CSF2A transfection |
pIRES2-eGFP质粒转染组和pIRES2-LMP2A质粒转染组均无特异蛋白条带表达,而pIRES2-CSF2A质粒转染组出现特异性目的条带,表明CSF2A融合基因在DC中成功表达蛋白。见图 4。

|
| Lane 1: pIRES2-eGFP group; Lane 2: pIRES2-LMP2A group; Lane 3: pIRES2-CSF2A group. 图 4 Western blotting法检测重组真核表达载体目的基因表达电泳图 Fig. 4 Electrophoregram of gene expression of recombinant eukaryotic expression vector detected by Western blotting method |
3种转染质粒作用于EBV+ CNE2细胞后12和24 h,各组细胞增殖抑制率比较差异无统计学意义。作用后48和72 h,与pIRES2-eGFP质粒转染组比较,pIRES2-CSF2A质粒转染组和pIRES2-LMP2A质粒转染组EBV+ CNE2细胞增殖抑制率升高(P<0.05或P<0.01),pIRES2-CSF2A质粒转染组EBV+ CNE2细胞增殖抑制率高于pIRES2-LMP2A质粒转染组(P<0.05)。见表 1。
| (n=6,x± s ,η/%) | ||||
| Group | Inhibitory rate of proliferation | |||
| (t/h) 12 | 24 | 48 | 72 | |
| pIRES2-eGFP | 0 | 0 | 0 | 0 |
| pIRES2-LMP2A | 3.65±0.68 | 8.94±1.43 | 20.85±1.56* | 21.72±2.17* |
| pIRES2-CSF2A | 4.10±0.91 | 14.65±2.14 | 33.71±2.38**△ | 41.43±2.67**△ |
| *P<0.05,** P<0.01 compared with pIRES2-eGFP group; △P<0.05 compared with pIRES2-LMP2A group . | ||||
Hochest33342细胞核染色结果:pIRES2-eGFP质粒转染组EBV+ CNE2细胞核呈圆形或椭圆形,荧光微弱、呈弥散性。pIRES2-CSF2A和pIRES2-LMP2A质粒转染组作用48h后,细胞核致密、浓染,或呈碎块状的蓝色荧光,并可见凋亡小体,提示有染色质固缩的凋亡细胞核改变;pIRES2-CSF2A质粒转染组比pIRES2-LMP2A质粒转染组凋亡小体数量更多。见图 5(插页一)。
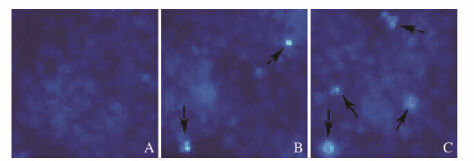
|
| A: pIRES2-eGFP group;B: pIRES2-LMP2A group;B: pIRES2-CSF2A group 图 5 Hochest法检测各组细胞凋亡形态表现(×400) Fig. 5 Apoptoticmorphology of cells in various groups detected by Hochest method(×400) |
免疫基因治疗方法被称为肿瘤的第四大类治疗技术,科学界认为其是最有可能治愈肿瘤的方法,在肿瘤治疗中得到越来越多科学工作者的重视[11, 12]。联合免疫基因疗法的主要策略是将细胞因子基因转染肿瘤细胞或免疫效应细胞增强机体的抗肿瘤免疫反应以及将肿瘤抗原等转染肿瘤细胞或抗原提呈细胞等提高肿瘤的免疫原性。本研究采用剪接式重叠延伸技术构建LMP2A和GM-CSF基因的融合基因,结果表明:该融合基因可协同发挥LMP2A诱导特异性CTL和GM-CSF抗肿瘤免疫的增强作用,对EBV+肿瘤细胞具有更强的促凋亡作用。本研究首次探讨了融合基因CSF2A对EBV+细胞的体外促凋亡作用,期待在后续的体内实验中其能发挥更有效的EBV+肿瘤细胞杀伤效应。
EBV是肿瘤相关病毒,鼻咽癌等肿瘤的发生发展与EBV有密切关联。LMP2A蛋白是鼻咽癌和淋巴瘤等肿瘤细胞中稳定表达的EBV保守抗原,具有潜在的T细胞激活表位,能介导CTL发挥作用[13, 14]。CTL是机体抗肿瘤最主要的效应性淋巴细胞,由肿瘤抗原激活并赋予抗肿瘤的特异性。当今许多学者致力于研究由LMP2A引发的特异性CTL来治疗EBV+肿瘤。GM-CSF是机体重要的细胞因子,其能促进DC增殖与分化,维持DC细胞活力,并且可调节DC的分布和抗原提呈。GM-CSF的表达可激活或募集抗原提呈细胞到肿瘤部位并参与抗肿瘤免疫应答[15]。研究[5, 6]证实:将GM-CSF基因转移至肿瘤细胞后,可增强肿瘤细胞的免疫原性,极大提高机体特异性的抗肿瘤免疫反应。如果将LMP2A和GM-CSF基因联合转入真核表达载体,则可表达2种抗原,既可诱发LMP2A特异性CTL,又可增强抗肿瘤免疫应答,使机体更加有效杀伤EBV+肿瘤细胞。研究[16, 17]表明:联合基因抗肿瘤治疗明显优于单一基因治疗效果,如趋化因子基因、细胞因子基因等与自杀基因联合治疗肿瘤的研究已应用于临床。综上所述,选择GM-CSF和LMP2A基因联合治疗肿瘤是理想的配伍。
本研究采用当今广泛应用的pIRES2-eGFP真核表达质粒,该质粒的特点是含有增强型绿色荧光蛋白报告基因,其表达的蛋白能在蓝色光下激发出绿色荧光,荧光强度比普通荧光蛋白报告基因提高了35倍[18],普通荧光显微镜即可直接观测。与以往本课题组采用的腺病毒载体比较,pIRES2-eGFP质粒载体不会诱发强烈的炎症反应和免疫反应,转染真核细胞后能够方便地检测和抗性筛选,并且目的基因可长期稳定表达。本研究将实验组和对照质粒进行对比,探讨融合基因重组质粒转染EBV+肿瘤细胞抑制增殖及促进凋亡的作用。MTT实验结果证实了pIRES2-CSF2A与pIRES2-LMP2A均对EBV+ CNE2细胞的增殖具有抑制作用,而融合基因CSF2A对EBV+ CNE2细胞有更强的增殖抑制作用。本研究结果显示:这种抑制效应呈现为时间依赖性,转染质粒24 h后,与对照组比较,实验组融合基因对细胞的抑制增殖能力逐渐增强,这可能是由于特异性CTL的作用发挥需要一定的时间。Hochest33342染色结果中细胞形态和细胞核的异常及有凋亡小体的形成均提示CSF2A融合基因通过诱导EBV+ CNE2程序性死亡而发挥细胞毒性作用。与对照组比较,CSF2A融合基因更能明显促进EBV+肿瘤细胞的凋亡,具有更强的诱导凋亡作用,表明融合基因确实具有杀伤EBV+肿瘤细胞的作用,并且联合基因杀伤EBV+肿瘤细胞效果更好。本研究结果表明:选择GM-CSF和LMP2A基因作为联合免疫治疗的靶基因,通过构建pIRES2-CSF2A重组载体的方式能够特异并且明显地促进EBV+肿瘤细胞的凋亡。
本研究结果表明:融合基因CSF2A可以发挥2组基因的协同作用,通过诱导EBV特异性CTL和增强抗肿瘤免疫,更好地抑制EBV+肿瘤细胞增殖,促进细胞凋亡。本研究为EBV+肿瘤的治疗提供了很好的思路,该方法能够在治疗肿瘤的同时而不伤及正常细胞,从而减少治疗的不良反应,以获得更好的治疗效果。
| [1] | Zhang NN,Chen JN,Xiao L,et al.Accumulation mechanisms of CD4(+)CD25(+)FOXP3(+) regulatory T cells in EBV-associated gastric carcinoma [J].Sci Rep,2015,5:18057. |
| [2] | Strong MJ,Xu G,Coco J,et al.Differences in gastric carcinoma microenvironment stratify according to EBV infection intensity:implications for possible immune adjuvant therapy [J].PLoS Pathog,2013,9(5):e1003341. |
| [3] | Xue QJ,Dai J,Li XZ,et al.Construction of a recombinant-BCG containing the LMP2A and BZLF1 genes and its significance in the Epstein-Barr virus positive gastric carcinoma[J].J Med Virol,2014,86(10):1780-1787. |
| [4] | Chen Y,Sun H,Liu G,et al.EBV LMP2A-specific T cell immune responses elicited by dendritic cells loaded with LMP2A protein [J].Cell Mol Immunol,2009,6(4):269-276. |
| [5] | Huang CC,Kuo KK,Cheng TC,et al.Development of membrane-bound GM-CSF and IL-18 as an effective tumor vaccine [J].PLoS One,2015,10(7):e0133470. |
| [6] | Xu H,Wang Q,Lin C,et al.Synergism between cryoablation and GM-CSF:enhanced immune function of splenic dendritic cells in mice with glioma [J].Neuroreport,2015,26(6):346-353. |
| [7] | Baer R,Bankier AT,Biggen MD,et al.DNA sequence and expression of the B95-8 Epstein-Barr virus[J].Nature,1984,310(5974):207-211. |
| [8] | Wong G,Witek J,Temple P,et al.Human GM-CSF:molecular cloning of the complementary DNA and purification of the natural and recombinant proteins [J].Science,1985,228(4701):810-815. |
| [9] | Böttcher R,Hollmann M,Merk K,et al.Efficient chromosomal gene modification with CRISPR/cas9 and PCR-based homologous recombination donors in cultured Drosophila cells [J].Nucleic Acids Res,2014,42(11):e89. |
| [10] | 蔡学敏,朱向情,刘 凌,等.人外周血树突状细胞的诱导、鉴定及活性测定[J].中华细胞与干细胞杂志:电子版,2012,2(4):231-236. |
| [11] | Lichtor T,Glick RP.Immunogene therapy[J].Adv Exp Med Biol,2012,746:151-165. |
| [12] | Evans CH,Ghivizzani SC,Robbins PD.Getting arthritis gene therapy into the clini [J].Nat Rev Rheumatol,2011,7(4):244-249. |
| [13] | Brewin J,Mancao C,Straathof K,et al.Generation of EBV-specific cytotoxic T cells that are resistant to calcineurin inhibitors for the treatment of posttransplantation lymphoproliferative disease [J].Blood,2009,114(23):4792-4803. |
| [14] | Berthomé M,Gallot G,Vivien R,et al.Viral DNA contamination is responsible for Epstein-Barr virus detection in cytotoxic T lymphocytes stimulated in vitro with Epstein-Barr virus B-lymphoblastoid cell line [J].Cancer Immunol Immunother,2010,59(12):1867-1875. |
| [15] | Lee CH,Yeh TH,Lai HC,et al.Epstein-Barr virus zta-Induced immunomodulators from nasopharyngeal carcinoma cells upregulate interleukin-10 production from monocytes [J].J Virol,2011,85(14):7333-7342. |
| [16] | Glasgow JN,Everts M,Curiel DT.Transductional targeting of adenovirus vectors for gene therapy [J].Cancer Gene Ther,2006,13(9):830-844. |
| [17] | 段秀梅,邹亚斌,马洪喜,等.结核杆菌热休克蛋白70刺激表位在融合基因疫苗中的佐剂作用[J].吉林大学学报:医学版,2012,38(3):506-511. |
| [18] | Jin J,Wang B,Zhu Z,et al.Construction of a recombinant eukaryotic expression vector containing a leptin gene and its expression in HPMSCs[J].Cytotechnology,2014,66(3):471-479. |
 2016, Vol. 42
2016, Vol. 42


