扩展功能
文章信息
- 朱超婕, 朱超, 李光宇, 裴颖
- Ca2+与Calpain在白内障形成过程中作用及其机制的研究进展
- Advance research on roles of Ca2+ and Calpain in formation of cataract and their mechanisms
- 吉林大学学报(医学版), 2016, 42(02): 414-418
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 414-418
- 10.13481/j.1671-587x.20160243
-
文章历史
- 收稿日期: 2015-10-26
白内障是目前世界最常见的、可治愈的致盲性眼病[1, 2]。自被发现以来,其主要的发病机制和治疗方法一直是国内外眼科学者研究和关注的热点。目前通过手术摘除混浊的晶状体是治疗白内障唯一确切有效的方法。白内障超声乳化吸除联合人工晶状体植入术,作为21世纪眼科学发展的里程碑,用人工晶状体替代病变的混浊晶状体,并且伴随人工晶状体工艺的不断改进,使白内障手术由复明手术时代进入屈光手术时代。然而白内障患者数量的不断增长和手术医生资源的匮乏之间的不平衡、高额的手术费用以及个别患者术后出现的并发症等问题成为白内障患者获得有效治疗的主要障碍。另外,人工晶状体无论材质上如何创新、功能上如何改善也无法完美地替代人自身的晶状体。因此,白内障非手术治疗和药物干预已成为世界眼科专家研究的主要方向。而白内障发病机制及其形成过程是研究白内障药物治疗方法的基石。
1 晶状体的解剖与晶状体球蛋白(Crystallin)正常的人眼晶状体是具有弹性、无血管的双凸面透明组织,借助于悬韧带悬挂于房水与玻璃体之间,构成人眼光学通路的一部分。晶状体的前表面覆盖着一层单层柱状上皮细胞,即晶状体上皮细胞,在前后凸面交界的晶状体赤道部,上皮细胞经历延长和分化,最终形成没有细胞核和细胞器的晶状体纤维细胞,同时赤道部外层不断生成的新的纤维细胞将年长的、旧的细胞推向内侧,形成晶状体的核。这种晶状体纤维细胞的分化过程不断进行,贯穿机体整个生命过程[1, 3, 4, 5, 6, 7]。正是由于这种特殊的生长方式,使得晶状体包含有处在其自身发育不同时期的细胞形态,即越往内层的细胞越老,越往外层细胞越年轻,形成一种“洋葱皮”样特殊结构[8, 9]。不同时期细胞共存于晶状体的这一特性也引起了国内外学者对晶状体各时期蛋白质结构和功能变化研究的广泛关注。晶状体球蛋白约占晶状体水溶性蛋白质90%,是晶状体主要的结构蛋白质。晶状体球蛋白主要分3个家族:α-、β-和γ-晶状体球蛋白。其中α-和β-晶状体球蛋白是寡聚体,而γ-晶状体球蛋白是单体[5, 10, 11, 12]。
α-晶状体球蛋白是构成晶状体细胞胞质主要蛋白质成分,其是小热休克蛋白家族中的一员,其含量约占晶状体内总蛋白质含量的一半。在人眼晶状体中,α-晶状体球蛋白是由αA-和αB-2个亚单位形成的杂源低聚体[5, 11, 12, 13],且αA-/αB-比值随着年龄的增长而改变,从最初胎儿时期的2:1减少至60岁左右大约为3:2[5]。2个亚基一直在解离和聚合之间不停转换以保持α-晶状体球蛋白复合体的分子伴侣活性,是维持晶状体透明的关键因素之一[4, 10, 12]。近来有研究[14]报道:在老年人或白内障患者晶状体中分离出某些低分子肽能够与α-晶状体球蛋白相结合,从而降低其分子伴侣活性。
β-和γ-晶状体球蛋白有着相似的反平行β-折叠蛋白质结构,这种类似于古希腊陶器上绘画图案的结构被象形性地称为“希腊钥匙模体(Greek key motif)”。这种特殊模体结构有利于蛋白质的紧密包装,以减少光线通过晶状体时发生的散射[5, 10, 11]。另外有学者[11]发现:“希腊钥匙模体”还具有Ca2+结合能力,而Ca2+目前被认为在白内障形成的过程中有着至关重要的作用。
鉴于晶状体纤维细胞不具有新陈代谢及蛋白质合成功能,因此晶状体中的蛋白质相对其他组织中的蛋白质长寿且极少发生蛋白质转换,这给蛋白质翻译后修饰(post-translational modifications,PTMs)提供了条件[4, 6, 10]。主要的PTMs包括脱氨基作用、甲硫氨酸和色氨酸氧化、主链切割、二硫键形成、半胱氨酸甲基化以及磷酸化作用。PTMs的发生改变了蛋白质的高级结构,使得蛋白质折叠,从而暴露肽链中的疏水基团,产生蛋白质聚集、沉淀和变性,最终形成混浊 [12, 15, 16, 17]。这意味着晶状体蛋白质的PTMs可能是白内障形成的重要机制之一。
2 Ca2+和白内障Ca2+是维持机体许多组织正常生理活动的重要离子。已经有不少国内外研究显示:Ca2+水平的升高与心肌缺血/再灌注损伤及帕金森氏病的发生有着密不可分的关系。研究[18]发现:细胞内Ca2+浓度的增加早于心肌不可逆损伤的发生,若同时采用抑制剂抑制Ca2+浓度升高可明显延缓心肌细胞的死亡。而在神经系统中,神经元内Ca2+超载及活性氧自由基(reactive oxygen species,ROS)生成增加,可导致大脑黑质致密部神经元死亡和帕金森病的发生[19, 20]。
除了循环系统和神经系统外,在人眼各组织中Ca2+同样担任着重要的角色。在晶状体的生理和病理状态下的很多代谢过程中,Ca2+作为一个信号转导粒子均发挥着很重要的作用。早在20世纪初就有报道[21]记载了人眼发生白内障的晶状体中Ca2+的病理性增多。1975年Duncan等[22]在论文中首次提出将Ca2+在白内障形成过程中的作用研究作为现代白内障研究最前沿的方向。该论文不仅报道了已发生白内障的晶状体中细胞内Ca2+含量增多,并且发现随着Ca2+浓度的增加,晶状体干重有所减少,由此推断白内障晶状体中蛋白质丢失与Ca2+超载有关。其后,许多学者[23, 24]在晶状体体外培养实验中,通过往正常培养基中加Ca2+载体使之形成细胞外高浓度Ca2+的培养环境,发现原本透明的晶状体呈现出皮质混浊,同时伴随晶状体球蛋白的丢失;而若在培养过程中同时加入Ca2+载体与Ca2+螯合剂EGTA,则晶状体不会出现明显混浊。根据一系列类似的实验结果,研究者推断Ca2+在白内障的形成过程中发挥重要作用。而Ca2+诱导的晶状体混浊的发生机制始终是白内障研究的主要焦点。
Ca2+可通过晶状体细胞膜上的多种跨膜通道内流使细胞内Ca2+浓度迅速增加,而晶状体细胞内Ca2+贮存库的释放也能有效升高Ca2+浓度。为更好地保持细胞内Ca2+浓度的稳定状态,晶状体细胞自身有多种阳离子缓冲体系、阳离子泵及离子交换体等,最主要的2种Ca2+外流机制是通过Na+/Ca2+交换体(Na+/Ca2+ exchanger ,NCX)和质膜Ca2+-ATP酶(plasm membrane Ca2+-ATPase,PMCA)进行Ca2+跨膜转运。另外内质网可通过肌浆网Ca2+-ATP酶(SERCA)将Ca2+泵入储存、隔离,从而降低胞浆内的游离Ca2+浓度;线粒体质膜上的单向传递体也可将Ca2+隔离在线粒体基质中[4, 25, 26]。
正常情况下,为了更好地完成信号转导作用且防止其对机体细胞的毒性作用,Ca2+内流与其缓冲体系处于相互抵消的动态平衡中,使得晶状体细胞内Ca2+浓度维持在微摩尔以下,远远低于房水中的浓度,并且与细胞外环境形成严格的浓度梯度[1, 7, 25, 26]。
晶状体细胞膜及细胞器质膜上的Ca2+转运体对氧化应激及质膜脂质成分和结构变化极为敏感[1]。在白内障患者的晶状体中,长期的氧化损伤,导致质膜脂质过度被氧化,使其对离子通透性大大增加,引起Ca2+内流上调,胞内Ca2+浓度增加远远超过胞质内Ca2+缓冲体系的承载能力,最终形成大量的Ca2+在细胞内堆积[25]。晶状体细胞内Ca2+超载可以触发一系列改变,包括Ca2+依赖酶活性改变、不可逆转的细胞结构蛋白破坏以及大量细胞凋亡。
有研究[1]通过测量统计发现:在成熟的人眼白内障细胞中,Ca2+的浓度可以增加近25倍,达到毫摩尔水平。而这一浓度的Ca2+能够激活多种Ca2+依赖晶状体酶。这些酶参与晶状体内一系列蛋白质水解作用,并损伤晶状体细胞的正常功能,这一变化被认为与白内障的形成直接相关。在这些细胞内的Ca2+依赖酶中,与白内障形成密切相关、最为重要的是Calpain。
3 Calpain和白内障Calpain是一类全身广泛存在的、依赖Ca2+激活的细胞内半胱氨酸蛋白水解酶家族[1, 18, 27]。在Calpain家族成员中,研究最为广泛的是Calpain 1(μ-Calpain)和Calpain 2(m-Calpain)[18, 28, 29],这2种同工酶在哺乳动物的各组织中普遍存在,其中包括大脑、血管及视神经细胞等[30]。Calpain家族的水解底物有很多,包括细胞骨架蛋白(例如血影蛋白和波形蛋白等)、膜相关蛋白(如离子通道、受体蛋白等)、信号转导分子、转录因子和凋亡相关蛋白等[9, 15]。因此,无论在细胞骨架重构、细胞的信号转导还是细胞凋亡等过程中,Calpain均发挥了重要作用[18]。
Calpain的失调能够引起机体很多病理改变,例如脊髓损伤、阿尔兹海默症(Alzheimer’ s disease,AD)、心肌缺血以及脑缺血[9, 18]。有研究[31]发现:在AD患者脑组织所形成的神经纤维缠结及老年斑中Calpain活性明显增高。在鼠的AD模型实验中,运用Calpain药物抑制剂,能够明显改善其记忆力,增强突触传递,减轻AD病征。在许多眼部疾病,如年龄相关性黄斑变性、青光眼高眼压、糖尿病性视网膜病变等的发生发展过程中,视网膜细胞缺血、缺氧,离子跨膜转运失控,Ca2+内流进入细胞质,可激活位于细胞内的Calpain,继而催化视杆细胞中的视紫红质、视锥细胞中的m-视蛋白以及米勒细胞中的波形蛋白等多种蛋白质水解,引起视神经节细胞、视锥、视杆细胞及视网膜色素上皮细胞快速死亡[32]。
在许多哺乳动物的晶状体中也发现了多种Calpain的存在,包括Calpain 10、 Calpain 3剪接变体(同一前体mRNA因不同剪接方式形成不同mRNA,并翻译成不同蛋白质)Lp82和Lp85及Calpain 2等[28, 30, 33],而晶状体中α晶状体蛋白的A链和B链、βH和βL晶状体蛋白等也是这些Calpain的重要底物[15, 34]。因而Calpain在白内障形成过程中的作用一直是研究的热点。
3.1 Calpain 10 和白内障Calpain 10与Calpain 2大亚基的主结构相近(图 1),但Calpain 10中缺少Ca2+结合区——Ⅳ区,因而有研究者[34]猜测Calpain 10的Ca2+结合区在Ⅲ区。
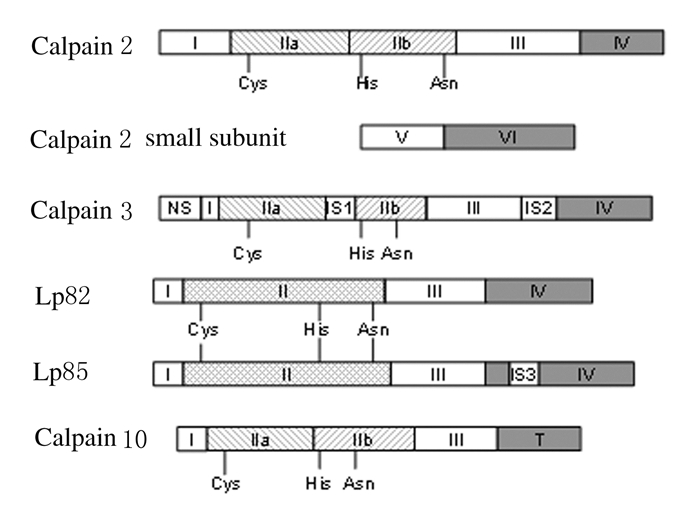
|
| 图1 晶状体中表达的Calpain的组织结构 Fig.1 Organization structurs of Calpain expressed in lens |
虽然对于Calpain 10在晶状体细胞中的活性状态和具体作用机制并未完全清楚,但根据长久以来的实验研究观察,Calpain 10在健康的成年鼠晶状体中表达水平最高的区域与上皮细胞的分化相关,因此研究者[34]推断:Calpain 10主要在上皮细胞的分化过程中发挥其正常功能。
在利用WBN/Kob大鼠作为自发性糖尿病模型的动物实验观察过程中发现:该类大鼠随着年龄的增加除了出现血糖增高、尿糖阳性、体质量降低等糖尿病基本表现外还会出现一系列与糖尿病相关的并发症,最常见的就是皮质性白内障。通过对这些WBN/Kob大鼠晶状体进行免疫标记,研究者[35]发现:在这些晶状体皮质中表达了大量的Calpain 10,而且其出现时机与白内障发生的时间相一致,同时发现这些晶状体细胞内Ca2+浓度明显升高。在亚硒酸盐诱导大鼠白内障的模型实验中也发现类似现象,即与晶状体混浊发生相一致的Calpain 10表达增加,然而与WBN/Kob大鼠形成的晶状体皮质混浊不同的是:由亚硒酸盐诱导的大鼠发生的是晶状体核性白内障[6]。
3.2 Lp82、Lp85和白内障虽然Lp82和Lp85作为Calpain 3的剪接变体,与Calpain 3有着相类似的主要结构,但前两者缺少Calpain 3中特异的插入区IS1和IS2(图 1),另外多了1个改良修饰的N-端区域AX1(图 1中未显示)[36],而Lp85比Lp82在Ca2+结合Ⅳ区多了1个含有28个氨基酸的插入序列(图 1)[37]。这些结构上的变化使得Lp82/Lp85比Calpain 3 更稳定。不同于其他Calpain在各组织细胞中的普遍存在,Lp82/p85只特异性地表达于鼠的晶状体中,而且无论在大鼠晶状体的正常成熟过程中还是白内障形成过程中均能发现其活性变化[9, 37]。目前认为Lp82/Lp85在正常晶状体中的主要功能是促进晶状体球蛋白的PTMs过程。
在Shih[37]等针对Lp82与Lp85生物化学活性对比的实验中发现:由于两者的来源与结构的高度相似,Lp82和Lp85有着等效的酶活性,相同的Ca2+激活浓度阈值与最适pH值,同样的对内源性Calpain抑制剂即Calpain抑素(calpastatin)不敏感,以及相似的αA-crystallin切割位点——切除蛋白质肽链C-端5个氨基酸即生成αA1-168片段[15, 34]。被切割的αA-crystallin失去了其分子伴侣活性[15, 37],将直接引起晶状体球蛋白的聚集、不溶、沉淀和晶状体的混浊,这在白内障的形成过程中有着重大意义。因此这种特异的αA1-168片段能够作为Lp82/Lp85水解αA-crystallin的生物标志,用来评估Lp82/Lp85的生物活性。利用αA1-168这一标志,研究者判断Lp82/Lp85在亚硒酸盐诱导大鼠离体白内障形成的实验中发挥了重要作用。在其他哺乳类动物如牛眼白内障模型实验[15]中也得到相近的结果。尽管普遍认为人体细胞中缺乏Lp82/Lp85,但通过对形成白内障的人眼晶状体进行蛋白质分析也发现了特异的αA1-168切割片段[34]。另外,人眼组织中的Calpain 3同工酶的结构上也发现了与大鼠中Lp82类似的改良修饰的AX1 N-端。
3.3 Calpain 2(m-Calpain)和白内障Calpain 2是广泛存在于哺乳动物各组织细胞中的一种Calpain家族成员,也是目前学者研究和关注的焦点所在。Calpain 2是由1个相对分子质量为80000大亚基和1个相对分子质量为30000小调节亚基组成的二聚体,其中大亚基包含Ⅰ、Ⅱ、Ⅲ和Ⅳ4个区域,而小亚基则由Ⅴ和Ⅵ2个区域组成(图 1)[1, 18, 29, 30]。通过对人类和大鼠的晶状体Calpain进行高分辨率结构分析发现:Calpain 2的大亚基Ⅱ区作为其酶活性中心,可进一步分为Ⅱa和Ⅱb2个亚区,2个亚区之间存在氨基酸残基形成肽键连接,而这一肽键的形成依赖Ca2+的存在。当Calpain 2所在细胞环境中缺乏Ca2+或Ca2+低于激活酶的阈值时,Ⅱa和Ⅱb2个亚区处于解离状态,Calpain 2则表现为无活性的酶原。当环境中的Ca2+浓度升高,Ca2+与位于Ⅳ和Ⅵ区域的Ca2+结合位点相结合,引起Ⅱa和Ⅱb2个亚区重组,装配成Calpain 2的活性中心,形成该酶的活化型,促进细胞内的蛋白水解作用[1, 30]。
在近几十年的研究中,Calpain 2已经被广泛认为在大鼠白内障的形成过程中扮演最主要角色,而在最近几年实验[1, 15]中发现:除外大鼠,在其他哺乳动物如天竺鼠、兔子、猴子、绵羊、牛甚至人的白内障形成中,Calpain 2也产生相似的水解蛋白的作用。在David等[36]的实验中,用加入了从鼠骨骼肌细胞提纯出的Calpain 2的培养基对β-晶状体球蛋白进行培养,将所得的不溶性蛋白质与亚硒酸钠诱导的鼠白内障晶状体中的蛋白质成分进行对比,发现所得到的剪切的、降级的β-晶状体球蛋白多肽链完全一致,因而推测在亚硒酸钠诱导鼠模型中形成白内障的关键角色是Calpain 2。在其后的实验中,研究者对Ca2+诱导的离体培养的人类晶状体混浊过程中所产生大量非水溶性蛋白质成分进行进一步分析发现:其主要为血影蛋白及波形蛋白的水解产物。波形蛋白和血影蛋白成分均属于细胞骨架蛋白,是Calpain 2的主要作用底物,因而他们的水解被当作是Calpain 2活化的生物标志[27, 28, 30],并以此证明Calpain 2在人类白内障的形成中发挥着重要作用。
4 Calpain抑制剂的抗白内障作用随着Calpain在白内障形成过程中的作用被发现,其抑制剂自然成为人们研究药物治疗白内障的重要对象。Calpastatin是目前唯一确定的具有Calpain特异性抑制作用的天然化合物,其是一种细胞内生性抑制剂。但由于相对分子质量太大、细胞质膜渗透性差,Calpastatin并不具备成为抗白内障药物的条件[1, 30]。因此人们只有通过合成或半合成的方式研究出合适的化合物作为治疗白内障的药物。第1代合成的实验性抗白内障制剂是环氧琥珀酰肽类化合物,其中包括E-64蛋白酶抑制剂[N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺,C15H27N5O5]及其衍生物。在离体实验[1]中发现:E64分子中能够与Calpain活性位点的巯基基团形成不可逆共价键,能够阻碍Calpain的蛋白水解活性,可以减缓白内障的形成。但是E-64蛋白酶抑制剂的质膜渗透性差,因而其在体内实验中的抗Calpain作用明显低于体外实验。因此E-64蛋白酶抑制剂作为治疗白内障药物应用于临床的可能性极小。近年有研究者采用新合成的大环醛类化合物CAT811(图 2)作为Calpain抑制剂作用于绵羊眼白内障实验中,发现其能够很好地通过细胞膜,能与m-Calpain可逆性结合,并能有效延缓、减轻晶状体混浊的发生,并且具有保护细胞骨架蛋白的作用[27]。其后许多实验研究在此基础上不断改进,意在合成具有良好质膜渗透性、低细胞毒性、高选择性与特异性并具有稳定的化学特性的Calpain抑制作用化合物。尽管如此,在其他许多哺乳动物甚至人的白内障形成过程中,这些合成的Calpain抑制剂的治疗作用仍然无法确定,而这也一直是学者们研究的主要方向。

|
| 图2 CAT811的化学式 Fig.2 Chemical formula of CAT811 |
随着一系列实验和研究的不断进行,越来越多的证据证实Calpain参与了白内障的形成,而在Calpain家族中,Calpain 2被认为是许多动物实验中白内障形成的关键因素。虽然对于Calpain在人眼白内障发生发展过程中的作用机制尚未明确,但据现有的线索可以推断,Calpain的活化对于人眼白内障的形成发挥着至关重要的作用。
由于白内障患者的持续增多,对于更加经济、便捷的白内障药物治疗方法的需求越来越迫切。虽然目前相关的研究尚属于早期,相信随着技术的日益更新,在不久的将来有希望发现可以有效治疗白内障的药物,为广大的白内障患者带来福音。
| [1] | Biswas S,Harris F,Dennison S,et al.Calpain:enzymes of vision?[J]. Med Sci Monit,2005,11(9):RA301-310. |
| [2] | Abraham AG,Condon NG,West Gower E.The new epidemiology of cataract[J].Ophthalmol Clin North Am,2006,19(4):415-425. |
| [3] | Wride MA.Lens fibre cell differentiation and organelle loss:many paths lead to clarity[J].Phil Trans R Soc Lond B Biol Sci,2011,366(1568):1219-1233. |
| [4] | Michael R,Bron AJ.The ageing lens and cataract:a model of normal and pathological ageing[J].Phil Trans R Soc Lond B Biol Sci,2011,366(1568):1278-1292. |
| [5] | Bloemendal H,de Jong W,Jaenicke R,et al.Ageing and vision:structure,stability and function of lens crystallins[J]. Prog Biophys Mol Biol,2004,86(3):407-485. |
| [6] | Kyselova Z.Different experimental approaches in modeling cataractogenesis:an overview of selenite-induced nuclear cataract in rat[J].Interdisc Toxicol,2010,3(1):3-14. |
| [7] | Gupta PD,Johar K,Vasavada A.Causative and preventive action of calcium in cataractogenesis[J].Acta Pharmacol Sin,2004,25(10):1250-1256. |
| [8] | Bahrami M,Hoshino M,Pierscionek B,et al.Optical properties of the lens:an explanation for the zones of discontinuity[J].Exp Eye Res,2014,124:93-99. |
| [9] | De Maria A,Shi Y,Kumar NM,et al.Calpain expression and activity during lens fiber cell differentiation[J].J Biol Chem,2009,284(20):13542-13550. |
| [10] | Shiels A,Hejtmancik JF.Genetics of human cataract[J].Clin Genet,2013,84(2):120-127. |
| [11] | Graw J.Genetics of crystallins:cataract and beyond[J].Exp Eye Res,2009,88(2):173-189. |
| [12] | Sharma KK,Santhoshkumar P.Lens aging:effects of crystallins[J].Biochim Biophys Acta,2009,1790(10):1095-1108. |
| [13] | Andley UP,Malone JP,Townsend RR.In vivo substrates of the lens molecular chaperones αA-crystallin and αB-crystallin[J].PLoS One,2014,9(4):e95507. |
| [14] | Rao G,Santhoshkumar P,Sharma KK.Anti-chaperone beta A3/A1(102-117)peptide interacting sites in human alpha B-crystallin[J].Mol Vis,2008,14:666-674. |
| [15] | Robertson LJ,David LL,Riviere MA,et al.Susceptibility of ovine lens crystallins to proteolytic cleavage during formation of hereditary cataract[J].Invest Ophthalmol Vis Sci,2008,49(3):1016-1022. |
| [16] | Wilmarth PA,Tanner S,Dasari S,et al.Age-related changes in human crystallins determined from comparative analysis of post-translational modifications in young and aged lens:does deamidation contribute to crystallin insolubility?[J].J Proteome Res,2006,5(10):2554-2566. |
| [17] | Liu K,Lyu L,Chin D,et al.Alter ubiquitin causes perturbed calcium homeostasis,hyperactivation of Calpain,dysregulated differentiation,and cataract[J].Proc Natl Acad Sci USA,2015,112(4):1071-1076. |
| [18] | Neuhof C,Neuhof H.Calpain system and its involvement in myocardial ischemia and reperfusion injury[J].World J Cardiol,2014,6(7):638-652. |
| [19] | Cali T,Ottlini D,Brini M.Calcium signaling in Parkinson's disease[J].Cell Tissue Res,2014,357(2):439-454. |
| [20] | Berridge MJ.Vitamin D cell signaling in health and disease[J].Biochem Biophys Res Commun,2015,460(1):53-71. |
| [21] | Burge WE.Analysis of the ash of the normal and cataractous lens[J].Arch Ophthalmol,1909,38:453-477. |
| [22] | Duncan G,Bushell AR.Ion analyses of human cataractous lenses[J].Exp Eye Res,1975,20(3):223-230. |
| [23] | Marcantonio JM.Calcium-induced disruption of the lens cytoskeleton[J].Ophthalmic Res,1996,28(Suppl 1):48-50. |
| [24] | Lee HY,Morton JD,Sanderson J,et al.The involvement of Calpains in opacification induced by Ca2+-overload in ovine lens culture[J].Vet Ophthalmol,2008,11(6):347-355. |
| [25] | Biju PG,Rooban BN,Lija Y,et al.Drevogenin D prevents selenite-induced oxidative stress and Calpain activation in cultured rat lens[J].Mol Vis,2007,13:1121-1129. |
| [26] | Rhodes JD,Sanderson J.The mechanisms of calcium homeostasis and signaling in the lens[J].Exp Eye Res,2009,88(2):226-234. |
| [27] | Morton JD,Lee HY,McDermott JD,et al.A macrocyclic Calpain inhibitor slows the development of inherited cortical cataracts in a sheep model[J].Invest Ophthalmol Vis Sci,2013,54(1):389-395. |
| [28] | Nakajima T,Shearer TR,Azuma M.Loss of calpastat in leads to activation of Calpain in human lens epithelial cell[J].Invest Ophthalmol Vis Sci,2014,55(8):5278-5283. |
| [29] | Branca D.Calpain-related diseases[J].Biochem Biophys Res Commun,2004,322(4):1098-1104. |
| [30] | Goll DE,Thompson VF,Li H,et al.The calpain system[J].Physiol Rev,2003,83(3):731-801. |
| [31] | Laske C,Stellos K,Kempter I,et al.Increased cerebrospinal fluid calpain activity and microparticle levels in Alzheimer's disease[J].Alzheimers Dement,2015,11(5):465-474. |
| [32] | Nakajima E,Hammond KB,Rosales JL,et al.Calpain,not caspase,is the causative protease for hypoxic damage in cultured monkey retinal cells[J].Invest Ophthalmol Vis Sci,2011,52(10):7059-7067. |
| [33] | Tang Y,Liu X,Zoltoski RK,et al.Age-related cataracts in alpha 3Cx46-Knockout mice are dependent on a calpain 3 isoform[J].Invest Ophthalmol Vis Sci,2007,48(6):2685-2694. |
| [34] | Reed NA,Castellini MA,Ma H,et al.Protein expression patterns for ubiquitous and tissue specific Calpains in the developing mouse lens[J].Exp Eye Res,2003,76(4):433-443. |
| [35] | Sakamoto-Mizutani K,Fukiage C,Tamada Y,et al.Contribution of ubiquitous Calpains to cataractogenesis in the spontaneous diabetic WBN/Kob rat[J].Exp Eye Res,2002,75(5):611-617. |
| [36] | David LL,Shearer TR,Shih M.Sequence analysis of lens β-crystallins suggests involvement of Calpain in cataract formation[J].J Biol Chem,1993,268(3):1937-1940. |
| [37] | Shih M,Ma H,Nakajima E,et al.Biochemical properties of lens-specific Calpain Lp85[J].Exp Eye Res,2006,82(1):146-152. |
 2016, Vol. 42
2016, Vol. 42


