扩展功能
文章信息
- 李红学, 刘军杰, 赵盛发, 李想, 周婷, 彭洋, 李航
- LI Hongxue, LIU Junjie, ZHAO Shengfa, LI Xiang, ZHOU Ting, PENG Yang, LI Hang
- 超声造影在门脉癌栓诊断和分型中的临床价值
- Clinical values of contrast-enhanced ultrasound in diagnosis and classification of portal vein tumor thrombosis
- 吉林大学学报(医学版), 2016, 42(02): 380-384
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 380-384
- 10.13481/j.1671-587x.20160236
-
文章历史
- 收稿日期: 2015-09-11
原发性肝癌(hepatocellular carcinoma,HCC)起病隐匿,大多数患者首诊时即为肝癌晚期,30%~40%HCC患者诊断时已经并发肉眼可见的门静脉癌栓(portal vein tumor thrombosis,PVTT),尸检发现超过90%以上的HCC患者出现微血管侵犯[1, 2]。HCC并发PVTT是肝癌晚期的生物学标志,是肝癌恶性生物学行为的特殊表现,是多因素综合的结果,其形成涉及解剖学、生物学等多种机制[3],早期正确诊断及分型对于制订治疗方案、客观评价疗效及判定预后等均具有十分重要的意义。增强CT是目前评估PVTT的重要影像学方法,超声造影是继二维超声、多普勒和彩色血流成像之后的第3次革命,超声造影在肝脏占位病变中的价值已得到临床医生的认可,国内外对超声造影在PVTT与血栓鉴别中作用的研究[4, 5, 6, 7, 8, 9, 10, 11, 12, 13]较多,但有关其在PVTT分型中作用的研究较少,且未见与增强CT诊断和分型性能比较的研究。本研究通过与增强CT对比,探讨超声造影在PVTT定性诊断和临床分型中的应用价值。
1 资料与方法 1.1 研究对象回顾分析2014年6月—2015年6月本院经临床和病理证实为HCC并发PVTT患者43例,其中男性32例,女性11例,年龄26~71岁,平均年龄43.8岁。43例PVTT患者共有87个HCC病灶,肿瘤最大径1.2~9.8 cm,平均(5.23±1.76)cm。患者多有上腹部不适、消瘦和长期乙肝病史。病例筛选标准:①原发癌病灶和PVTT经影像学评估可切除,术前均行超声造影和增强CT检查;②肝内无广泛癌病灶和远处转移;③患者全身状况良好,无严重心肺功能衰竭;④肝功能Child A或B级。本研究已在本院伦理委员会备案,并经患者书面同意。
1.2 主要仪器和试剂使用GE E9彩色多普勒超声诊断仪,探头频率2~4 MHz,编码相位反转技术(CPI)和Tru造影检测技术(tru agent detection,TAD),机械指数(MI)范围为0.08~0.20。造影剂为六氟化硫微泡(Sonovue,意大利Bracco公司)。
1.3 超声造影先行常规超声扫查肝脏各叶段和肝内门静脉系统主干及分支,然后进入造影模式,先将5 mL生理盐水注入装有Sonovue的小瓶中,形成磷脂包裹的六氟化硫微泡混悬液,以团注方式将2.4 mL Sonovue混悬液在2~3 s 内快速注入肘前静脉,随之用5 mL 生理盐水冲注,实时不间断观察5 min。注射后第10~30秒为动脉相,第31~120秒为门脉相,第120秒以后为延迟相。
1.4 图像诊断3名超声医师评估PVTT回声、内部血流及其与周围组织结构关系、超声造影时癌栓内部增强及消退特征,讨论后得出统一诊断意见。以癌栓内部回声高于周围肝实质回声为高增强,癌栓内部回声与周围肝实质回声相当为等增强,病灶内部回声低于周围肝实质回声为低增强。PVTT分型依据上海第二军医大学东方肝胆医院对肝癌并发PVTT提出的分型[4],根据癌栓侵犯不同的门静脉部位,将癌栓分为四型: Ⅰ型癌栓累及二级及二级以上门静脉分支,Ⅱ型癌栓累及一级门静脉分支,Ⅲ型癌栓累及门静脉主干,Ⅳ型癌栓累及肠系膜上静脉或下腔静脉。
1.5 增强CT使用GE OPTIMA CT660 64排螺旋CT仪,由3名CT医生协助完成。
1.6 统计学分析采用SPSS 16.0统计软件进行统计学处理。3名CT诊断医师和超声医师诊断结果的一致性分析行Kappa检验,超声造影和增强CT诊断和分型准确率行χ2检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 CT诊断医师和超声医师诊断结果的一致性分析3名CT诊断医师诊断结果一致性分析的Kappa值为0.82,3名超声医师诊断结果一致性分析的Kappa值为0.87,3名CT诊断医师和超声医师的诊断结果基本一致。
2.2 PVTT的常规超声和超声造影43例PVTT患者中常规超声呈低回声32例(74.4%),等回声9例(20.9%),高回声2例(4.7%);其中27例(62.8%)癌栓内部可见稀疏血流信号,频谱证实以动脉为主。PVTT超声造影表现为“快进快出”的特征:动脉相,88.4%(38/43)的癌栓表现为高增强;门脉相,81.4%(35/43)的癌栓表现为低增强;延迟相,所有癌栓(43/43)均表现为低增强。
2.3 超声造影和增强CT对PVTT诊断和分型的准确率超声造影诊断PVTT的准确率为100%,增强CT为97.7%(42/43),2种方法比较差异无统计学意义(χ2=0,P=1.000);超声造影分型准确率为95.3%(41/43),增强CT分型准确率为93.0%(40/43),2种方法比较差异无统计学意义(χ2=5.79,P>0.05)。见表 1和图 1~4。
| (n=43) | |||||
| Method | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Thrombus |
| CEUS | 7 | 10 | 21 | 5 | 0 |
| Enhanced CT | 6 | 10 | 21 | 5 | 1 |
| Surgery | 7 | 8 | 23 | 5 | 0 |
|
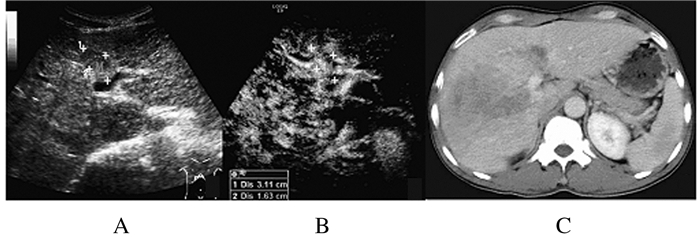
| M:Mass;US:Hypoechoic mass;CEUS: Arterial phase hyper-enhancement; Enhanced CT: Vein phase filling defect. 图1 门静脉矢状段癌栓常规超声(A)、超声造影(B)和增强CT(C)图像 Fig.1 Images of portal vein sagittal section of tumor thrombosis by conventional ultrasound(A),contrast-enhanced ultrasound(B)and enhanced CT(C) |

|
| M:Mass;US:Hypoechoic mass;CEUS: Arterial phase hyper-enhancement; Enhanced CT: Arterial phase heterogeneous density. 图2 门静脉左支癌栓常规超声(A)、超声造影(B)和增强CT(C)图像 Fig.2 Images of left branch of PVTT by conventional ultrasound(A),contrast-enhanced ultrasound(B) and enhanced CT(C) |
|
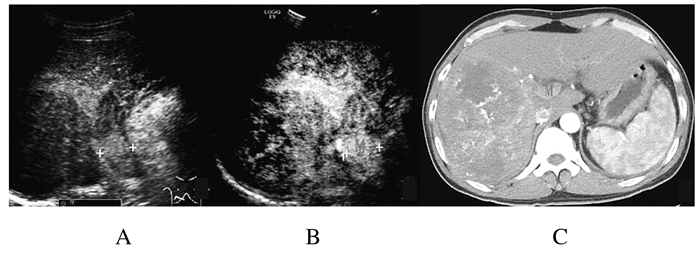
| M:Mass;US: Hypoechoic mass;CEUS: Arterial phase hyper-enhancement; Enhanced CT: Arterial phase heterogeneous density. 图3 门静脉主干癌栓常规超声(A)、超声造影(B)和增强CT(C)图像 Fig.3 Images of tumor thrombosis in main portal vein by conventional ultrasound(A),contrast-enhanced ultrasound(B)and enhanced CT(C) |
|
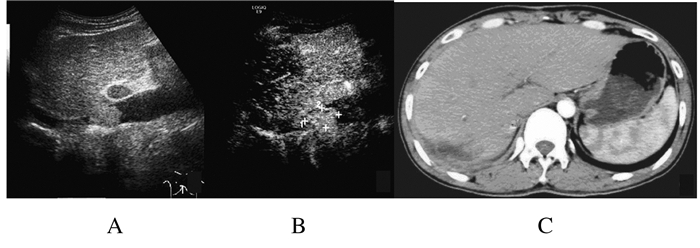
| M:Mass;US: Hypoechoic mass;CEUS: Arterial phase hyper-enhancement; Enhanced CT: Arterial phase heterogeneous density. 图4 下腔静脉癌栓常规超声(A)、超声造影(B)和增强CT(C)图像 Fig.4 Images of tumor thrombosis in inferior vena cava by conventional ultrasound(A),contrast-enhanced ultrasound(B)and enhanced CT(C) |
HCC是我国常见的恶性肿瘤之一,广西壮族自治区更是我国HCC高发区之一,HCC死亡率居广西各种恶性肿瘤之首[5]。HCC最常见的转移或复发途径是经门静脉系统的肝内播散,PVTT是HCC的严重并发症与重要转移方式,PVTT是影响肝癌切除率和预后的重要因素,有研究[6]指出:并发PVTT是肝癌患者预后不良居首位的、最强的和独立的因素。
PVTT的及时诊断和正确分型对临床医生治疗方案的选择有重要的临床价值,目前PVTT的诊断和分型主要依靠影像学技术,常规超声和增强CT是目前最为常用的无创性影像学诊断手段[7]。常规超声主要通过门静脉管腔内出现异常实质性回声、血流充盈缺损、阻塞段扩张和门静脉海绵样变性等特征来判定门静脉有无栓子,在本研究中PVTT呈浸润性生长,多为低回声或等回声(本组41例,95.3%),与周围肝实质对比不明显,常规超声无法对癌栓边界做出准确判断,并且有16例(37.2%)PVTT内部未见明显血流信号,这就使彩色多普勒超声对PVTT内部血流的评估敏感性降低,且因常规超声时常无法准确评估PVTT的实际浸润范围导致分型准确率降低。临床医生对常规超声在PVTT血流信号显示率和分型准确率的不足常借助增强CT予以明确[9],癌栓的供血动脉在动脉期强化是增强CT诊断癌栓的主要依据,增强CT虽然具有良好的空间分辨率,但其时间分辨率较差,在本研究中误诊1例Ⅰ型病例,回顾性分析发现由于癌栓范围较小且造影剂增强及消退很快,增强CT在碘海醇对比增强剂注射后开始动脉期扫查时癌栓已完全消退,被误诊为血栓,因此对于动脉早期出现快速强化并快速消退的癌栓容易误诊为血栓,易出现假阴性,造成诊断敏感性减低。
超声造影是利用造影剂使后散射回声增强,明显提高超声分辨力、诊断敏感性和特异性的技术,超声造影能克服常规超声的局限性,造影剂微泡的平均直径远小于癌栓内滋养动脉管径,这有助于评估微小血管内的低速血流,同时结合造影成像技术,可在实时动态显示微循环血流灌注的同时获得造影区解剖和功能代谢两方面的信息[10, 11, 12],超声造影已经成为无创性评价组织微循环及肿瘤新生血管的重要影像学手段,其诊断敏感性及准确性均高于普通超声[8, 13]。PVTT与正常肝实质均为双重供血,但癌栓主要由肝动脉供血,而正常肝实质主要由门静脉供血,癌栓内新生毛细血管的增加使癌栓内部血流灌注量明显增加,超声造影时,动脉期造影剂可快速通过癌栓供血血管进入癌栓内部毛细血管网,可清楚显示癌栓毛细血管网在癌栓内部的分布,因而癌栓在此期表现为高增强,但癌栓动脉期以后造影剂的摄取量较少,而周围肝组织在门脉期才是摄取造影剂微泡的高峰,故在门脉后期及延迟期癌栓主要表现为低增强,而周围肝组织表现为高增强,这增加了两者的对比,使癌栓的边界相对更清楚,更易观察癌栓真正的浸润范围,这与本研究的结果相符,43例PVTT中88.4%(38/43)动脉相表现为高增强,81.4%(35/43)门脉相表现为低增强,延迟相均表现为低增强,超声造影表现为“快进快出”的特征。
超声造影剂是血池显像剂,超声造影可以通过动态反映PVTT的血流灌注特征和增强癌栓与周围肝组织结构声特性阻抗的对比度,提高PVTT的显示和分型准确率。PVTT的分型主要通过判断癌栓侵袭门静脉不同分支的情况进行,超声造影由于可以较清楚显示PVTT的部位及癌栓的浸润范围,提高了其对PVTT分型的能力。在本研究中,由3名超声医师共同讨论得出统一的诊断意见,3名超声医师诊断结果基本一致(Kappa=0.87),这减少了超声医师经验对诊断结果的影响。超声造影诊断PVTT的准确率为100%,分型准确率为95.3%(41/43),与增强CT有很好的一致性,但本组资料超声造影2例Ⅲ型误诊为Ⅱ型,通过分析可以发现癌栓位于左右支门静脉汇合部位,门脉主干部分癌栓较小未完全填充管腔,且血供稀疏,造影后由于部分容积效应的影响导致边界显示不清,故而出现分型错误,这就提示超声造影在分型时应结合常规超声,并进行多切面动态细致扫查,尽可能分清癌栓边界和对肝内门静脉的侵犯情况以做出准确的分型,便于临床医生做出合理的治疗方案。
综上所述,超声造影可以动态显示PVTT的血流灌注特征,通过增强癌栓与周围组织结构声特性阻抗的对比度来显示癌栓的实际浸润范围,超声造影和增强CT在PVTT的诊断和分型方面有很好的一致性,超声造影可作为PVTT治疗前评估的重要影像学方式。
| [1] | Giorgio A,Calisti G,Montesarchio L,et al.Hepatocellular carcinoma invading portal venous system in cirrhosis:long-term results of percutaneous radiofrequency ablation of both the nodule and portal vein tumor thrombus.A case control study[J].Anticancer Res,2014,34(11):6785-6790. |
| [2] | Zhou L,Rui JA,Wang SB,et al.Risk factors of microvascular invasion,portal vein tumor thrombosis and poor post-resectional survival in HBV-related hepatocellular carcinoma[J].Hepato-Gastroenterology,2014,61(134):1696-1703. |
| [3] | Wang Z,Liu G,Lu MD,et al.Role of portal vein tumor thrombosis in quantitative perfusion analysis of contrast-enhanced ultrasound of hepatocellular carcinoma[J].Ultrasound Med Biol,2015,41(5):1277-1286. |
| [4] | Shi J,Lai EC,Li N,et al.A new classification for hepatocellular carcinoma with portal vein tumor thrombus[J].Hepatobiliary Pancreat Sci,2011,18(1):74-80. |
| [5] | Ye JZ,Zhang YQ,Ye HH,et al.Appropriate treatment strategies improve survival of hepatocellular carcinoma patients with portal vein tumor thrombus[J].World J Gastroenterol,2014,20(45):17141-17147. |
| [6] | Shaohua L,Qiaoxuan W,Peng S,et al.Surgical strategy for hepatocellular carcinoma patients with portal/hepatic vein tumor thrombosis[J].PLoS One,2015,10(6):e0130021. |
| [7] | Zhang XY,Yan L,Wen TF,et al.Contrast-enhanced ultrasound:Improving the preoperative staging of hepatocellular carcinoma and guiding individual treatment[J].World J Gastroenterol,2014,20(35):12628-12636. |
| [8] | Danila M,Sporea I,Popescu A,et al.The value of contrast enhanced ultrasound in the evaluation of the nature of portal vein thrombosis[J].Med Ultrason,2011,13(2):102-107. |
| [9] | Yoon JH,Kim HC,Chung JW,et al.CT findings of completely regressed hepatocellular carcinoma with main portal vein tumor thrombosis after transcatheter arterial chemoembolization[J].Korean J Radiol,2010,11(1):69-74. |
| [10] | Palmieri VO,Santovito D,Marano G,et al.Contrast-enhanced ultrasound in the diagnosis of hepatocellular carcinoma[J].Radiol Med,2015,120(7):627-633. |
| [11] | Wildner D,Bernatik T,Greis C,et al.CEUS in hepatocellular carcinoma and intrahepatic cholangiocellular carcinoma in 320 patients-early or Late washout matters:A subanalysis of the DEGUM multicenter trial[J].Ultraschall Der Medizin,2015,36(2):132-139. |
| [12] | Lin Q,Lu F,Luo Y,et al.Contrast-enhanced ultrasound for the signature analysis of splenic trauma in a canine model during hemorrhagic shock and resuscitation[J].Zhong Nan Da Xue Bao Yi Xue Ban,2015,40(1):59-66. |
| [13] | Raza SA,Jang HJ,Kim T K.Differentiating malignant from benign thrombosis in hepatocellular carcinoma:contrast-enhanced ultrasound[J].Abdom Imaging,2014,39(1):153-161. |
 2016, Vol. 42
2016, Vol. 42


