扩展功能
文章信息
- 邹喜, 陈金梅, 洪金省, 郭飞宝, 蓝林臻, 张纬建
- ZOU Xi, CHEN Jinmei, HONG Jinsheng, GUO Feibao, LAN Linzhen, ZHANG Weijian
- 非小细胞肺癌患者EGFR-TKI靶向治疗前后肿瘤体积变化规律及其临床价值
- Tumor volume recession pattern of patients with non-small cell lung cancer before and after EGFR-TKI targeting treatment and its clinical value
- 吉林大学学报(医学版), 2016, 42(02): 345-350
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 345-350
- 10.13481/j.1671-587x.20160229
-
文章历史
- 收稿日期: 2015-07-15
对于局部晚期及晚期肺癌,放化疗综合治疗模式一直是美国国立综合癌症网络(National Comprehensive Cancer Network ,NCCN)临床实践指南推荐的治疗方法,但不良反应较大。近年来,随着对表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)的深入研究,认为EGFR-TKI与放疗联合是很好的选择。李夏南等[1] 对EGFR-TKI与放疗联合的基础研究进行综述后认为:EGFR-TKI具有放射增敏性,其与放疗联合不但可以解决放疗后期肿瘤的放射抵抗以及EGFR-TKI继发耐药问题,还可以增加对肿瘤杀伤能力,同时不良反应较同步放化疗小。在临床上EGFR-TKI与放疗结合治疗的安全性和作用潜能已得到一些研究[2, 3]的肯定。更为重要的是:靶向治疗有效的病例肿瘤体积退缩一般都比较明显,而目前放疗剂量的提高和毒性反应的大小仍然是非小细胞肺癌(non-small cell lung cancer,NSCLC)放射治疗中的一对主要矛盾,肿瘤体积的大小是决定正常组织器官照射体积大小的直接因素。故寻找合适的靶向治疗和放疗的联合方式,即在肿瘤体积最小或变化的平台期介入放疗或许是二者联合的一个最佳模式。目前国内外有关此类的研究甚少,本研究从靶向治疗中肿瘤体积变化规律进行探讨,以期在肿瘤体积最小时介入以放射治疗为主的局部治疗手段,旨在提高肿瘤局部控制率的同时,降低对正常组织的损伤。
1 资料与方法 1.1 一般资料回顾性分析2010年10月—2013年12月于福建医科大学附属第一医院行EGFR-TKI靶向治疗的连续地符合入组条件的NSCLC患者。入组标准:①病理证实的NSCLC,存在EGFR基因突变或虽基因突变状态不明,但为女性、腺癌、不吸烟的靶向治疗优势人群;②入组前未行过放疗或肺肿瘤切除术;③ CT扫描肺部有可见肿瘤且肿瘤边界可识别。排除标准:因各种原因造成靶向治疗中断超过1周以上;图像资料不完整。测量、记录入组病例的相关临床资料。靶向治疗前和靶向治疗开始后的胸部CT图像通过螺旋CT扫描获得;所获得图像选择靶向治疗前和治疗不同时间后的扫描图像。
1.2 研究设备与条件对本医院的CT图像通过局域网传输至Philips ADAC Pinacle9.0m三维治疗计划系统并进行体积测量;对部分非本医院的CT图像,使用ImageJ 图像处理软件,选择感兴趣区域 (regions of interest,ROI)测量法计算肺肿瘤体积。每例患者勾画条件和标准保持一致,统一窗宽窗位:CT肺窗窗宽窗位分别为1600HU和-700HU,纵膈窗窗宽窗位分别为500HU和40HU,转移淋巴结与原发灶不能区分时一起归入原发灶。由TPS及ImageJ 图像处理软件测量得出靶向治疗前及靶向治疗后每个月的肿瘤绝对体积。
1.3 数据计算与分析方法靶向治疗前原发灶肿瘤体积为VT0;治疗中第1、2、……n个月原发灶肿瘤体积分别为VT1、VT2……VTn,并设靶向治疗前原始体积为1,计算得出靶向治疗后每个月的肿瘤相对体积(VTn%=VTn/VT0×100%),符合正态分布的计量资料采用x±s表示,非正态分布的计量资料以M(P25,P75)表示。对靶向治疗前、治疗后第1、2……n个月各相邻月份肿瘤绝对体积和相对体积分别作配对比较。组间差异分析采用配对t检验或配对样本比较的Wilcoxon符号秩检验进行配对比较。
2 结果 2.1 入组患者一般观察指标研究期间符合条件的共39例NSCLC患者入组,对入组患者均根据患者首次诊断时的影像资料及病史资料参照UICC 2009年第7版进行临床分期。各项指标统计描述见表 1。
| (x±s) | |||
| Characteristic | n | Characteristic | n |
| Sex | Smoking history | ||
| Male | 12 | No | 33 |
| Female | 27 | Yes | 6 |
| Age(year) | Chemotherapy cycle pre-TK1 | ||
| ≤60 | 22 | ≥4 cycle | 15 |
| >60 | 17 | <4 cycle | 24 |
| Pathological type | ECOG PS | ||
| Squamous | 3 | ≤1 | 34 |
| Adenocarcinoma | 36 | >1 | 5 |
| General type | Primary tumor volume (cm 3) | ||
| Central | 16 | ≥10 | 21 |
| Peripheral | 23 | <10 | 18 |
| Location | EGFR gene detection | ||
| Upper | 24 | Mutation | 29 |
| Lower | 15 | Unknown | 10 |
| Distant metastases | TNM staging | ||
| Yes | 31 | Ⅲ | 8 |
| No | 8 | Ⅳ | 31 |
所有患者经过了1个月以上的靶向治疗后均获得了每例患者靶向治疗前扫描的影像资料并测量了其体积。EGFR-TKI靶向治疗期间各月份复查的影像资料获取后亦测量其体积。按接受靶向治疗具体月份数分组具有可测量肿瘤体积数据的例数如下:靶向治疗前39例,靶向治疗1个月后34例,靶向治疗2个月后24例,靶向治疗3个月后20例,靶向治疗4个月后20例,靶向治疗5个月后16例,靶向治疗6个月后12例,靶向治疗7个月后14例,靶向治疗8个月后8例,靶向治疗9个月后6例,靶向治疗10个月后6例。
2.2.1 NSCLC患者靶向治疗前后肿瘤绝对体积与相对体积变化的总体趋势NSCLC患者EGFR-TKI靶向治疗后第1和第2个月肿瘤体积明显缩小,治疗后3~9个月肿瘤体积趋于稳定,10个月后肿瘤体积有增大趋势。见表 2和图 1。
| M(P25,P75) | ||
| Time | Absolute tumor volume( V/mm 3)(V Tn) | Relative tumor volume (V Tn%) |
| T 0 | 14 541.85(7 491.65,43 141.02) | 1 |
| T 1 | 7 954.42(3 499.73,29 236.83) | 0.612 6(0.313 8,0.853 7) |
| T 2 | 6 492.90(3 702.84,19 863.07) | 0.592 9(0.282 8,0.876 4) |
| T 3 | 7 961.95(2 559.31,20 785.82) | 0.422 0(0.168 7,0.643 9) |
| T 4 | 4 230.04(2 909.51,14 118.13) | 0.458 4(0.198 6,0.702 5) |
| T 5 | 7 734.37(2 660.12,20 284.73) | 0.369 8(0.243 5,0.581 1) |
| T 6 | 3 647.55(2 679.70,8 349.20) | 0.392 6(0.178 4,0.906 9) |
| T 7 | 4 489.45(2 143.15,12 730.82) | 0.323 1(0.121 4,0.488 1) |
| T 8 | 3 329.43(2 283.15,15 546.51) | 0.350 3(0.225 9,0.696 7) |
| T 9 | 2 212.33(908.41,8 415.65) | 0.306 0(0.102 7,0.747 7) |
| T 10 | 7 370.29(1 413.71,19 289.37) | 0.595 7(0.212 7,0.860 7) |
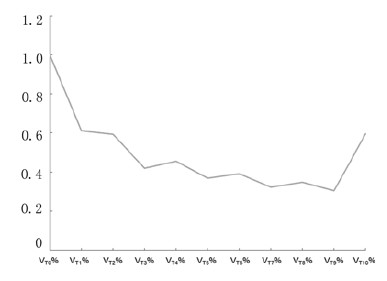
|
| 图1 NSCLC患者靶向治疗前后肿瘤相对体积中位数变化趋势图 Fig.1 Tumor relative volume median changing trend diagram of NSCLC patients after targeting treatment |
采用SPSS 17.0统计软件统计所有患者靶向治疗后每月CT扫描时肿瘤体积曲线变化情况。对靶向治疗前、治疗后第1、2……n个月各相邻月份的相对体积分别作配对分析发现:前6个月用配对样本比较的Wilcoxon符号秩检验提示EGFR-TKI靶向治疗前和治疗后1个月后(Z=-3.855,P < 0.001)、治疗后第1月和第2个月(Z=-2.173,P=0.030)间的相对体积比较差异有统计学意义(P < 0.05),余相邻月份间的相对体积差异无统计学意义(P>0.05)。见表 3和4(仅比较前6个月)。说明NSCLC患者靶向治疗中的前2个月平均原发灶肿瘤体积下降较明显,3个月后开始进入平台期。
| [M(P25,P75),V/mm3] | |||||
| Absolute volume matching group | n | Volume of prior month | Volume of later month | Z | P |
| V T0 vs V T1 | 34 | 14 822.11(7 524.73,54 999.41) | 7 954.42(3 499.73,29 396.83) | -3.257 | 0.001 |
| V T1 vs V T2 | 19 | 8 358.47(4 394.36,24 430.05) | 7 028.76(3 634.98,21 056.71) | -2.213 | 0.027 |
| V T2 vs V T3 | 9 | 7 040.74(3 099.38,13 717.46) | 7 161.87(3 427.76,11 838.50) | -0.770 | 0.441 |
| V T3 vs V T4 | 9 | 5 642.38(1 592.73,11 308.68) | 3 871.06(1 198.63,11 872.17) | -0.889 | 0.374 |
| V T4 vs V T5 | 6 | 8 267.15(2 957.15,14 543.45) | 6 653.90(2 701.70,15 143.60) | -0.734 | 0.463 |
| V T5 vs V T6 | 4 | 3 162.67(2 664.97,8 805.65) | 3 191.08(2 679.70,9 360.43) | -0.365 | 0.715 |
| V T0: The absolute volume of pre-targeting treatment;V TX: The absolute volume post-targeting treatment of X month(X≥1). | |||||
| [M(P25,P75),η/%] | |||||
| Relative volume matching group | n | Volume of prior month | Volume of later month | Z | P |
| V T0% vs V T1% | 34 | 1 | 0.612 6(0.313 8,0.853 7) | -3.872 | 0.000 |
| V T1% vs V T2% | 19 | 0.608 4(0.364 3,1.044 3) | 0.423 0(0.248 8,0.877 7) | -2.173 | 0.030 |
| V T2% vs V T3% | 9 | 0.339 1(0.221 1,0.687 8) | 0.376 2(0.180 9,0.676 1) | -0.533 | 0.594 |
| V T3% vs V T4% | 9 | 0.376 2(0.083 9,0.541 7) | 0.258 0(0.097 9,0.408 5) | -0.770 | 0.441 |
| V T4% vs V T5% | 6 | 0.384 6(0.248 3,0.590 7) | 0.334 8(0.242 6,0.652 7) | -0.524 | 0.600 |
| V T5% vs V T6% | 4 | 0.267 7(0.190 2,0.632 6) | 0.285 0(0.177 0,0.700 4) | -0.730 | 0.465 |
| V T0%:The relative volume of pre-targeting treatment was 1; V TX%:The relative volume post-targeting treatment of X month(X≥1). | |||||
靶向药物的出现大大改变了NSCLC的治疗现状,EGFR-TKI(主要是吉非替尼和厄洛替尼)对亚裔、腺癌、女性、不吸烟以及EGFR 基因突变的晚期NSCLC患者安全性及有效性均较好。尤其对于EGFR突变的晚期NSCLC患者,已经推荐用于一线治疗 [4, 5, 6]。本研究通过对39例NSCLC EGFR-TKI靶向治疗患者进行研究发现:NSCLC患者EGFR-TKI治疗后的第1和2个月平均原发灶肿瘤体积缩小显著,尤其是治疗1个月后,原发灶肿瘤体积平均退缩了接近1/3(31.06%),治疗3~9个月后原发灶肿瘤体积趋于稳定,肿瘤最小体积出现在7~9个月,10个月后肿瘤体积有增大趋势。而庄梦琪[7]研究了晚期NSCLC靶向药物治疗失败模式,其进展发生在肺部的患者无进展生存时间(progress free survival,PFS)为6个月,与本研究结果大体相符。以上肿瘤体积变化趋势与本单位先前135例NSCLC化疗退缩规律[8, 9]比较有如下特点:①化疗1个周期后剩余肿瘤体积为82.01%,而靶向治疗第1个月后为63.94%,化疗第1个周期肿瘤体积退缩大于80%的仅有1例,比例小于1%。而靶向治疗中1个月后肿瘤体积退缩大于80%的有6例,约占15.4%,相比较而言靶向治疗的肿瘤退缩率大于经典的化疗;②化疗相对体积变化趋势于2~3周期出现平台期,4~6周期出现增大的趋势,而靶向治疗者3~9个月出现平台期,最小值出现在7~9个月,平均体积最低值可达30.74%,其有效维持时间也较化疗长,这与多项临床研究,如Mok等[10]、Zhang等[11]、Zhou等[12]及日本的Mitsudomi等[13]等提示EGFR-TKI较化疗更能改善EGFR基因敏感突变NSCLC患者的PFS相符。
然而,上述临床研究[10, 11, 12, 13]均提示与化疗相比,EGFR-TK1虽然可改善EGFR突变患者的PFS,但不能延长总生存时间(overall survival,OS)。本文作者曾经对该研究入组病例中的2例接近取得影像学完全缓解(complete response,CR)的患者进行过二次病理活检,提示仍未达到病理学的CR,故要想在NSCLC的疗效上更进一步,局部治疗手段的应用是必要的。已有研究[2]证明:对TKI治疗有效的Ⅲb或Ⅳ期人群早期应用放疗来控制可见肿瘤病灶是有价值的,但该研究未明确提出放疗与靶向治疗结合的最佳时间。众所周知,肿瘤体积不但与放疗疗效密切相关[14],而且是提高靶区剂量的主要限制因素,随着NSCLC靶向治疗药物在肺癌治疗中应用越来越多,为放疗前降低原发灶体积进而降低正常组织剂量体积参数及提高疗效提供了可能。本研究发现:在靶向治疗3~9个月后肿瘤体积退缩已进入平台期,此期间或许就是实施放射治疗的较好时期,此时靶向治疗已可使原发肿瘤退缩了近2/3体积,实施放疗时靶体积减小,肺损伤少,并可提升肿瘤照射剂量,同时由于靶向治疗所致间质性肺炎的时间多发生在3个月内[15],靶向治疗一定时间后放疗可使其与放射治疗所致放射性肺炎时间上有效分开,便于观察及防范处理。
综上所述,EGFR-TKI治疗有效的晚期或局部晚期NSCLC患者,靶向治疗开始后1~2个月原发灶肿瘤体积下降较为明显,在治疗后3~9个月介入放疗可能较适合。本研究分析了EGFR-TKI靶向治疗NSCLC患者原发灶肿瘤体积变化规律,为其与胸部放疗相结合时机的选择提供了一定的参考依据。此结果仍需进一步扩大样本量及延长观察时间来验证。
| [1] | 李夏南,朱广迎. EGFR-TKI联合放疗治疗晚期非小细胞肺癌的研究进展[J].中国肺癌杂志,2014,17(4):357-362. |
| [2] | Chang CC,Chi KH,Kao SJ,et al.Upfront gefitinib/erlotinib treatmentfollowed by concomitant radiotherapy for advanced lung cancer:Amono-institutional experience[J].Lung Cancer,2011,73(2):189-194. |
| [3] | WangJ,Xia TY,Wang YJ,et al.Prospective study of epidermal growth factor receptor tyrosine kinase inhibitors concurrent with individualized radiotherapy for patients with locally advanced or metastatic non-small-cell lung cancer[J].Int J Radiat Oncol Biol Phys,2011,81(3):e59-65. |
| [4] | 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78. |
| [5] | Chen G,Feng J,Zhou C,et al.Quality of life (QoL) analyses from OPTIMAL (CTONG-0802),a phase Ⅲ,randomised,open-label study of first-line erlotinib versus chemotherapy in patients with advanced EGFR mutation-positive non-small-cell lung cancer (NSCLC)[J].Ann Oncol,2013,24(6):1615-1622. |
| [6] | 中华医学会呼吸病学分会肺癌学组,中国肺癌防治联盟.晚期非小细胞肺癌分子靶向治疗专家共识(2013版)[J].中华结核与呼吸杂志,2014,37(3):177-183. |
| [7] | 庄梦琪.晚期非小细胞肺癌靶向药物治疗失败模式的临床分析[D].济南:山东大学,2014. |
| [8] | 张纬建,邹喜,洪金省,等.非小细胞肺癌诱导化疗后肿瘤体积变化规律及其影响因素[J].广东医学,2013,34(11):1741-1744. |
| [9] | 邹喜.非小细胞肺癌化疗后肿瘤体积变化规律及其影响因素研究[D].福州:福建医科大学,2012. |
| [10] | Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957. |
| [11] | Zhang L,Ma S,Song X,et al.Gefitinib versus placebo as maintenance therapy in patients with locally advanced or metastatic non-small-cell lung cancer(INFORM:C-TONG0804):a multicentre,double-blind randomised phase 3 trial[J].Lancet Oncol,2012,13(5):466-475. |
| [12] | Zhou C,Wu YL,Chen G,et al.Erlotinib versus chemotherapy as first-line treatmenl for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735-742. |
| [13] | Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405):an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11(2):121-128. |
| [14] | Alexander BM,Othus M,Caglar HB,et al.Tumor volume is a prognostic factor in non-small-cell lung cancer treated with chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2011,79(5):1381-1387. |
| [15] | Akamatsu H,Inoue A,Mitsudomi T,et al.Interstitial lung disease associated with gefitinib in Japanese patients with EGFR-mutated non-small-cell lung cancer:combined analysis of two Phase Ⅲ trials (NEJ 002 and WJTOG 3405)[J].Jpn J Clin Oncol,2013,43(6):664-668. |
 2016, Vol. 42
2016, Vol. 42


