扩展功能
文章信息
- 邱立洁, 张也, 张文静, 钱东华
- QIU Lijie, ZHANG Ye, ZHANG Wenjing, QIAN Donghua
- 他汀类药物辅助治疗肺炎或脓毒症疗效的Meta分析
- Meta-analysis on curative effects of statins in treatment of pneumoniaor or sepsis
- 吉林大学学报(医学版), 2016, 42(02): 336-344
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 336-344
- 10.13481/j.1671-587x.20160228
-
文章历史
- 收稿日期: 2015-10-16
2. 吉林大学第一医院内分泌代谢科, 吉林长春 130021
2. Department of Endocrine and Metabolic Diseases, First Hospital, Jilin University, Changchun 130021, China
他汀类药物(即HMG-CoA还原酶抑制剂)作为治疗高脂血症和冠状动脉粥样硬化性心脏病的常用药物,已经越来越广泛地应用于临床,在降低胆固醇、降低心血管疾病的患病率及病死率方面发挥着重要的作用。近年来,他汀类药物的多效性引起了人们的关注,有研究[1, 2]发现:他汀类药物具有抗炎、免疫调节、抗氧化及保护内皮细胞等作用,提示他汀类药物对于感染性疾病,尤其是最常见的肺部感染及病情严重的脓毒症的治疗及预后的改善可能有一定的辅助作用。近几年,国内外多项研究对他汀类药物与感染性疾病的关系均有报道,但结论不一,争议颇多。有国外学者[3, 4, 5]进行过这方面的荟萃分析,因其所纳入的研究多为队列研究和病例对照研究,可能会存在各种偏倚,使研究结果的可信性降低,而国内类似的荟萃分析为数不多。本研究搜集有关他汀类药物辅助治疗肺炎及脓毒症的多个临床随机对照研究,并纳入国内发表的相关文献进行荟萃分析,就他汀类药物与细菌感染性疾病的相关性进行探讨,从而阐述他汀类药物辅助治疗细菌感染性疾病是否有效。
1 资料与方法 1.1 检索策略收集各数据库从建库至2015年1月31日的相关随机对照试验。检索的中文数据库包括:中国生物医学文献数据库、万方数据库、中国知网数据库;中文检索词为:“他汀”或“阿托伐他汀”或“氟伐他汀”或“洛伐他汀”或“匹伐他汀”或“普伐他汀”或“罗素伐他汀”或“辛伐他汀”,联合“肺炎”或“肺部感染”或“下呼吸道感染” 或“社区获得性肺炎”或“脓毒症”; 检索的英文数据库为:PubMed、Cochrane Library、EMbase;英文检索词为:“statin” or “simvastatin” or “atorvastatin” or “fluvastatin” or “lovastatin” or “pitavastatin” or “pravastatin” or “rosuvastatin” 以及 “infection” or “sepsis” or “bacteremia” or “pneumonia”or “sepsis”。语言限定为英语或中文,研究对象限定为人,同时对纳入文献的参考文献进行检索。
1.2 纳入标准①研究类型为随机对照试验;②研究对象符合肺炎、脓毒症诊断标准;③干预措施为治疗组给予他汀类药物;④有具体的结局指标数据:住院期间死亡人数、机械通气或入住ICU治疗的人数以及C反应蛋白(C reaction protein,CRP)的计量资料。
1.3 排除标准①因数据不完整而无法使用的文献;②统一数据重复发表或一稿多投的文献。
1.4 文献筛查和数据提取通过阅读检索文献的题目及摘要初步剔除与本研究不相关的和与纳入标准不相符的文献。为达到更加精确的文献查全率和查准率,同时由第2位研究者独立进行相关的文献检索工作,然后通过讨论汇总2人检索结果。最后进行质量评价、数据提取及交叉核对,如若有任何不同意见均需交由第3人讨论解决。主要提取数据包括:①检出文献的基本信息。第一作者、发表时间、地区、纳入人群基本特征;②纳入文献中患者的基本信息。年龄、性别、男女比例;③纳入研究的设计类型。盲法,对照和随机分组情况;④干预策略。干预组用药的名称、用法、剂量,对照组治疗情况;⑤研究的主要结论。住院期间死亡率、CRP、需机械通气或入住ICU 比率等。不确切或数据不完整的部分研究结果联系文献第一作者咨询;相关数据详细记录并编制相关表格以待进一步统计分析。
1.5 文献质量评价采用修改后的Jadad量表对所纳入文献进行方法学质量评分。
1.6 统计学分析本研究使用Cochrane协作网提供的Review Manager 5.3软件对纳入文献进行数据处理及统计分析。计数资料选择相对危险度(risk ratio,RR)为合并统计量,计量资料选择均数差(mean differences,MD)及95%CI为合并统计量。对纳入研究文献结果采用异质性检验。若P>0.1,I2 < 50%,则研究结果间的异质性无统计学差异,且偏向同质,选取固定效应模型(fixed effects model,FEM)进行分析;若 P≤0.1,I2>50%,则研究数据间的异质性有统计学意义,且异质性大,使用随机效应模型(random effects model,REM)进行统计学分析。若异质性显著,首先分析产生异质性的原因,进而分亚组进行统计分析;如异质性大或其来源不明则放弃合并分析,只对其进行描述性分析。利用Review Manager 5.3软件绘制漏斗图(funnel plots)评价是否存在发表偏倚。由于本Meta分析纳入文献少,主观判断漏斗图是否对称来鉴定“发表偏倚”更容易产生相反的结论,故采用Begg’s检验和 Egger’s 检验定量检验漏斗图的对称性[6]。以P<0.05为差异有统计学意义,存在发表偏倚[7]。
2 结果 2.1 基本检索情况共检索到中英文文献821篇,通过阅读文献题目和摘要首先剔除与本研究明显不相关文献616篇,进而除外了113篇综述,22篇动物实验,最终选择并检索70篇文献全文,其中27篇因观察性研究被排除,34篇因仔细阅读全文后数据不充分被除外,最终纳入9篇符合本次Meta分析纳入标准的文献[8, 9, 10, 11, 12, 13, 14, 15, 16]。9项研究共包括1227例患者,其中他汀类药物治疗组616例患者,对照组611例患者,纳入文献的一般特征见表 1和2。
| Study (Author/Year | District | Characteristicof patients | Dosage and usage | Simple size(E/C) | Age(E/C)(year) | Male ratio(E/C) ( η/%) | |
| E | C | ||||||
| Novak V, et al [10]/2009 | Israel | Patients with bacterial infection | Simvastatin,20 mg,po;QD;hospital discharge or the development of severe sepsis | Placebo | 83(42/41) | 66.0±17.2/72.7 ±13.8 | 35.7/39.0 |
| Kruger PS, et al [11]/2011 | Australia | Patients requiring hospitalization for infection | Atorvastatin,20 mg,po;QD; up to a maximum of 28 d | Placebo | 150(75/75) | 68.2±12.7/68.5±11.9 | 64.0/65.0 |
| Makris D, et al [15]/2011 | Greece | Patients with mechanical ventilation | Pravastatin,40 mg;po;QD;30 d | Non-placebo | 152(71/81) | 56.2±1.9/55.9±2.1 | 74.6/65.4 |
| Patel JM, et al [14]/2012 | UK | Patients with sepsis | Atorvastatin,40 mg,po;QD; a maximum of 28 d | Placebo | 100(49/51) | 62.8±21.2/64.0±15.6 | 51.0/51.0 |
| Kruger P, et al [13]/2013 | Australia | Patients with severe sepsis | Atorvastatin,20 mg;po;QD; 14 d or until death or discharge from ICU | Placebo | 250(123/127) | 58(44-67)/64(50-75) | 59.0/65.0 |
| Papazian L, et al [8]/2013 | France | Patients with ventilator-associated pneumonia | Simvastatin,60 mg,po;QD;until ICU discharge,death,or 28 d | Placebo | 284(146/138) | 60.0±16.0/59.0±17.0 | 73.0/77.0 |
| Viasus D, et al [12]/2014 | Spain | Patients with community-acquired pneumonia | Simvastatin,60 mg,po;QD; 4 d | Placebo | 34(19/15) | 63(44.5-79.0)/76(45.5-78.0) | 73.7/80.0 |
| Sun GX,et al [9]/2012 | China | Patients with severe community-acquired pneumonia | Atorvastatin,20 mg,po;QD;14-28 d | Non-placebo | 65(35/30) | Unclear | Unclear |
| Shu P,et al [16]/2013 | China | Patients with sepsis(3 patients lost) | Atorvastatin,20 mg,po;QD;7 d | Non-placebo | 109(56/53) | 54.0±17.0/54.0±16.0 | 54.7/55.3 |
| E: Experimental group;C: Control group. | |||||||
| Study (Author/Year) | Time of hospital stay ( t/d) | Requirement of mechanical ventilation or ICU admission(E/C) | Hospital mortality rate (E/C) | CRP(mg·L -1) (E/C) | |
| E | C | ||||
| Novak V, et al [10]/2009 | 4(IQR 3-6) | 4(IQR 2-6) | 3/5 | 0/0 | Unclear |
| Kruger PS, et al [11]/2011 | 7(IQR 4-12) | 6(IQR 4-11) | 13/11 | 6/4 | Unclear |
| Makris D, et al [15]/2011 | 21.9±2.1 | 24.3±2.2 | 71/81 | 10/24 | 73 ±11/79 ±10 |
| Patel JM, et al [14]/2012 | 5(IQR 3-13) | 6(IQR 4-12) | 0/1 | Unclear | 194.6 ±114.6/ 188.0±127.3 |
| Kruger P, et al [13]/2013 | 18.3(IQR 11.0-38.7) | 22.7(IQR 12.4-37.0) | 123/127 | 16/23 | Unclear |
| Papazian L, et al [8]/2013 | 37(IQR 21-59) | 35(IQR 22-62) | 146/138 | 43/38 | Unclear |
| Viasus D, et al [12]/2014 | Unclear | Unclear | 4/5 | Unclear | 151.2 (59.5-243.6) / 69.4 (27.5-212.2) |
| Sun GX,et al [9]/2012 | 23.57±9.84 | 32.68±11.76 | Unclear | 3/ 5 | 32.83 ±10.68/ |
| Shu P,et al [16]/2013 | Unclear | Unclear | Unclear | 19±9/26±12 | 46.25 ±10.23 |
| E:Experimental group;C:Control group. | |||||
所有纳入文献均采用修改后的Jadad量表进行评分,本研究所纳入的9篇文献中,有4篇文献评分5分,2篇文献评分3分,其余文献均评分为3分。质量评分详见表 3。
| Study (Author/Year) | Randomizationmethod | Allocationconcealment | Blindingmethous | Withdraw | Jadad score |
| Novak V, et al [10]/2009 | 2 | 1 | 2 | 0 | 5 |
| Kruger PS, et al [11]/2011 | 2 | 1 | 2 | 0 | 5 |
| Makris D, et al [15]/2011 | 2 | 1 | 0 | 0 | 3 |
| Patel JM, et al [14]/2012 | 2 | 0 | 2 | 0 | 4 |
| Kruger P, et al [13]/2013 | 2 | 0 | 2 | 0 | 4 |
| Papazian L, et al [8]/2013 | 2 | 1 | 2 | 0 | 5 |
| Viasus D,et al [12]/2014 | 2 | 1 | 2 | 0 | 5 |
| Sun GX,et al [9]/2012 | 2 | 0 | 1 | 0 | 3 |
| Shu P,et al [16]/2013 | 2 | 0 | 1 | 0 | 3 |
有6篇文献[8, 9, 10, 11, 13, 15](共包括984例肺炎或脓毒症患者)对住院期间死亡率进行了临床观察研究。本文作者对所有纳入文献提取出的数据进行统计学分析,结果显示:各研究之间无明显统计学异质性(P=0.19,I2=35%),故应用固定效应模型进行统计学分析。6个研究数据经统计学分析得出:合并RR=0.83,95%CI(0.63,1.08),P=0.17,因此接受他汀类药物治疗的肺炎或脓毒症患者的住院期间死亡率与对照组比较差异无统计学意义。见图 1。
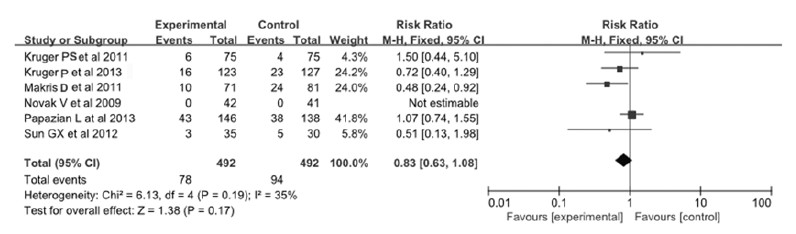
|
| 图1 他汀类药物与患者住院期间死亡率相关性的森林图 Fig.1 Forest plots of correlation between statins and hospitalized mortality rates of patients |
发表偏移的评估使用Review Manager 5.3软件绘制的漏斗图(图 2)。漏斗图中缺失1篇文献的数据,表明此漏斗图并不对称。因此采用Begg’s检验和Egger’s检验对总有效率的数据进行定量的偏倚性分析,结果显示: Begg’s检验P=0.327 >0.05,Egger’s检验P=0.174>0.05,表明不存在发表偏倚,上述结论较为可靠。
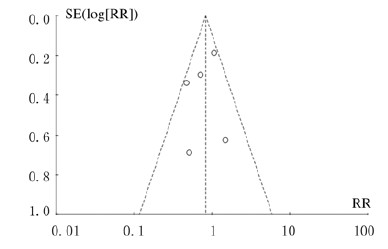
|
| 图2 他汀类药物与患者住院死亡率相关性的漏斗图 Fig.2 Funnel plots of correlation between statins and hospitalized mortality rates of patients |
对纳入研究的敏感性分析采用以下2种方法:① 使用随机效应模型再次进行统计学分析。所得合并RR=0.80,95%CI(0.54,1.17),P=0.24。② 剔除质量相对较低的文献(质量评分在3分及3分以下)后再次进行统计学分析,所得合并RR=0.97,95%CI(0.72,1.32),P=0.87。综合上述2种方法所得合并RR值结果大致相同,说明试验结果稳定性较好。
2.4 他汀类药物与患者需机械通气或入住ICU治疗的相关性 2.4.1 Meta分析有7篇文献[8, 10, 11, 12, 13, 14, 15]共1 053例肺炎或脓毒症患者接受了跟踪随访,随访的主要内容为需机械通气或入住ICU治疗的人数。对其进行异质性检验,结果显示:P=0.56,I2=0%;表明结果间具有同质性,可选择固定效应模型进行统计学分析。经分析得出结论:合并RR=0.99,95%CI(0.96,1.03),P=0.62。因此他汀组与对照组比较,肺炎或脓毒症患者需要机械通气或入住ICU治疗人数之间差异无统计学意义,说明从目前研究来看他汀类药物治疗未降低机械通气或入住ICU治疗的比率。 见图 3。
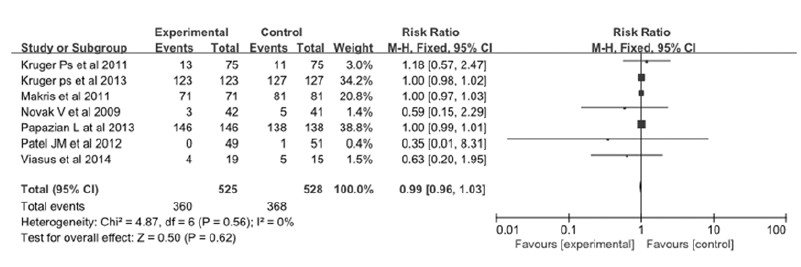
|
| 图3 他汀类药物与患者需机械通气或入住ICU相关性的森林图 Fig.3 Forest plots of correlation between statins and requirements of mechanical ventilation or ICU of patients |
发表偏倚的评估采用Review Manager 5.3软件绘制的漏斗图(图 4)。漏斗图明显不对称,考虑与所研究文献数量少及样本小有关。通过Begg’s检验及Egger’s检验对总有效率的数据进行定量偏倚性分析,Begg’s检验:P=0.317 >0.05;Egger’s检验:P=0.164>0.05,表明不存在发表偏移。
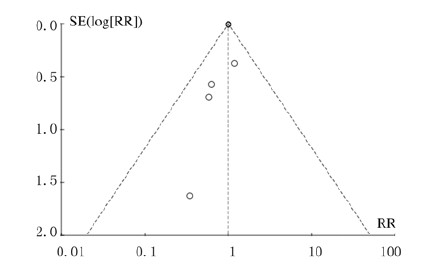
|
| 图4 他汀类药物与患者需机械通气或入住ICU的相关性的漏斗图 Fig.4 Funnel plots of correlation between statins and requirements of mechanical ventilation or ICU of patients |
敏感性分析采用上述2种方法进行:① 使用随机效应模型进行统计学分析,所得合并RR=1.00,95%CI(0.99,1.01),P=0.99。② 剔除质量相对较低的文献(质量评分在3分及3分以下)后进行统计学分析,所得合并RR=0.99,95%CI(0.95,1.03),P=0.61。综合上述2种方法所得合并RR值结果大致相同,说明结果稳定性较好。
2.5 他汀类药物与患者CRP水平相关性 2.5.1 Meta分析本次Meta分析所纳入的文献中共有5篇文献[9, 12, 14, 15, 16]详细记录了肺炎或脓毒症患者血浆CRP水平的变化。但Viasus等[12]的研究因缺乏CRP水平的标准差无法进行统计学分析,因此共有4篇文献426例肺炎或脓毒症患者纳入本次Meta分析。对纳入的研究进行异质性分析发现:各研究间存在轻度异质性(P=0.10,I2=52%),故选用随机效应模型进行合并分析。4项研究数据结果进行统计学分析后得出:MD=-8.30mg·L-1,95%CI(-12.13,-4.47),P<0.0001,他汀组与对照组之间比较差异有统计学意义,他汀组患者的CRP水平明显降低。见图 5。为了探讨统计结果异质性的出处,本研究依据他汀类药物种类的不同将纳入研究分阿托伐他汀组和普伐他汀组2个亚组进行统计学分析,以观察研究结果的异质性是否来自于不同的他汀类药物 (图 6)。亚组分析结果显示:普伐他汀组仅包含1项研究,MD=-6.00mg·L-1,95%CI(-9.36,-2.64),P<0.0001;阿托伐他汀组包含3项研究,MD=-9.74mg·L-1 ,95%CI(-15.45,-4.02),P<0.0001。上述结果表明:各亚组中所阐述的他汀类药物均能降低肺炎或脓毒症患者的CRP水平。阿托伐他汀组P=0.12,I2=53%,仍存在轻度异质性,考虑可能与阿托伐他汀应用剂量不同或应用时间长短不同有关,因该亚组纳入研究数量较少,不再进行亚组分析。
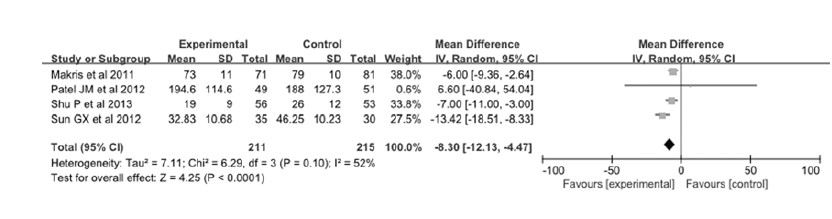
|
| 图5 他汀类药物与肺炎及脓毒症患者CRP水平相关性的森林图 Fig.5 Forest plots of correlation between statins and CRP levels in patients with pneumonia and sepsis |
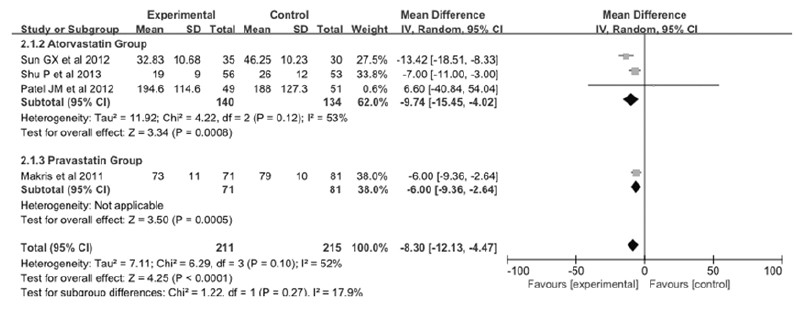
|
| 图6 他汀类药物与肺炎或脓毒症患者CRP水平相关性亚组分析的森林图 Fig.6 Forest plots of subgroup analysis of correlation between statins and CRP levels in patients with pneumonia and sepsis |
发表偏移的评估使用Review Manager 5.3软件绘制的漏斗图(图 7)。图中所示的漏斗图中缺失1篇文献的数据,表明此漏斗图并不对称。因此采用Begg’s检验和Egger’s检验对总有效率的数据进行定量的偏倚性分析。Begg’s检验显示P=0.497 >0.05,Egger’s检验结果提示P=0.747>0.05,表明不存在发表偏移。
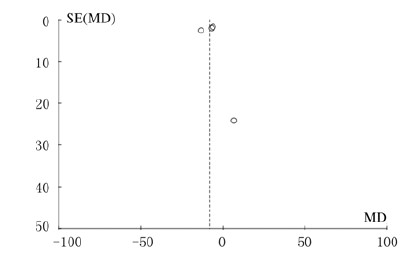
|
| 图7 他汀类药物与肺炎或脓毒症患者CRP水平相关性的漏斗图 Fig.7 Funnel plots of correlation between statins and CRP levels in patients with pneumonia and sepsis |
敏感性分析通过改变效应模型为固定效应模型再次进行统计学分析来完成。采用固定效应模型合并效应量所得MD=-7.81mg·L-1,95%CI(-10.10,-5.51),P<0.0001,与随机效应模型所得MD值大致相同。所纳入的4篇文献中,1篇文献的质量评分为4分,其余3篇均评分为3分,文献质量相对较低。因此该统计分析结果稳定性相对欠佳。
2.6 他汀类药物与患者细胞因子水平的相关性本Meta分析所纳入的随机对照试验中,有5项研究描述了他汀类药物与细胞因子间的相关性,因各研究中应用的检测方法不同、数据统计不完善等因素,无法进行Meta分析。随机对照试验[9, 10, 11, 12, 14]研究证明:治疗前2组患者IL-6和TNF-α水平均升高,治疗后实验组患者的IL-6和TNF-α水平均明显降低,且治疗组较对照组降低更明显,2组间比较差异有统计学意义(P < 0.05)。
3 讨论肺炎及脓毒症皆是临床上常见的细菌感染性疾病。虽然大量强效抗生素的问世和机械通气等支持辅助技术的发展为疾病治疗提供了保障,但患者住院率及死亡率仍居高不下,为患者带来了极大的痛苦及沉重的经济负担。另外,多种耐药菌的出现更为肺炎及脓毒症的治疗增加了难度。这就要求尽快寻找和开发非抗生素辅助治疗药物。
他汀类药物是目前临床上常用的降血脂及降心血管疾病患病率及病死率的药物之一。他汀类药物的多效性受到国内外学者的关注。国内外针对他汀类药物是否能治疗肺炎及脓毒症方面的研究已开展数年,争论颇多。Xing等[17]发现:阿托伐他汀可以显著抑制人类肺泡上皮细胞的脂多糖介导的CRP的表达。Iwata等[18]证实:他汀类药物抑制人类支气管上皮细胞的炎性细胞因子的表达,如IL-6、IL-8和TNF-α。以上结论均表明他汀类药物具有良好的抗炎作用。Troeman等[19]研究证明:他汀类药物可降低肺部感染的发生率,减少其死亡率。同时有动物实验[20]证实:他汀类药物可提高脓毒症小鼠的生存率。然而,Kruger等[13]研究了他汀类药物与脓毒症发生率的关系证明:他汀类药物并未降低疾病发生率。上述各研究的研究方法、研究对象各异,得到的结论不一,导致可信度降低。
本研究采用Meta分析的方法,对国内外他汀类药物治疗肺炎或脓毒症患者的随机对照试验进行研究。共纳入9个随机对照试验,共计1193例患者,选取住院期间死亡率、需机械通气或入住ICU治疗的比率、CRP水平进行Meta分析。他汀类药物与肺炎或脓毒症患者住院期间死亡率相关性的研究表明:他汀类药物不能降低肺炎或脓毒症患者住院期间死亡率。他汀类药物与患者需机械通气或入住ICU治疗的相关性进行研究表明:他汀类药物在改善肺炎或脓毒症是否需机械通气或入住ICU方面无差异。在他汀类药物与肺炎或脓毒症患者CRP水平的相关性研究表明:他汀类药物可以降低肺炎或脓毒症患者的CRP水平。共有5个随机对照试验描述了他汀类药物与细胞因子间的相关性,均表明他汀类药物可以降低细菌性疾病患者TNF-α、IL-1和IL-6等促炎细胞因子的水平。因此,炎性细胞因子可能作为评价疾病程度的指标,但仍需继续跟踪调查并收集更多的临床研究数据以验证结论正确性。
本次Meta分析与既往已发表的对观察性及回顾性研究进行的Meta分析结果显然不同,研究结论不一致的重要原因考虑研究方法的差异,观察性研究存在着无法避免的多项混杂变量因素。另一种解释结论不一致的原因可能是:大多数观察性及回顾性研究主要侧重他汀类药物对疾病的预防方面;而随机对照试验侧重于他汀类药物对疾病的治疗方面。即使对观察性研究结果的稳定性进行了敏感性分析,分析结果未见明显发表偏倚,但仍不能确定完全避免发表偏倚的存在。
本研究是一篇关于他汀类药物治疗肺炎或脓毒症疗效的荟萃分析研究,其结果很大程度受Meta分析所纳入文献质量高低的影响。本次Meta分析以Jadad质量评估纳入的文献有6篇4分以上的高质量文献是研究结果正确性的基础。同时各研究方向的相关数据通过统计学分析后进行发表偏倚分析及敏感性分析,表明不存在发表偏倚,且数据稳定,证实本研究结论可信度较高。
本研究仍存在着自身局限性:①本次Meta分析纳入文献数量相对较少,且入选文献的样本量较少,不可避免地在试验时出现不足;②除了患者疾病严重程度影响需机械通气或入住ICU的比率外,还受众多因素的影响,如医生对于患者病情的认识、患者的治疗需求、患者是否耐受机械通气的治疗等,因此把机械通气或入住ICU治疗作为疾病观察指标有一定的局限性;③对于CRP水平相关性的研究中,纳入文献较少,样本量小,且文献质量相对较低,进行亚组分析时由于文献数量较少,使得结果稳定性欠佳,因此他汀类药物对CRP水平的影响及程度仍需大样本量的研究进一步证实;④因检测结果不同、缺乏具体数据等多因素影响,他汀类药物与肺炎或脓毒症患者细胞因子水平的相关性无法进行Meta分析,这方面有待于进一步深入研究。
总之,他汀类药物不能降低肺炎或脓毒症患者住院期间死亡率及机械通气或入住ICU次数,但可以降低肺炎或脓毒症患者的CRP水平,可能会降低TNF-α、IL-1和IL-6等促炎细胞因子的水平并减轻全身炎症反应。
| [1] | De Loecker I,Preiser JC.Statins in the critically ill[J].Ann Intensive Care,2012,2(1):19. |
| [2] | Abeles AM,Pillinger MH.Statins as antiinflammatory and immunomodulatory agents:a future in rheumatologic therapy?[J].Arthritis Rheum,2006,54(2):393-407. |
| [3] | Khan AR,Riaz M,Bin Abdulhak AA,et al.The role of statins in prevention and treatment of community acquired pneumonia:a systematic review and meta-analysis[J].PLoS One,2013,8(1):e52929. |
| [4] | Kwok CS,Yeong JK,Turner RM,et al.Statins and associated risk of pneumonia:a systematic review and meta-analysis of observational studies[J].Eur J Clin Pharmacol,2012,68(5):747-755. |
| [5] | Wan YD,Sun TW,Kan QC,et al.Effect of statin therapy on mortality from infection and sepsis:a meta-analysis of randomized and observational studies[J].Crit Care,2014,18:R71. |
| [6] | 郑辉烈,王忠旭,王增珍.Meta分析中发表偏倚的Begg's检验,Egger's检验及Macaskill's检验的SAS程序实现[J].中国循证医学杂志,2009,9(8):910-916. |
| [7] | Sterne JA,Gavaghan D,Egger M.Publication and related bias in meta-analysis:power of statistical tests and prevalence in the literature[J].J Clin Epidemiol,2000,53(11):1119-1129. |
| [8] | Papazian L,Roch A,Charles PE,et al.Effect of statin therapy on mortality in patients with ventilator-associated pneumonia:a randomized clinical trial[J].JAMA,2013,310(16):1692-1700. |
| [9] | 孙广信,李国燕,李振华.阿托伐他汀辅助治疗重症社区获得性肺炎的临床探索[J].中国卫生产业,2012,9(19):78. |
| [10] | Novack V,Eisinger M,Frenkel A,et al.The effects of statin therapy on inflammatory cytokines in patients with bacterial infections:a randomized double-blind placebo controlled clinical trial[J].Intens Care Med,2009,35(7):1255-1260. |
| [11] | Kruger PS,Harward ML,Jones MA,et al.Continuation of statin therapy in patients with presumed infection:a randomized controlled trial[J].Am J Respir Crit Care Med,2011,183(6):774-781. |
| [12] | Viasus D,Garcia-Vidal C,Simonetti AF,et al.The effect of simvastatin on inflammatory cytokines in community-acquired pneumonia:a randomised,double-blind,placebo-controlled trial[J].BMJ Open,2015,5(1):e006251. |
| [13] | Kruger P,Bailey M,Bellomo R,et al.A multicenter randomized trial of atorvastatin therapy in intensive care patients with severe sepsis[J].Am J Respir Crit Care Med,2013,187(7):743-750. |
| [14] | Patel JM,Snaith C,Thickett DR,et al.Randomized double-blind placebo-controlled trial of 40 mg/day of atorvastatin in reducing the severity of sepsis in ward patients (ASEPSIS Trial)[J].Crit Care,2012,16(6):R231. |
| [15] | Makris D,Manoulakas E,Komnos A,et al.Effect of pravastatin on the frequency of ventilator-associated pneumonia and on intensive care unit mortality:Open-label,randomized study[J].Crit Care Med,2011,39(11):2440-2446. |
| [16] | 舒平,周慧云,黄志刚,等.阿托伐他汀对脓毒症患者急性肾损伤的保护作用[J].中华危重症医学杂志:电子版,2013,6(2):5-9. |
| [17] | Xing XQ,Duan S,Wu XW,et al.Atorvastatin reduces lipopolysaccharide-induced expression of C-reactive protein in human lung epithelial cells[J].Mol Med Rep,2011,4(4):753-757. |
| [18] | Iwata A,Shirai R,Ishii H,et al.Inhibitory effect of statins on inflammatory cytokine production from human bronchial epithelial cells[J].Clin Exp Immunol,2012,168(2):234-240. |
| [19] | Troeman DP,Postma DF,van Werkhoven CH,et al.The immunomodulatory effects of statins in community-acquired pneumonia:a systematic review[J].J Infect,2013,67(2):93-101. |
| [20] | Merx MW,Liehn EA,Graf J,et al.Statin treatment after onset of sepsis in a murine model improves survival[J].Circulation,2005,112(1):117-124. |
 2016, Vol. 42
2016, Vol. 42


