扩展功能
文章信息
- 樊锐太, 张恒, 王鑫, 顾浩
- FAN Ruitai, ZHANG Heng, WANG Xin, GU Hao
- 胶质瘤患者T淋巴细胞表面CTLA-4的表达及其临床意义
- Expression of CTLA-4 in T lymphocytes of patients with glioma and its clinical significance
- 吉林大学学报(医学版), 2016, 42(02): 311-315
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 311-315
- 10.13481/j.1671-587x.20160223
-
文章历史
- 收稿日期: 2015-08-12
胶质瘤是一种常见的恶性肿瘤,尽管给予标准治疗,但预后依然很差[1, 2],其中胶质母细胞瘤患者的中位生存期仅约14个月,5年生存率不足10%[3]。因此,找到更敏感的疗效预测指标及更好的治疗策略显得极其重要。肿瘤免疫治疗是利用自身的免疫系统来识别和摧毁肿瘤细胞,其中主要效应细胞为CD8+T细胞,即细胞毒性T细胞,而CD4+T细胞主要起协助体液免疫和细胞免疫的功能。细胞毒性T淋巴细胞相关抗原4(CTLA-4,也称为CD152)经诱导表达在活化的CD4+和CD8+T细胞表面,能抑制T细胞的抗肿瘤作用[4],在肿瘤的免疫抑制中起到重要作用。既往研究[5, 6]发现:CTLA-4在卵巢癌和黑色素瘤等肿瘤中表达升高,但有关CTLA-4在胶质瘤中表达尚无文献报道。本研究通过比较胶质瘤患者和健康人外周血CD4+和CD8+T细胞中CTLA-4的表达,探讨CTLA-4与WHO分级及手术的关系。
1 资料与方法 1.1 研究对象选择2015年1—6月在郑州大学第一附属医院手术确诊的胶质瘤患者60例(胶质瘤组)和同期健康献血者46名(对照组)。根据WHO分级,胶质瘤组中Ⅰ级9例,Ⅱ级15例,Ⅲ级20例,Ⅳ级16例。胶质瘤组和对照组在年龄、性别和吸烟与否等方面分布差异无统计学意义(P>0.05),具有可比性。见表 1。
| (n,η/%) | |||||||||||
| Group | n | Gender | Age | Smoking | WHO grade | ||||||
| Male | Famale | Children Adults | Yes | No | Ⅰ | Ⅱ | Ⅲ | Ⅳ | |||
| Control | 46 | 29(63.0) | 17(37.0) | 7(15.2) 39(84.8) | 21(45.7) | 25(54.3) | — | — | — | — | |
| Glioma | 60 | 37(61.7) | 23(38.3) | 11(18.3) 49(81.7) | 25(41.7) | 35(58.3) | 9(15.0) | 15(25.0) | 20(33.3) | 16(26.7) | |
| ": Nodata. | |||||||||||
单克隆抗体(美国Biolegend公司),淋巴细胞分离液(天津灏洋生物制品科技有限责任公司)。 FACScantoll流式细胞仪(美国BD公司)。
1.3 实验流程收集胶质瘤组(手术前12d、手术后57d)及健康对照组研究对象晨起空腹静脉血,利用密度梯度离心法分离外周血中的单个核细胞(PBMCs),1000r·min-1 离心10min,弃上清。加入1mL PBS 重悬细胞,调整细胞浓度为1×106mL-1。取单细胞悬液0.1mL,分别加入5μL抗CD3-APCCY7单克隆抗体、CD4-PERCP单克隆抗体、 CD8-APC克隆抗体及CTLA-4-PE单克隆抗体,室温孵育30min。加入10mLPBS,混合均匀,1000 r·min-1 离心10min,弃去上清液;重复1次。加入0.1mLPBS,重悬,采用流式细胞仪分别测定CD4+和CD8+T淋巴细胞表面CTLA-4表达率,其表达率以百分比表示。
1.4 统计学分析采用SPSS21.0软件进行统计学分析。2组研究对象年龄、性别和吸烟状态组间差异比较采用χ2检验;2组研究对象CD4+和CD8+T细胞表面CTLA-4表达水平以x±s表示,组间比较采用t检验,胶质瘤患者手术前后CTLA-4表达水平比较采用配对样本t检验。采用GraphPad Prism绘制统计图。以P < 0.05为差异有统计学意义。
2 结果 2.1 胶质瘤组和对照组研究对象CD4+和CD8+T细胞表面CTLA-4表达水平胶质瘤组患者外周血CD4+T细胞中CTLA-4的表达水平高于对照组[(21.12±1.66)% vs (8.48±0.77)%,t=6.263,P < 0.01],胶质瘤组患者外周血CD8+T细胞中CTLA-4的表达水平高于对照组[(33.57±2.64)% vs (12.62±0.89)%,t=6.682,P < 0.01]。见图 1。
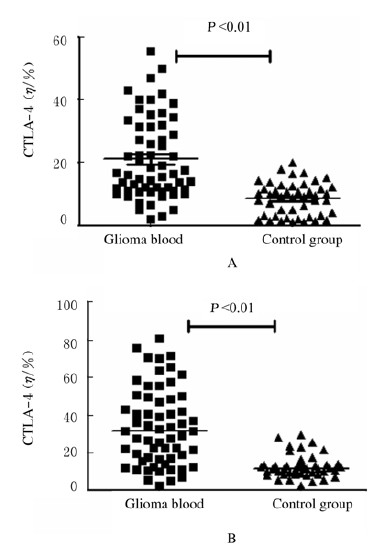
|
| 图1 胶质瘤组与对照组研究对象CD4+(A)CD8+(B)T细胞表面CTLA-4表达水平 Fig.1 Expression levels of CTLA-4 in CD4+(A) and CD8+(B)T cells of subjects in glioma group and control group |
WHO分级代表着胶质瘤的恶性程度,依据分级的结果显示:在CD4+T细胞表面,Ⅳ级胶质瘤患者CTLA-4的表达水平最高,Ⅳ级胶质瘤患者CTLA-4表达水平高于Ⅲ级胶质瘤患者(P < 0.01),Ⅲ级胶质瘤患者CTLA-4表达水平高于Ⅱ级胶质瘤患者(P < 0.01),Ⅰ与Ⅱ级胶质瘤患者CTLA-4表达水平比较差异无统计学意义(P>0.05)。在CD8+T细胞表面,Ⅳ级胶质瘤患者CTLA-4表达水平最高,Ⅳ级胶质瘤患者CTLA-4表达水平高于Ⅲ级胶质瘤患者(P < 0.01),Ⅲ级胶质瘤患者CTLA-4表达水平高于Ⅱ级胶质瘤患者(P < 0.01),且Ⅱ级胶质瘤患者CTLA-4表达水平高于Ⅰ级胶质瘤患者(P < 0.05)。见表 2。
| (x±s,η/%) | |||
| Group(Grade) | n | CTLA-4 | |
| CD4+T cells | CD8+T cells | ||
| Ⅰ | 9 | 9.467±1.092 | 8 733±1.103* |
| Ⅱ | 15 | 10.850±0.972 | 17.400±1.360 |
| Ⅲ | 20 | 21.200±1.894* | 35.140±1.641 |
| Ⅳ | 16 | 37.190±2.253? | 60.730±2.739? |
| *P < 0.05 compared with grade Ⅱ; ?P < 0.05 compared with grade Ⅲ | |||
手术后胶质瘤患者CD4+T细胞表面CTLA-4的表达水平低于术前[(15.06±1.31)% vs (21.12±1.66)%,t=7.233,P < 0.01],而CD8+T细胞 表面CTLA-4的表达水平下降更为显著[(18.69±1.72 )% vs (33.57±2.64)% ,t=8.740,P < 0.01] 。见图 2。
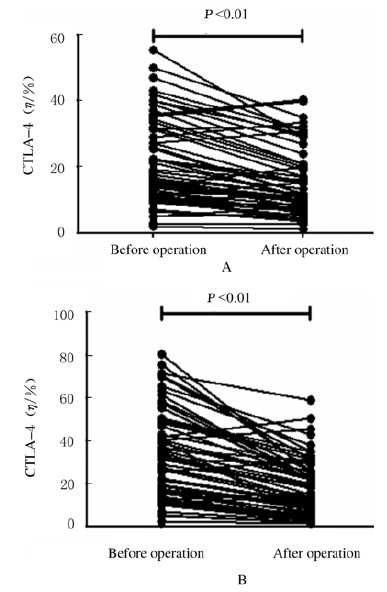
|
| 图2 胶质瘤患者手术前后CD4+(A)和CD8+(B)T细胞表面CTLA-4表达水平 Fig.2 Expression levels of CTLA-4 in CD4+T (A) and CD8+(B) T cells of patients in glioma group before and after operation |
CTLA-4是CD28受体家族的一员,经诱导表达在活化的CD4+和CD8+T细胞表面,CTLA-4可以与共刺激受体CD28竞争性结合抗原提呈细胞表面的B7.1 (CD80) 受体和 B7.2 (CD86)受体,由于CTLA-4较CD28有更高的亲和性,其能减少CD28依赖的共刺激作用,从而抑制T细胞的功能。T细胞表面CTLA-4的表达也能够抑制主要组织相容性复合体(major histocompatibility complex,MHC)与T细胞受体(T cell receptor,TCR)的结合,抑制T细胞发挥抗肿瘤的作用[4]。CTLA-4还高表达于CD4+CD25+FOXP3+调节性T细胞(Tregs)细胞表面,在免疫抑制中起到重要作用。
胶质瘤的发病机制尚未完全阐明,既往研究[4]发现:肿瘤微环境在肿瘤的发生发展过程中扮演着重要的角色。在肿瘤微环境中,CTLA-4能够抑制抗肿瘤免疫反应。目前有关T细胞表面CTLA-4表达水平与胶质瘤临床病理特征、发生发展及预后的关系的研究尚未见报道。本研究发现:在胶质瘤CD4+和CD8+T细胞表面CTLA-4表达水平高于对照组,表明CTLA-4可能在胶质瘤的发病过程中通过抑制免疫反应而起到重要作用。CTLA-4表达水平随胶质瘤分级升高而升高,提示CTLA-4能够预测胶质瘤的恶性程度,并可能成为一个潜在的分级指标。纳入本研究的患者均进行了手术治疗,手术后CTLA-4表达水平降低,其中CD8+T细胞尤为明显,提示CTLA-4在胶质瘤的发展过程中扮演重要角色,胶质瘤患者的免疫抑制在手术后明显减轻。本研究证明了CTLA-4表达水平低的患者有着更长的术后总生存时间,说明CTLA-4表达水平升高可以作为胶质瘤的一个预后不良因素。
术后替莫唑胺同步放化疗后行替莫唑胺辅助化疗是胶质母细胞瘤标准治疗方案,但预后仍然很差。两项大型的Ⅲ期临床试验(放射治疗肿瘤学组RTOG0825和AVAglio研究)显示:在一线放疗联合替莫唑胺化疗基础上加用贝伐单抗,并不能延长总生存期,仅可以延长无进展生存期,而且这种血管生成抑制剂与更差的神经认知和生活质量结局相关,这也在一定程度上限制了贝伐单抗的应用[7, 8]。
肿瘤的免疫治疗相对于传统化疗有着更高的特异性和更低的毒性,同时免疫记忆被激活,能提供持久的疗效。但是,肿瘤免疫治疗的疗效能够被免疫抑制及局部肿瘤的免疫耐受所限制,其中CTLA-4和PD-1等是抑制免疫的主要效应分子。在黑色素瘤、肺癌等恶性肿瘤,抗PD-1抗体已经显示出初步疗效,Sandra等[9]证明:在小鼠4T1乳腺癌模型中抗CTLA-4抗体联合放疗能够引发CD8+T细胞介导的抗肿瘤反应,从而抑制放疗照射野外的转移及延长生存期。研究者[10, 11]已经在在动物模型中证实:抑制CTLA-4能够再活化抗肿瘤免疫反应从而引起肿瘤缩小,其中的机制尚未阐明。目前研究[12]显示:抗CTLA-4抗体不仅阻断T细胞的抑制信号而且能够清除肿瘤微环境中的调节性T细胞。本研究结果表明:CTLA-4在胶质瘤的发生、发展及分级中发挥重要的作用,这也为应用抗CTLA-4抗体治疗胶质瘤提供了理论依据。
放疗在提高局部肿瘤控制率的同时,也可以与免疫治疗协同作用。放疗通过趋化因子、细胞因子、黏附分子等使效应T细胞聚集,抑制肿瘤,同时诱导肿瘤细胞的免疫原性死亡,增加肿瘤抗原的表达,从而增强树突状细胞交叉提呈肿瘤抗原给T细胞[13],进而引起免疫介导的放疗照射野内外的肿瘤退缩,但CTLA-4可以通过阻断免疫的抗肿瘤作用而抑制这一过程。目前,基于临床前试验能够应用于人体的有2种抗体,分别为ipilimumab和tremelimumab,在联合放疗、化疗等肿瘤治疗方面均有很好的效果,但在胶质瘤领域尚无相关文献报道。相信在胶质瘤中放化疗联合贝伐单抗和免疫治疗的组合将会取得不错的疗效。
综上所述,CD4+和CD8+T细胞表面CTLA-4的表达上调与胶质瘤的发生发展、肿瘤的恶性程度及患者的预后相关,并且可能作为未来治疗胶质瘤的有效靶点。本课题组下一步工作是研究CTLA-4的表达水平在放化疗过程中的变化,并更深入地探讨其中的机制。
| [1] | Stupp R,Hegi ME,Mason WP,et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol,2009,10(5):459-466. |
| [2] | Belcaid Z,Phallen JA,Zeng J,et al.Focal radiation therapy combined with 4-1BB activation and CTLA-4 blockade yields long-term survival and a protective antigen-specific memory response in a murine glioma model[J].PLoS One,2014,9(7):e101764. |
| [3] | Weller M,Cloughesy T,Perry JR,et al.Standards of care for treatment of recurrent glioblastoma-are we there yet?[J].Neurol Oncol,2013,15(1):4-27. |
| [4] | Nirschl CJ,Drake CG.Molecular pathways:coexpression of immune checkpoint molecules:signaling pathways and implications for cancer immunotherapy[J].Clin Cancer Res,2013,19(18):4917-4924. |
| [5] | Tahtinen S,Kaikkonen S,Merisalo-Soikkeli M,et al.Favorable alteration of tumor microenvironment by immunomodulatory cytokines for efficient T-cell therapy in solid tumors[J].PLoS One,2015,10(6):e131242. |
| [6] | Zhang S,Ke X,Zeng S,et al.Analysis of CD8+Treg cells in patients with ovarian cancer:a possible mechanism for immune impairment[J].Cell Mol Immunol,2015,12(5):580-591. |
| [7] | Gilbert MR,Dignam JJ,Armstrong TS,et al.A randomized trial of bevacizumab for newly diagnosed glioblastoma[J].N Engl J Med,2014,370(8):699-708. |
| [8] | Chinot OL,Wick W,Mason W,et al.Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma[J].N Engl J Med,2014,370(8):709-722. |
| [9] | Demaria S,Kawashima N,Yang AM,et al.Immune-mediated inhibition of metastases after treatment with local radiation and CTLA-4 blockade in a mouse model of breast cancer[J].Clin Cancer Res,2005,11(2 Pt 1):728-734. |
| [10] | Leach DR,Krummel MF,Allison JP.Enhancement of antitumor immunity by CTLA-4 blockade[J].Science,1996,271(5256):1734-1736. |
| [11] | Quezada SA,Simpson TR,Peggs KS,et al.Tumor-reactive CD4+T cells develop cytotoxic activity and eradicate large established melanoma after transfer into lymphopenic hosts[J].J Exp Med,2010,207(3):637-650. |
| [12] | Peggs KS,Quezada SA,Chambers CA,et al.Blockade of CTLA-4 on both effector and regulatory T cell compartments contributes to the antitumor activity of anti-CTLA-4 antibodies[J].J Exp Med,2009,206(8):1717-1725. |
| [13] | Vanpouille-Box C,Pilones KA,Wennerberg E,et al.In situ vaccination by radiotherapy to improve responses to anti-CTLA-4 treatment[J].Vaccine,2015,33(51):7415-7422. |
 2016, Vol. 42
2016, Vol. 42
