扩展功能
文章信息
- 李倩, 李劲高, 周茂华, 廖鹏军, 彭琪, 陈景, 陈少贤, 魏姗姗, 黄晖婷, 佘妙容
- LI Qian, LI Jingao, ZHOU Maohua, LIAO Pengjun, PENG Qi, CHEN Jing, CHEN Shaoxian, WEI Shanshan, HUANG Huiting, SHE Miaorong
- 白血病细胞CD56抗原表达与急性髓系白血病患者预后的关系
- Relationship between CD56 antigen expression in leukemia cells and prognosis of patients with acute myeloid leukemia
- 吉林大学学报(医学版), 2016, 42(02): 283-289
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 283-289
- 10.13481/j.1671-587x.20160218
-
文章历史
- 收稿日期: 2015-09-24
2. 广东省人民医院广东省医学科学院血液科, 广东广州 510080;
3. 中山大学孙逸仙纪念医院肾内科, 广东广州 510120;
4. 广东省人民医院广东省医学科学院检验科, 广东广州 510080;
5. 广东省人民医院广东省医学科学院病理生理研究室, 广东广州 510080
2. Department of Hematology, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
3. Department of Nephrology, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, China;
4. Department of Laboratory Medicine, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
5. Department of Pathophysiology, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
急性髓系白血病(acute myeloid leukemia,AML)是一类源于白血病干细胞的异质性恶性疾病,其发病率逐年上升[1]。对AML的标准治疗包括诱导治疗和巩固治疗,但仍有20%~40%的患者不能达到完全缓解(complete remission,CR),超过60%的患者最终复发。除了年龄外,临床上常规在治疗前检测细胞遗传学和分子遗传学改变、白细胞计数、骨髓原始细胞数和脾肿大等作为预后的标记,其中细胞遗传学和分子遗传学提供最重要的预后信息。但仍迫切需要能早期可靠预测预后的指标以指导治疗。免疫表型可以帮助对AML作出更精确的诊断和分型,但其在评估预后中的价值仍有争议。CD56抗原作为免疫球蛋白家族的一员,是一种同型人神经细胞黏附分子,能够介导细胞黏附和细胞毒性[2],其在AML预后方面的研究已有多篇报道,但CD56对预后的预测作用观点不一致[3],可能与年龄、化疗方案、人种和病例数多少有关。因此,本研究探讨CD56表达与特定AML患者预后的关系,以14~60岁初诊AML患者为研究对象,以去甲氧柔红霉素+阿糖胞苷(IA)方案为首次诱导方案,进一步比较CD56阳性表达率≥50%与CD56阳性表达率 < 50%患者的预后,为AML患者提供可靠的预后指标。
1 材料与方法 1.1 研究对象收集2009年1月—2015年5月广东省人民医院收治的初诊AML患者的临床资料。纳入标准:成人初诊AML患者首次诱导治疗方案为IA方案;患者均经临床及骨髓细胞形态学、组织细胞学染色和免疫组织化学检测确诊。排除标准:年龄大于60岁或小于14岁;已接受过化疗或放疗;继发于骨髓增生异常综合征或并发其他骨髓增殖性肿瘤;急性早幼粒细胞白血病(M3);随访时间小于30d。
1.2 CD56免疫表型检测取患者EDTA二钾抗凝骨髓50 μL(约106个细胞)注入试管,加入荧光标记的CD56单克隆抗体,室温避光孵育20 min,再向其中加入2 mL裂解液,室温避光放置5~10 min,离心弃上清,PBS洗涤细胞1次,加入0.5 mL1%多聚甲醛缓冲液固定,24 h内上机检测。每次检测前先用CellQuest软件获取10 000个细胞,用CD45/SSC设门识别白血病细胞群和各有核细胞群,分析白血病细胞群在各种分化抗原中的表达和图形。其中CD56抗原的表达大于20%即为表达阳性。单克隆抗体鼠抗人CD56 PE、相应荧光标记的同型对照及流式细胞仪均购自美国BD公司,红细胞裂解液为0.83%氯化铵,洗涤液为含0.5%小牛血清的PBS,固定液为1%多聚甲醛。CD56用平均荧光强度(MFI)和百分率表示,以≥20.00%为阳性。
1.3 疗效评估和随访方法主要终点评价指标为总生存时间(overall survival,OS)、无病生存时间(disease-free survival,DFS)、1年生存率和2年生存率,次要终点评价指标为完全缓解率(CRR)、总复发率和1年内复发率[4, 5]。随访起点为疾病确诊日期,2015年6月1日为随访截止日期;随访方式为门诊、住院复查记录;随访内容包括一般情况、临床症状、血常规和骨髓涂片。数据截止时未复发或死亡的患者作为删失值处理。
1.4 统计学分析应用SPSS 20.0统计软件进行统计学分析。采用COX回归模型研究患者生存时间的影响因素;采用双变量相关分析患者CD56百分率与OS间的相关分析;患者年龄、WBC计数采用中位数(M)及最小~最大值(Min~Max)表示;患者FAB分型和危险度分级组间比较采用Mann-Whitney U检验;研究对象性别、WBC>50×109 L-1人数、造血干细胞移植人数、完全缓解率(complete remission rate,CRR)、复发率等计数资料组间比较采用χ2检验;OS、DFS和生存率比较采用Log-rank检验;Kaplan -Meier方法描述生存曲线。
2 结果 2.1 一般临床特点本研究诱导方案为IA方案:第1~3天静脉滴注伊达比星(IDA)8~10 mg·m-2·d-1,第1~7天静脉滴注阿糖胞苷(Ara-c)100~200 mg·m-2·d-1。诱导治疗部分缓解(partial remission,PR)者继续给予IA方案诱导治疗1个疗程,未缓解(non-remission,NR)者给予氟达拉宾+Ara-c+粒细胞集落刺激因子(FLAG)方案或者环磷酰胺+Ara-c+拓扑替康(CAT)方案诱导治疗。CR者给予4个疗程大剂量Ara-c巩固治疗(第1、3、5天每12 h 1次静脉滴注Ara-c 2.0~3.0 g·m-2·d-1)(未按危险度分层),巩固治疗结束继续交替给予米托蒽醌+Ara-c(NA)、柔红霉素+Ara-c(DA)、吡柔比星+Ara-c(TA)方案序贯治疗,有条件行骨髓移植者则行异基因造血干细胞移植,复发患者给予FLAG方案或者CAT方案重新诱导治疗。化疗同时给予碱化、水化、输血和抗感染等对症支持治疗,化疗结束后第14天复查骨髓象。
本研究共纳入171例患者,其中CD56+患者52例,CD56-患者119例,CD56阳性表达率≥50%组39例,CD56阳性表达率 < 50%组13例。共51位患者进行异基因造血干细胞移植,其中CD56+组40例,CD56-组11例。本组患者随访率为81.3%,随访时间为1.0~75.1个月,中位随访时间为11.53个月。患者性别、年龄、FAB分型、初诊时WBC>50×109L-1人数、WBC计数、危险度分级和移植人数组间比较,均无统计学差异(P>0.05)。组间患者巩固治疗方案具有一致性(P>0.05)。CD56+患者为52例,占总例数的30.4%。CD56+患者主要分布在M2和M5型中,其中以M2最多。CD56+组和CD56-组临床资料比较差异无统计学意义(P>0.05),具有可比性。见表 1。
| Clinical characteristic | CD56- (n=119) | CD56+ (n=52) | χ2/U | P </td> | CD56≥50% (n=39) | CD56 < 50% (n=13) | χ2/U | P </td> |
| Age(year) | 42.0(15-60) | 41.5(14-60) | 2 957.5 | 0.647 | 40.0(14-60) | 43.0(18-59) | 213.0 | 0.392 |
| Gender(F/M) | 48/71 | 28/24 | 2.675 | 0.102 | 18/21 | 10/3 | 3.714 | 0.054 |
| FAB subtype | 2 987.5 | 0.707 | 253.0 | 0.991 | ||||
| M0 | 1(0.8) | 0(0) | 0(0) | 0(0) | ||||
| M1 | 11(9.2 | 3(5.8) | 3(7.7) | 0(0) | ||||
| M2 | 48(40.3) | 27(51.9) | 19(48.7) | 8(61.5) | ||||
| M4 | 18(15.1) | 3(5.8) | 2(5.1) | 1(7.7) | ||||
| M5 | 15(12.6) | 12(23.1) | 10(25.6) | 2(15.4) | ||||
| M6 | 6(5.0) | 0(0) | 0(0) | 0(0) | ||||
| M7 | 0(0) | 0(0) | 0(0) | 0(0) | ||||
| Missing/unknown | 20(16.8) | 7(13.5) | 5(12.8) | 2(15.4) | ||||
| WBC count >50×109L-1 | 30(25.2) | 9(17.3) | 1.284 | 0.257 | 6(15.4) | 3(23.1) | 0.045 | 0.832 |
WBC count (×109L-1) | 15.4(0.2,389) | 11.2 (1.3,168) | 2 598.0 | 0.648 | 13.0 (1.3,97.7) | 6.2 (2.0,168.0) | 224.0 | 0.533 |
| Risk status | 2 726.0 | 0.181 | 240.0 | 0.567 | ||||
| Favorable | 5(4.2) | 5(9.6) | 3(7.7) | 2(15.4) | ||||
| Intermediate | 60(50.4) | 24(46.2) | 18(46.2) | 6(46.2) | ||||
| Unfavorable | 35(29.4) | 12(23.1) | 8(20.5) | 4(30.8) | ||||
| Missing/unknown | 19(16.0) | 11(21.2) | 9(23.1) | 2(15.4) | ||||
| Allogeneictransplantation | 40(33.6) | 11(21.2) | 2.684 | 0.101 | 8(20.5) | 3(23.1) | 0.0 | 1.000 |
将AML患者性别、年龄、初诊时WBC、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、白蛋白、血糖、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆汁酸、总胆红素、结合胆红素、肌酐、尿素氮、左心室射血分数、CD34、CD33、CD117和CD56共20项可疑预后因素逐个进行单因素COX回归分析,结果显示:年龄、性别和CD56表达3项与患者预后有关(P <0.05),其余因素与预后无关(P>0.05)。见表 2。为减少混杂因素影响,在P=0.05水平上,将单因素分析有意义的指标进行COX多因素逐步回归分析显示:年龄和CD56表达是AML患者预后不良的独立危险因素。见表 3。
| Variable | β | SE | Wald | P </td> | Exp(95%CI) |
| Sex | -0.825 | 0.337 | 5.988 | 0.014 | 0.438(0.226,0.849) |
| Age | 0.038 | 0.011 | 11.087 | 0.001 | 1.039(1.016,1.062) |
| WBC | 0.004 | 0.003 | 2.737 | 0.098 | 1.004(0.999,1.010) |
| Hb | -0.012 | 0.007 | 2.645 | 0.104 | 0.988(0.974,1.002) |
| PLT | 0.000 | 0.001 | 0.038 | 0.846 | 1.000(0.998,1.003) |
| LDH | 0.000 | 0.000 | 0.005 | 0.946 | 1.000(1.000,1.000) |
| ALB | 0.030 | 0.033 | 0.803 | 0.370 | 1.030(0.965,1.100) |
| Glu | 0.051 | 0.087 | 0.343 | 0.558 | 1.052(0.888,1.246) |
| ALT | -0.001 | 0.008 | 0.016 | 0.900 | 0.999(0.983,1.015) |
| AST | 0.004 | 0.010 | 0.143 | 0.705 | 1.004(0.985,1.023) |
| TBA | -0.007 | 0.017 | 0.179 | 0.672 | 0.993(0.959,1.027) |
| TBIL | -0.055 | 0.038 | 2.116 | 0.146 | 0.947(0.880,1.019) |
| DBIL | 0.068 | 0.075 | 0.826 | 0.363 | 1.070(0.925,1.239) |
| Cr | -0.012 | 0.008 | 2.324 | 0.127 | 0.988(0.973,1.003) |
| BUN | 0.133 | 0.102 | 1.703 | 0.192 | 1.142(0.936,1.393) |
| LVEF | -0.004 | 0.009 | 0.183 | 0.669 | 0.996(0.979,1.014) |
| CD34 | 0.008 | 0.004 | 3.453 | 0.063 | 1.008(1.000,1.017) |
| CD33 | -0.005 | 0.007 | 0.654 | 0.419 | 0.955(0.982,1.008) |
| CD117 | -0.009 | 0.005 | 3.118 | 0.077 | 0.991(0.981,1.001) |
| CD56 | 0.011 | 0.004 | 7.482 | 0.006 | 1.011(1.003,1.020) |
| Variable | β | SE | Wald | P </td> | Exp(95%CI) |
| Age | 0.043 | 0.010 | 17.406 | 0.000 | 1.044(1.023,1.065) |
| CD56 | 0.011 | 0.003 | 10.375 | 0.001 | 1.011(1.004,1.018) |
CD56-组患者中位OS为39.4个月,CD56+组中位OS为14.2个月,2组患者中位OS比较差异有统计学意义(P <0.05)。CD56阳性表达率≥50%组患者中位OS为11.7个月,CD56阳性表达率 < 50%组患者中位OS为20.3个月,2组患者中位OS比较差异有统计学意义(P <0.05)。CD56-组患者1年、2年生存率分别为75.6%和63.9%,CD56+组患者1年、2年生存率分别为61.5%和46.2%,2组患者1年和2年生存率比较差异有统计学意义(P <0.05)。CD56阳性表达率≥50%组患者1年生存率(53.8%)低于CD56阳性表达率 < 50%组(84.6%),但差异无统计学意义(P>0.05);CD56阳性表达率≥50%组患者2年生存率(41.0%)明显低于CD56阳性表达率 < 50%组(61.5%),2组患者2年生存率比较差异有统计学意义(P <0.05)。见图 2。
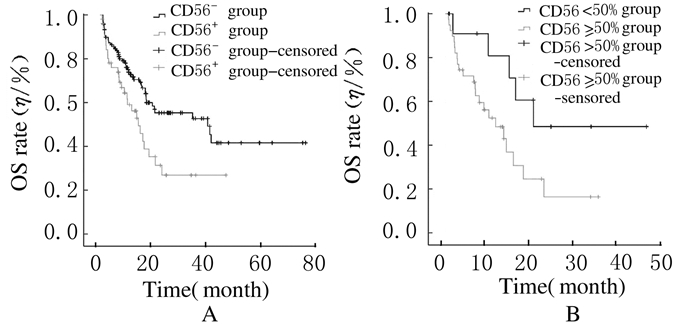
|
| A:CD56+ group and CD56- group; B: CD56≥50% group and CD56 < 50% group. 图1 AML患者中位OS示意图 Fig.1 Schematic diagrams of median OS of AMLpatients |
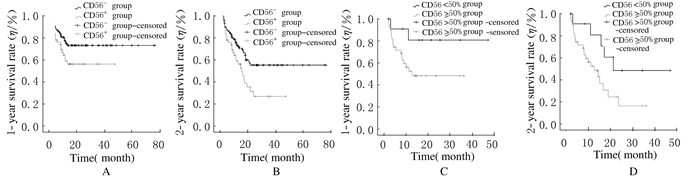
|
| A,B:CD56+ group and CD56- group; C,D: CD56≥50% groupand CD56 < 50% group;A,C: 1-year survival rate;B,D: 2-year survival rate. 图2 AML患者1年及2年生存率示意图 Fig.2 Schematic diagrams of 1-year and 2-year survival rates of AML patients |
共有115例患者达到CR,其中CD56-组82例(82/119,68.9%),CD56+组33例(33/52,63.5%),2组患者诱导治疗的CRR比较差异无统计学意义(P>0.05)。CD56阳性表达率≥50%组23例(23/39,58.9%),CD56阳性表达率 < 50%组10例(10/13,76.9%),2组患者CRR比较差异无统计学意义(P>0.05)。
2.5 CD56与复发率和中位DFS的关系总复发率可评估患者95例(20例患者失访),共40例患者复发,其中CD56-组23例(23/67,34.3%),CD56+组18例(18/28,64.3%),2组患者总复发率比较差异有统计学意义(P < 0.05)。1年内复发率可评估患者110例(5例失访),CD56-组复发患者14例(14/78,17.9%),CD56+组复发患者12例(12/32,37.5%),2组患者1年内复发率比较差异有统计学意义(P <0.05)。CD56阳性表达率≥50%组复发患者15例(15/20,75.0%),CD56阳性表达率 < 50%组复发患者3例(3/8,37.5%),2组患者总复发率比较差异无统计学意义(P>0.05)。CD56阳性表达率≥50%组1年内复发患者12例(12/28,42.9%),CD56阳性表达率 < 50%组1年内复发患者3例(2/12,16.7%),2组患者1年内复发率比较差异无统计学意义(P>0.05)。CD56-组患者中位DFS为12.7个月,CD56+组为34.1个月,2组患者中位DFS比较差异有统计学意义(P <0.05);CD56阳性表达率≥50%组与CD56阳性表达率 < 50%组中位DFS比较差异有统计学意义(P <0.05)。见图 3。

|
| A:CD56+ group and CD56- group;B: CD56≥50% group and CD56 < 50% group. 图3 AML患者中位DFS示意图 Fig.3 Schematic diagrams of median DFS of AMLpatients |
CD56分子属超免疫球蛋白家族的成员,是神经细胞黏附分子的异构体和自然杀伤淋巴细胞(NK)的标志[6, 7]。由于其介导细胞和细胞之间的相互作用,故可能调节细胞归巢从而导致急性髓系白血病细胞的扩散[8]。虽已有多项研究[6, 9]表明表达CD56的AML患者预后不良,但亦有部分研究[8, 10]表明在不同亚型AML患者CD56对AML预后的预测意义不同。故纳入具有一致特征的患者对判断CD56对预后的预测作用更具有可靠性和科学性。AML患者初诊时的年龄、白细胞计数、继发性AML、FAB分型、细胞遗传学和分子学改变等因素均与其预后相关[4]。本研究纳入研究对象年龄为14~60岁,排除高年龄对预后的影响,且2组患者年龄比较无差异,WBC计数比较无差异,据细胞遗传学和分子遗传学改变所判断的危险度分级比较无差异,无继发性AML,且诱导方案一致。故本研究所纳入的研究对象具有高度一致性,结果更为可靠。
本研究共纳入患者171例,CD56+患者为52例,占总数的30.4%,这与大多数研究[11]一致。本研究中CD56+患者主要分布在M2和M5型中,这与Raspadori等[6]研究结果一致,但Alegretti等[11]的研究中CD56+患者在M4和M5中分布最多,考虑可能与患者年龄和治疗方案有关。本研究中以CD56表达百分比在20%以上为阳性,这与国内外多项研究一致。
本研究中COX回归分析表明:CD56和年龄是AML患者的独立预后因素,这与Djunic等[12]研究结果一致。双变量相关分析表明:患者CD56阳性表达率与OS存在负相关关系,因此考虑AML患者CD56阳性表达率越高,预后越差。由于本研究CD56+患者在不同表达百分率的例数限制,本研究将CD56+患者分为CD56阳性表达率≥50%组和CD56阳性表达率 < 50%组,并比较2组之间的预后指标,进而验证CD56阳性率与预后的关系。
本研究中CD56+组的中位OS明显短于CD56-组,这与已有研究[6, 11, 13, 14]结果一致。本研究CD56+组中位DFS为12.7个月,明显短于CD56-组的34.1个月。Djunic等[12]用多变量COX回归分析的方法发现:相较于年龄大于55岁、白细胞增多症、不良核型、ECOG评分≥2等因素,CD56抗原的表达与患者OS最相关,且亦能影响患者DFS。然而Iriyama等[8]指出:具有t(8;21)突变的的AML患者,CD56的表达对OS并无影响,这可能与研究患者限定在t(8;21)有关,并且化疗缓解后骨髓移植患者比例也可能产生影响。Chang等[13]指出:在初诊AML患者中,CD56对OS有明显影响,但是对DFS无影响,这与本研究结果不同,Chang等[13]的研究中位年龄为58岁,且化疗方案不同,而本研究中的中位年龄为42岁,首次化疗方案均为IA方案,故本研究结果更加特异,白血病细胞表达CD56对OS和DFS均有明显影响。CD56阳性表达率≥50%组的中位OS、中位DFS及2年生存率与CD56阳性表达率 < 50%组比较差异具有统计学意义,这与CD56+组和CD56-组间的差异类似,以上为临床医生治疗CD56+患者提供重要的指导意义。但CD56阳性表达率≥50%组与CD56阳性表达率 < 50%组1年生存率比较差异无统计学意义,这可能与CD56低表达患者数量偏少有关。
本研究中CD56+组与CD56-组患者CRR比较差异无统计学意义,与Jekarl等[15]和Raspadori等[6]的研究结果不一致。Jekarl等[15]研究显示:CD56+的AML患者缓解率极低,仅8.3%,其纳入患者为AMLt(16;21)(p11;q22),无年龄限制,且研究例数较少,诱导方案为BHAC方案,本研究皆为IA方案。Raspadori等[6]研究表明:CD56+患者的CRR明显低于CD56-组,但其研究对象为70岁以下患者,且诱导方案为DA方案,故本研究CRR不同可能与这些因素有关。CD56阳性表达率≥50%组和CD56阳性表达率 < 50%组间的CRR无差异,提示CD56表达的高低可能对60岁以下CD56+AML患者诱导治疗后的CRR无影响。研究[16]发现:IDA可耐受ABC蛋白介导的药物外排作用,故过表达ABC蛋白的AML患者对IDA敏感,而对柔红霉素和米托蒽醌耐药,且相对于其他蒽环类抗生素,其能清除较多的微小残留病灶。因而本研究采用IDA方案可能是导致CD56对组间CRR无差异的原因。本研究中CD56+组总复发率和1年复发率分别为64.3%和37.5%,均明显高于CD56-组(34.3%、17.9%),这与Iriyama等[8]结果一致。Iriyama等[8]研究发现:CD56+AML患者具有比CD56-患者更高的复发风险,并且同样适用于急性早幼粒细胞白血病,Montesinos等[17]指出:CD56+的急性早幼粒细胞白血病患者5年复发率为22%,明显高于CD56-组的10%。CD56阳性表达率≥50%组与CD56阳性表达率 < 50%组比较,两者总复发率与1年复发率差异均无统计学意义。以上研究提示:CD56表达对60岁以下AML患者的复发率有影响,但是CD56表达高低可能不影响CD56+患者复发率,由于本研究阳性病例数较少,需进一步验证。
综上所述,初诊AML患者白血病细胞表达CD56抗原提示预后不良,并且CD56抗原表达率越高,患者的预后更差,因此在临床上应尽可能对初诊AML患者行流式细胞术检测白血病细胞CD56抗原的表达,并将表达阳性率的高低与已知预后因素相结合全面评估患者预后,调整治疗方案,最大限度地提高疗效。
| [1] | Dores GM,Devesa SS,Curtis RE,et al. Acute leukemia incidence and patient survival among children and adults in the United States,2001-2007[J].Blood,2012,119(1):34-43. |
| [2] | Valgardsdottir R,Capitanio C, Texido G,et al.Direct involvement of CD56 in cytokine-induced killer-mediated lysis of CD56+ hematopoietic target cells[J].Exp Hematol,2014,42(12):1013-1021. |
| [3] | Xu S,Li X,Zhang J,et al.Prognostic value of CD56 in patients with acute myeloid leukemia:a meta-analysis[J].J Cancer Res Clin Oncol,2015,141(10):1859-1870. |
| [4] | 魏姗姗,周茂华,李劲高,等.急性髓系白血病患者白血病细胞CD34和CD38抗原的表达及其临床意义[J].吉林大学学报:医学版,2015,41(2):362-367. |
| [5] | 张之南.血液病诊断及疗效标准[M].2版.北京:科学出版社,1998:168-218. |
| [6] | Raspadori D,Damiani D, Lenoci M,et al.CD56 antigenic expression in acute myeloid leukemia identifies patients with poor clinical prognosis[J].Leukemia,2001,15(8):1161-1164. |
| [7] | Junca J,Garcia-Caro M,Granada I,et al.Correlation of CD11b and CD56 expression in adult acute myeloid leukemia with cytogenetic risk groups and prognosis[J].Ann Hematol,2014,93(9):1483-1489. |
| [8] | Iriyama N,Hatta Y,Takeuchi J,et al.CD56 expression is an independent prognostic factor for relapse in acute myeloid leukemia with t(8;21)[J].Leuk Res,2013,37(9):1021-1026. |
| [9] | Ono T,Takeshita A,Kishimoto Y,et al.Expression of CD56 is an unfavorable prognostic factor for acute promyelocytic leukemia with higher initial white blood cell counts[J].Cancer Sci,2014,105(1):97-104. |
| [10] | Mason KD,Juneja SK,Szer J.The immunophenotype of acute myeloid leukemia:is there a relationship with prognosis[J].Blood Rev,2006,20(2):71-82. |
| [11] | Alegretti AP,Bittar CM,Bittencourt R,et al.The expression of CD56 antigen is associated with poor prognosis in patients with acute myeloid leukemia[J].Rev Bras Hematol Hemoter,2011,33(3):202-206. |
| [12] | Djunic I, Virijevic M,Djurasinovic V,et al.Prognostic significance of CD56 antigen expression in patients with acute myeloid leukemia[J].Med Oncol,2012,29(3):2077-2082. |
| [13] | Chang H,Salma F,Yi QL,et al.Prognostic relevance of immunophenotyping in 379 patients with acute myeloid leukemia[J].Leuk Res,2004,28(1):43-48. |
| [14] | Chang H,Brandwein J,Yi QL,et al.Extramedullary infiltrates of AML are associated with CD56 expression,11q23 abnormalities and inferior clinical outcome[J].Leuk Res,2004,28(10):1007-1011. |
| [15] | Jekarl DW,Kim M,Lim J,et al.CD56 antigen expression and hemophagocytosis of leukemic cells in acute myeloid leukemia with t(16;21)(p11;q22)[J].Int J Hematol,2010,92(2):306-313. |
| [16] | Benderra Z,Faussat AM,Sayada L,et al.Breast cancer resistance protein and P-glycoprotein in 149 adult acute myeloid leukemias[J].Clin Cancer Res,2004,10(23):7896-7902. |
| [17] | Montesinos P,Rayón C,Vellenga E,et al.Clinical significance of CD56 expression in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline-based regimens[J].Blood,2011,117(6):1799-1805. |
 2016, Vol. 42
2016, Vol. 42


