扩展功能
文章信息
- 李娜, 何叶, 李敏超
- LI Na, HE Ye, LI Minchao
- 机械压力敏感性通道蛋白表达水平与COPD患者气道重塑的关联性分析
- Analysis on correlation between expression level of pressure-sensitive channel protein and airway remodeling in COPD patients
- 吉林大学学报(医学版), 2016, 42(02): 277-282
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 277-282
- 10.13481/j.1671-587x.20160217
-
文章历史
- 收稿日期: 2015-08-23
- 网络出版时间: 2016-03-08 12: 52: 10
2. 四川省人民医院老年科, 四川成都 610000
2. Department of Geriatric, Sichuan Provincial People's Hospital, Chengdu 610072, China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种不可逆性气流受限为主的慢性气道炎症性疾病。气道重塑是导致气流受限的重要病理学改变,这也是COPD患者病情无法缓解的重要原因之一[1]。COPD急性发作时可诱发气道痉挛,加之气道重塑致中小气道长期不可逆性狭窄,管腔内压持续性升高,继而作用于气道管腔内侧结构。国外报道[2, 3, 4]显示:已发现哺乳动物细胞膜上普遍存在一种机械敏感性离子通道(mechanosensitive channel,MSC),其亚型瞬时受体电位C1(transient receptor potential canonical 1,TRPC1)通道是感知机械压力或牵张刺激的重要通道,被激活后可诱导胞内Ca2+浓度的升高。目前TRPC1通道在肺泡巨噬细胞、肺血管平滑肌细胞均有表达,且集中于基础研究,但其具体作用机制尚不明确[5]。而气道重塑的发生、进展涉及到多种细胞因子及炎症因子,如基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、转化生长因子β1(transforming growth factor-β1,TGF-β1),这些因子的基因表达及调控均涉及到Ca2+的参与[6, 7]。故本实验由此着手,旨在检测COPD患者支气管黏膜上皮内是否有TRPC1通道激活及上调性表达,探讨人体内气道黏膜上皮细胞上TRPC1通道与气道重塑评估指标的关联程度。
1 材料与方法 1.1 主要试剂与材料TRPC1、MMP-9、TGF-β1ELISA试剂盒(深圳晶美生物工程有限公司);兔抗TRPC1多克隆抗体(美国Abcam公司);兔SP试剂盒(SP9001);山羊抗兔IgG抗体(购自碧云天生物技术研究所);小鼠抗β-actin单克隆抗体、HRP标记的羊抗兔或羊抗小鼠IgG(武汉博士德生物有限公司)。
1.2 研究对象 1.2.1 一般资料选取2014年1月-2015年1月重庆医科大学附属第二医院呼吸内科门诊及住院部收治的64例欲行纤维支气管镜检查的患者为研究对象,作为非手术组。入选标准:胸部CT或者X片发现原因未明的肺不张、肺部占位性病变;原因未明的咯血。排除标准:并发神经系统疾病,如肌萎缩侧索硬化症、小脑性共济失调、肌营养不良症、重症肌无力和神经胶瘤等;并发COPD以外的其他慢性气道疾病;并发有无法耐受纤维支气管镜检查的疾病。根据中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的COPD诊断标准分为COPD组(轻至中度)和对照组(无其他慢性气道炎症性疾病)。COPD组共40例,其中男性22例,女性18例,平均年龄(54.6±1.3)岁,吸烟患者30例,吸烟量为(42.10±10.34)包/年;对照组24例,其中男性18例,女性6例,平均年龄(52.10±1.00)岁,吸烟患者8例,吸烟量为(45.01±8.41)包/年。COPD组和对照组患者的年龄、性别、吸烟者所占比例及吸烟量差异均无统计学意义(P>0.05)。所有研究经本院伦理委员会批准,所有患者均签署知情同意书。
1.2.2 肺功能测定待行纤维支气管镜检查前分别检测患者的第1秒用力呼气容积/用力肺活量(FEV1/FVC)及其实测值占预计值百分比(FEV1%pred),结果以百分比表示。
1.2.3 肺泡灌洗液(bronchoalveolar liquid,BALF)的收集纤维支气管镜前段插入患肺中叶或舌叶的叶支气管开口处,将100~150mL 37℃、0.9%生理盐水注入,负压回吸收量大于40%为回收成功[8],4℃、 1000 r·min-1离心10min,取上清液,于-70℃保存,用于测定各种因子水平。
1.2.4 ELISA法测定BALF中TRPC1、MMP-9和TGF-β1水平取BALF上清液,按试剂盒说明测定书TRPC1、MMP-9和TGF-β1的表达水平[9],表达水平以ng·L-1表示。
1.3 手术组织标本的收集和检测 1.3.1 手术组组织病理标本的收集收集2015年1—10月因周围型肺癌在重庆医科大学附属第二医院胸外科行肺叶切除术患者的肺组织标本17例,取材部位同参考文献[10],作为手术组。入选标准:术前均未经放疗、化疗,均至少3个月未曾使用氨茶碱、β受体激动剂、激素及抗胆碱能受体药物。根据中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的COPD诊断标准分为COPD(轻至中度)组和对照组(无其他慢性气道炎症性疾病)。COPD组8例,其中男性6例,女性2例,平均年龄(58.1±6.11)岁,吸烟患者5例,吸烟量为(44.80±10.54)包/年;对照组9例,其中男性7例,女性2例,平均年龄(61.10±8.31)岁,吸烟患者5例,吸烟量为(46.00±9.41)包/年。COPD和对照组患者的年龄、性别、吸烟者所占比例及吸烟量差异均无统计学意义(P>0.05)。所有研究经本院伦理委员会批准,所有患者均签署知情同意书。标本收集方法同参考文献[10]。
1.3.2 高分辨CT下测定气道重塑指标选择支气管外径大小1~5mm为对象,测量支气管管壁内径(L)、支气管的外径(D)。计算壁厚[WT=(D-L)/2]、壁厚与外径比率[TDR%=2WT/D)],气道管腔面积[A0=π(L/2)2]、气道总面积[A1=π(D/2)2]、气道壁总面积[WA=A1-A0]和气道壁面积占总横截面积比[WA%=WA/A1]。
1.3.3 免疫组织化学半定量法检测手术组支气管上皮细胞中TRPC1表达水平按常规步骤制蜡块、切片、脱蜡水化,步骤同参考文献[8](兔抗TRPC1多克隆抗体浓度为1∶300,阴性对照则加入非免疫源性正常兔IgG),用Imagepro-plus 6.0软件进行图像分析,累积光密度(integrated optical density,IOD)/选择测量面积(area)值作为统计数据,每张切片在高倍镜下(×400)选择5个视野,取其平均值作为支气管上皮细胞中TRPC1的表达水平。
1.3.4 Western blotting法检测手术组患者支气管上皮细胞中TRPC1表达水平取支气管上皮组织行TRPC1蛋白检测,方法步骤参考文献[10](兔抗TRPC1多克隆抗体浓度为1∶300,HRP标记的羊抗兔或羊抗小鼠IgG浓度稀释为1∶2000),以TRPC1与β-actin相对强度值表示TRPC1蛋白相对表达水平。
1.4 统计学分析采用SPSS 17.0统计软件包进行分析。手术组COPD患者支气管上皮细胞中TRPC1表达水平为方差齐性资料,组间比较采用单因素方差分析,两两比较采用LSD-t检验。手术组COPD患者TDR%和WA%、非手术组COPD患者BALF中TRPC1、MMP-9和TGF-β1表达水平以及FEV1/FVC和FEV1%pred均为方差不齐资料,组间比较采用Kruskal-Wallis H检验,两两比较采用Wilcoxon秩和检验并校正检验水准。上述指标检测结果均以x± s 表示。各指标水平与TRPC1表达水平采用偏相关分析。以P<0.05为差异有统计学意义。
2 结果 2.1 非手术组患者肺功能与对照组FEV1%pred和FEV1/FVC(87.28%±9.72%,84.20%±1.23%)比较,COPD组FEV1%pred和FEV1/FVC(68.12%±7.14%,61.42%±4.25%)明显降低,差异有统计学意义(P<0.05)。
2.2 非手术组患者BALF中相关因子表达水平对照组患者TRPC1蛋白、MMP-9和TGF-β1表达水平分别为(5.12±0.92)、(49.64±2.03)和(492.02±70.73)ng·L-1,COPD组患者TRPC1蛋白、MMP-9和TGF-β1表达水平则明显升高[(24.31±1.41)、(76.24±4.21)和(50.01±62.42)ng·L-1],差异有统计学意义(P<0.05)。
2.3 非手术组BALF中TRPC1表达水平与肺功能的相关性偏相关分析:TRPC1表达水平与FEV1%pred呈负相关关系(r=-0.34,P=0.002),回归分析得出回归方程为FEV1%pred=-0.90TRPC1+43.90;TRPC1与FEV1/FVC呈负相关关系(r=-0.38,P=0.004),回归分析得出回归方程为FEV1/FVC=-1.19TRPC1+90.28。
2.4 非手术组BALF中TRPC1表达水平与MMP-9和TGF-β1的相关性偏相关分析:TRPC1表达水平与MMP-9和TGF-β1水平均呈正相关关系(r=0.36,P=0.004;r=0.61,P=0.002)。回归方程分别为MMP-9=1.12TRPC1+49.07和TGF-β1=10.17TRPC1+245.12。
2.5 手术组支气管上皮细胞中TRPC1蛋白的表达水平免疫组织化学法检测:COPD组患者支气管上皮细胞中TRPC1蛋白分布于支气管黏膜上皮管腔侧,广泛分布于柱状细胞或杯状细胞胞浆,部分表达于上皮下平滑肌细胞或肺泡上皮细胞胞浆内(图 1A,见插页四)。对照组无明显阳性表达(图 1B,见插页四)。Imagepro-plus 6.0软件行图像分析,黄色区域作为感兴趣的测量区域(area of interesting,AOI),COPD组支气管上皮细胞IOD/area值(0.350±0.009)明显高于对照组(0.010±0.002)(P<0.05)。
2.6 手术组患者支气管上皮细胞中TRPC1蛋白的表达Western blotting法检测结果:COPD组患者支气管上皮细胞中TRPC1蛋白相对表达水平(5.14±0.17)明显高于对照组(0.22±0.01),差异有统计学意义(P<0.05)。见图 2。
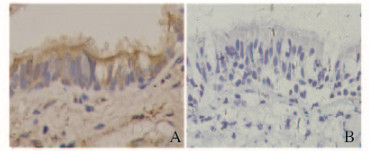
|
| A:copd group;B: Control group. 图1 免疫组织化学法检测手术组患者支气管上皮细胞中TRPC1蛋白表达(×400) Fig.1 Expression of TRPC1 protein bronchial epithelium cells of patients in operation group detected by immunohistochemistry(×400) |
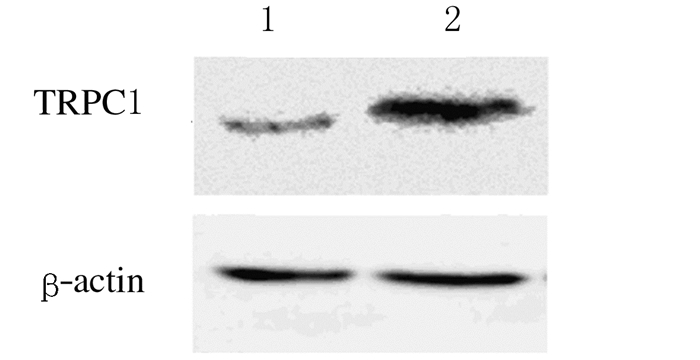
|
| Lane 1:Control group;Lane 2:COPD group. 图2 Western blotting法检测手术组患者支气管上皮细胞中TRPC1蛋白表达电泳图 Fig.2 Electrophoregram of expression levels of TRPC protein in bronchial epithelium cells of patients detected by Western blotting method |
COPD组TDR%(33.35±5.81)和WA%(63.31±8.17)较对照组(14.12±2.05,26.62±2.01)明显升高(P<0.05)。
2.8 手术组COPD患者TRPC1蛋白水平与气道重塑指标的相关性偏相关分析:手术COPD患者支气管上皮细胞中TRPC1表达水平与TDR%和WA%呈正相关关系(r=0.59,P=0.002;r=0.60,P=0.002),回归方程为TDR%=6.24TRPC1+1.19,WA%=7.76TRPC1+23.42。
3 讨论TRPC1是一类可被机械压力激活的跨膜通道蛋白,其一系列活动及表达均可导致胞内第2信使—— Ca2+浓度变化,影响细胞增殖及表型变化,与支气管黏膜上皮结构的再生再塑关系密切[11, 12]。本实验免疫组织化学结果表明:COPD患者气道上皮内有高水平表达的TRPC1蛋白,且高于对照组;Western blotting法亦证明了COPD患者气道上皮内有高水平表达的TRPC1蛋白;ELISA法提示COPD患者气道内TRPC1分泌表达水平高于对照组。且高分辨CT检测显示:COPD患者的气道壁厚度指标,如TDR%和WA%等高于对照组,且与TRPC1蛋白表达水平呈正相关关系。故由此推测TRPC1蛋白与COPD患者气道重塑的病理生理过程密切相关。
肺功能是评估气流受限的方法,是评估COPD患者气道狭窄程度的重要方法。通过FEV1衡量气流受限的程度,可进一步评估气道壁增厚的程度[13],因此本实验采用了FEV1/FVC,FEV1%pred作为判断气道重塑的客观指标。本实验结果显示:与对照组比较,COPD组FEV1/FVC和FEV1%pred均显著降低;上述2个指标与TRPC1蛋白表达水平呈负相关关系,提示COPD患者小气道内压力持续、病理性升高,激活了胞膜及胞内TRPC1通道,通过某些信号机制引导小气道结构的不可逆性重建,肺功能进行性的下降。
机械应力相关的TRPC1通道的一系列活动及表达均可导致胞内第2信使——Ca2+浓度改变,介导一系列炎症因子(MMPs、TGF等)的上调性表达[6, 7]。MMP-9即Ⅳ型胶原纤维,是由炎性细胞(如中性粒细胞、嗜酸性粒细胞和巨噬细胞)分泌的细胞因子,可炎症性损害、重建气道壁结构,故可作为判断气道重塑的非创伤性参考指标[14]。本实验结果显示:对照组BALF中MMP-9低水平表达,而COPD组MMP-9表达水平高于对照组;相关性分析提示MMP-9与TRPC1表达水平呈正相关关系。上述结果提示TRPC1通道与MMP-9的高表达有着密切关系,由此推断TRPC1通道被激活后诱导Ca2+入胞内,MMP-9表达水平升高,最终导致细胞基质降解及再生。TGF-β1是公认的致气道重塑的炎症介质[15]。机械牵张可诱导TGF-β1上调性表达,且涉及到细胞周期依赖性Ca2+可在基因水平上调控TGF-β1家族通道受体及配体的表达[12]。本实验结果表明:COPD组BALF中TGF-β1表达水平高于对照组,相关分析显示TRPC1蛋白表达水平与TGF-β1表达水平呈正相关关系,由此推断,激活的TRPC1通道开放,胞内Ca2+升高,在基因水平调控TGF-β1表达,出现平滑肌增殖/肥大等。
综上所述,COPD患者肺功能进行性下降、上皮内MMP-9及TGF-β1表达水平上调极可能与气道上皮内高水平表达的TRPC1蛋白相关,因此推测COPD患者气道内高压力可激活管腔侧TRPC1通道,进而上调气道重塑相关因子而参与其中。本研究结果提示干预感知气道压力的TRPC1环节很可能是防止COPD发生、发展的关键途径。
| [1] | Fabbri LM,Hurd SS.GOLD Scientific Committee.From the Global Strategy for the Diagnosis,Management and Prevention of COPD,Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2013[J].Eur Respir J,2003,22(1):1-2. |
| [2] | Reed A,Kohl P,Peyronnet R.Molecular candidates for cardiac stretch-activated ion channels[J].Glob Cardiol Sci Pract,2014(2):9-25. |
| [3] | Liu C,Montell C.Forcing open TRP channels:Mechanical gating as a unifying activation mechanism[J].Biochem Biophys Res Commun,2015,460(1):22-25. |
| [4] | Rohacs T.Regulation of transient receptor potential channels by the phospholipase C pathway[J].Adv Biol Regul,2013,53(3):341-355. |
| [5] | Sun CK,Zhen YY,LuHI,et al.Reducing TRPC1 expression through liposome-mediated siRNA delivery markedly attenuates hypoxia-induced pulmonary arterial hypertension in a murine model[J].Stem Cells Int,2014,316214. |
| [6] | Fischer KD,Agrawal DK.Vitamin D regulating TGF-β induced epithelial-mesenchymal transition[J].Respir Res,2014,15:146. |
| [7] | Suki B,Sato S,Parameswaran H.Emphysema and mechanical stress-induced lung remodeling[J].Physiology,2013,28(6):404-413. |
| [8] | 李敏超,张婷,周向东.肺癌患者肺泡巨噬细胞和外周血单个核细胞IL-10、IL-12测定的临床意义[J].重庆医科大学学报,2010,35(3):361-363. |
| [9] | 安英,路倩,徐丛飞.红景天总黄酮对大鼠心肌成纤维细胞增殖的抑制作用[J].吉林大学学报:医学版,2015,41(6):1190-1194. |
| [10] | Li M,Li Q,Yang G.Cold temperature induces mucin hypersecretion from normal human bronchial epithelial cells in vitro through a transient receptor potential melastatin 8(TRPM8)-mediated mechanism[J].J Allergy Clin Immunol,2011,128(3):627-634. |
| [11] | Rathor N,Chung HK,Wang SR.Caveolin-1 enhances rapid mucosal restitution by activating TRPC1-mediated Ca2+ signaling[J].Physiol Rep,2014,2(11):e12193. |
| [12] | Cheng KT,Ong HL,Liu X.Contribution and regulation of TRPC channels in store-operated Ca2+ entry[J].Curr Top Membr,2013,71:149-179. |
| [13] | Dournes G,Laurent F,Coste F.Computed tomographic measurement of airway remodeling and emphysema in advanced chronic obstructive pulmonary disease.Correlation with pulmonary hypertension[J].Am J Respir Crit Care Med,2015,191(1):63-70. |
| [14] | Lian Y,Zhang N,Liu T.Different intranasal corticosteroids effects on nasal airway remodeling of allergic rhinitis murine and matrix metalloproteinase-9[J].Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2015,29(5):452-456. |
| [15] | Yang YC,Zhang N,van Crombruggen K,et al.Transforming growth factor-beta1 in inflammatory airway disease:a key for understanding inflammation and remodeling[J].Allergy,2012,67(10):1193-1202. |
 2016, Vol. 42
2016, Vol. 42


