扩展功能
文章信息
- 马强, 谢淑丽, 王广义, 邢光远, 杨耀群, 吕国悦
- MA Qiang, XIE Shuli, WANG Guangyi, XING Guangyuan, YANG Yaoqun, LYU Guoyue
- 慢病毒介导靶向P27RF-Rho基因沉默对肝癌细胞侵袭性的影响
- Influence of lentiviral-mediated P27RF-Rho gene silence in invasion of liver cancer cells
- 吉林大学学报(医学版), 2016, 42(02): 260-265
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 260-265
- 10.13481/j.1671-587x.20160214
-
文章历史
- 收稿日期: 2015-05-14
我国是世界上肝癌发病率最高的国家,平均每年死于肝癌的患者约11万人,占全世界肝癌死亡人数的45%,其中90%为肝细胞癌(hepatocellular carcinoma cells,HCC)。肝癌的发生是一个多基因参与、多步骤和多阶段进展的过程 [1, 2],早期无明显临床表现,出现临床症状时多已处于癌症晚期,以侵袭性强、易转移为主要特点。目前关于肝癌的发病及转移复发的具体机制尚未明确,因此找出与其转移、扩散有关的因子对于肝癌的预防及治疗具有切实的临床意义。研究 [3, 4]表明:Rho蛋白在肿瘤的发生与发展过程中起重要作用,能够调控细胞黏附结构和细胞运动行为,进而调控细胞迁移、肿瘤转移等,其家族成员RhoA和RhoC在多种肿瘤细胞中呈高表达,与肝癌的远端转移及复发有密不可分的关系。P27RF-Rho是近年来新发现的能够调控Rho蛋白活性的重要因子,目前对于该因子的研究尚处于初级阶段。本实验采用RNA干扰技术通过慢病毒介导靶向抑制肝癌细胞中P27RF-Rho的表达,观察其对肝癌细胞BEL7402侵袭和迁移能力的影响,进而明确P27RF-Rho表达高低与肝癌恶性进展的生物学行为关系。
1 材料与方法 1.1 细胞、主要试剂和仪器人肝癌细胞株BEL7402和293T细胞由吉林大学第一医院肝胆外科实验室保存。U6-shRNA-CMV-copGFP-PGK-Puro-P27RF-Rho基因沉默病毒真核表达载体U6-shRNA-CMV-copGFP-PGK-Puro-Scramble及基因沉默病毒真核表达阴性对照载体由本实验室自行构建。E.coli DH5a感受态细胞购自美国Invetrogen公司。限制性内切酶、DNA连接酶(thermo)、DNA回收试剂盒及质粒提取试剂盒购自中国美基生物公司,Western blotting法所用抗体购自美国Santa Cruz公司。CO2恒温孵箱购自日本Sanyo公司,Transwell小室购自美国Sigma公司。
1.2 RNAi慢病毒载体的构建和提取shRNA引物退火形成具有黏性末端的双链片段:所用shRNA序列见表 1。反应体系:shRNA-F 2μL、shRNA-R 2μL、10×退火缓冲液2μL、ddH2O 14μL。反应条件:95℃、5min ,72℃、10min,室温 1 h。
| Gene | Primer sequence |
| P27RF-Rho-shRNA | 5'-GGAGCTGGTTGTACAGTTTTCAAGAGAAACTGTACAACCAGCTCCTTTTT-3' 5'-AAAAAGGAGCTGGTTGTACAGTTTCTCTTGAAAACTGTACAACCAGCTCCGTAC-3' |
| Scramble- shRNA | 5'-GTTGCATACGTGCGGTGATATTCAAGAGATATCACCGCACGTATGCAACTTTTT-3' 5'-AAAAAGTTGCATACGTGCGGTGATATCTCTTGAATATCACCGCACGTATGCAACGTAC-3' |
制备表达载体:10× buffer 6 μL、慢病毒干扰载体10 μL、K.pnI 1μL、H.paI 1μL、ddH2O 42μL,37℃作用3 h。干扰片段连接入表达载体:退火产物3μL、载体片段3μL、T4连接酶1μL、10× T4 Buffer 2μL、ddH2O 11μL,16℃过夜,构建出U6-shRNA-CMV-copGFP-PGK-Puro载体。转化感受态细胞:取出100μLE.coli DH5a感受态细胞,冰上解冻,取10μL重组产物加到感受态细胞中混匀,静置30 min,42℃水浴1 min,冰上静置2 min。加SOC溶液500μL,摇床混匀1 h,37℃培养过夜。挑取菌落提取质粒测序,测序引物LKO5: 5'-GACTATCATATGCTTACCGT-3'。提取质粒:将菌液培养基移至1.5 mL EP管中12 000 r·min-1 离心1 min,弃上清,重复操作数次,加250 μL Buffer S1制成细菌悬液,加250 mL Buffer S2上下翻转4~6次混匀,使菌体彻底裂解。加350 μL Buffer S3上下翻转,12 000 r·min-1离心10min。取上清液移至制备管中,12 000 r·min-1离心1 min,弃滤液。加500 μL Buffer W1 12 000 r·min-1离心1 min,弃滤液。加500 μL Buffer W2 12 000 r·min-1离心1 min,弃滤液。将制备管放入1.5 mL离心管12 000 r·min-1离心1 min。取制备管移入新的1.5 mL离心管中,加50 μL Eluent,室温1 min ,12 000 r·min-1离心1 min。
1.3 慢病毒包装载体质粒DNA与psPAX和pMD2G质粒共转染293T细胞进行病毒包装:转染前,用胰酶消化对数生长期的293T细胞,以20mL含1.2 ×107个细胞的密度接种于无菌15 cm细胞培养皿中,37℃、5% CO2培养箱内培养。待细胞密度达70%~80%时进行转染。500 μL 无血清培养液稀释2 μg 表达质粒+1.5 μg psPAX2+
1.5 μg pMD2G;500 μL 无血清培养液稀释15 μL 脂质体;5 min后,将DNA溶液和脂质体溶液混合,室温静置20 min。从6孔板中吸出1 mL无血清培养液,滴加入1 mL质粒和脂质体混合物。6~10 h后,移除含有DNA-脂质体复合物的培养基,换之以正常培养液DMED+10%FBS。转染24 h后,荧光显微镜下观察,转染效率达80%以上 。转染48和72 h后分别收获含病毒的上清。
1.4 BEL7402细胞分组和慢病毒感染将BEL7402细胞分为P27RF-Rho-siRNA实验组、Scramble-siRNA阴性对照组和BEL7402空白对照组。实验所用BEL7402细胞用含10%胎牛血清、1%双抗H-DMEM培养液,37℃、5%CO2的孵育箱培养。取对数生长期的BEL7402细胞以每孔1.2×106个细胞接种于6孔板中,待细胞平铺6孔板底面积80%~90%时,按实验设计向P27RF-Rho-siRNA实验组细胞中加入P27RF-Rho-siRNA慢病毒,Scramble-siRNA阴性对照组细胞中加入等量的Scramble-siRNA慢病毒,BEL7402空白对照组不作处理,待细胞感染36~48h后行后续实验。
1.5 Western blotting法检测P27RF-Rho基因沉默效果和肝癌相关蛋白表达水平收集6孔板中细胞,加入RIPA裂解液及蛋白酶抑制剂PMSF,冰上孵育30 min,期间不断吹打,使细胞裂解彻底。4℃、12000 r·min-1离心30 min,将上清移至新的1.5mLEP管中,蛋白曲线法测定蛋白浓度,并分装。取30 μg蛋白质样品,与5倍稀释的溴酚蓝上样缓冲液4∶1混合,沸水浴煮5 min,行12%SDS-PAGE电泳。电泳完毕后,PAGE胶上的目的蛋白用Bio-Rad微型电转移系统电转移至PVDF膜上,条件为15V、17 min。取出PVDF膜用20 mL封闭液(含5%脱脂奶粉的TBST溶液)室温孵育20 min,弃去封闭液,加一抗(1∶1000稀释)4℃孵育过夜,取出过夜PVDF膜,10 mLTBST震荡洗膜3次,每次5 min,加二抗室温孵育2 h,TBST洗膜,方法同上。PVDF膜稍干后,将化学发光试剂ECL均匀涂抹于PVDF膜上表面,作用约1 min后迅速置于暗箱内曝光,曝光时间为1 min,显影后拍照记录,以β-actin为内参照,采用图像分析软件Imagine J进行图像量化,设β-actin内参照灰度值为1,灰度值越大表示相应蛋白表达水平越高。
1.6 明胶酶谱分析侵袭相关基质金属蛋白酶(matrix metalloproteinase,MMPs)活性弃去6孔板中各组细胞原培养液,更换无血清培养液继续培养24~36 h,收集上清液,以每孔10 μL上清上样,条件为浓缩胶 80V、30 min和分离胶120V、1.5h,待溴酚蓝距离终点约1 cm时终止电泳,取出凝胶弃去上层浓缩胶,保留下层分离胶,将分离胶置于洗脱液中震荡洗脱90 min,中间换液1次;漂洗液震荡漂洗40 min,中间换液1次;置分离胶于孵育液中密闭37℃孵育42~48 h,取出孵育好的分离胶,考马斯亮兰染色3h;脱色液A、B、C按浓度梯度3∶2∶1分别脱色30 min、1h和2h,比较各组细胞MMPs活性强弱,采用同上图像分析软件Imagine J进行图像量化,设β-actin内参照灰度值为1,灰度值越大表示相应蛋白表达水平越高。
1.7 划痕实验检测细胞迁移能力胰酶消化各实验组细胞,用含10%胎牛血清、1%双抗的H-DMEM细胞培养液制成细胞悬液,细胞计数,于96孔板中按每孔4×104个细胞加入上述细胞悬液,待细胞生长铺满96孔板底表面时,用10 μL移液枪头在孔板底部按从上到下划"一"字形划痕。分别于划痕后0和24h观察不同实验组划痕区细胞的迁移情况,并进行比对、测量细胞划痕宽度,测量各组划痕不同区域,计算平均值,数值越小表示细胞生长迁移能力越强。
1.8 体外Transwell小室侵袭实验检测细胞侵袭能力铺胶:Matrigel胶按1∶1稀释,在每个Transwell小室的多聚碳酸脂膜上表面涂布30 μL,制成人工基底膜,室温风干15~20min。将上述6孔板中3组细胞用胰酶处理,制成细胞悬液,离心,弃上清,加1 mL无血清培养液制备细胞悬液。取上述细胞悬液,以每孔2.0×105个细胞接种到上室中,下室加入500 μL含10%胎牛血清、1%双抗的H-DMEM细胞培养液,37℃、5%CO2条件下培养24h。用棉签擦去上室未穿膜细胞及胶,无菌PBS冲洗2~3次,4%多聚甲醛固定10 min,0.1%龙胆紫染色30 min,蒸馏水冲洗小室下表面2~3次,风干,显微镜下选取视野内不同区域观察计数,每毫升细胞数=四大格细胞总数/4×104,计算平均值,并拍照,平均数值越大表明侵袭能力越强。
1.9 统计学分析应用SPSS13.0统计分析软件进行统计分析。各组BEL7402细胞中P27RF-Rho、RhoC、RhoA、P53、PTEN、VEGF和MMPs相对表达水平以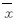 ±s表示,组间样本均数比较采用t检验。检验水准α=0.05。
±s表示,组间样本均数比较采用t检验。检验水准α=0.05。
Western blotting结果显示:P27RF-Rho-siRNA实验组BEL7402细胞中P27RF-Rho蛋白表达水平(0.20+0.10)较2个对照组(0.89+0.21,0.88+0.17)明显降低(P<0.05),阴性对照组与空白对照组细胞中P27RF-Rho蛋白表达水平比较差异无统计学意义(P>0.05);P27RF-Rho-siRNA实验组BEL7402细胞中P53和PTEN蛋白表达水平高于2个对照组(P<0.05),而RhoC、VEGF和RhoA蛋白表达水平均低于2个对照组(P<0.05)。见图 1。
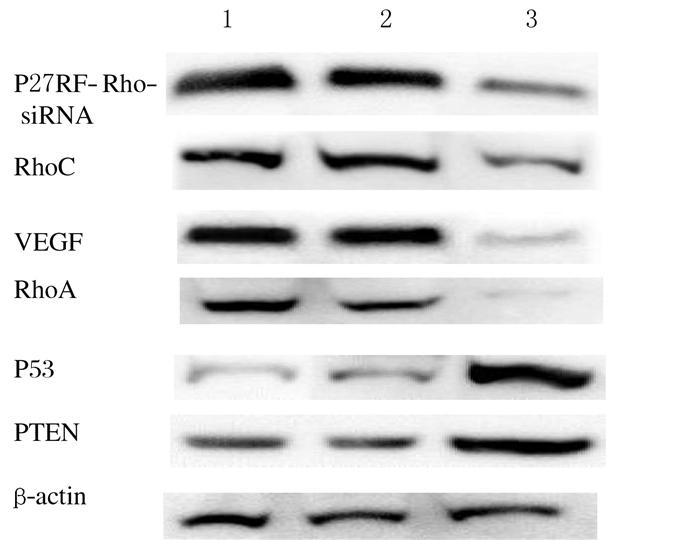
|
| Lane 1: BEL7402 group;Lane 2: Scramble-siRNA group; Lane 3: P27RF-Rho-siRNA group. 图1 各组BEL7402细胞中肝癌相关蛋白表达水平 Fig.1 Expression levels of HCC associated proteins in BEL7402 cells in vairous groups |
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中的明胶被空白对照组及阴性对照组上清液中的MMPs所分解,出现白色负染条带,而实验组细胞的上清液中只检测出微弱的酶活性,说明P27RF-Rho基因被靶向抑制后,BEL7402细胞中MMPs活性明显降低,即MMPs活性受到明显抑制(P<0.01)。见图 2。

|
| Lane 1: BEL7402 group;Lane 2: Scramble-siRNA group;Lane 3: P27RF-Rho-siRNA group. 图2 各组BEL7402细胞中MMPs活性 Fig.2 Activities of MMPs in BEL7402 cells in various groups |
分别在0和24h观察3组细胞的迁移距离,实验组细胞的迁移距离受到明显抑制,2个对照组细胞迁移能力无明显差异(P>0.05);24h后实验组细胞的迁移距离明显小于其他2个对照组,差异有统计学意义(P<0.01)。见图 3(插页四)。

|
| A-C: 0 hjD-F: 24 h5A,D: BEL7402 group; B,E: Scramble-siRNA group; C,F: P27RF-Rho-siRNA group. 图3 各组BEL7402细胞划痕实验结果 Fig.3 Results of sarification of BEL7402 cells in various groups |
同样时间内,实验组BEL7402细胞穿过人工基底膜的细胞数量(33±7)较阴性对照组(113±6)及空白对照组(108±9)明显减少(P<0.01)。见图 4(插页四)。

|
| A: BEL7402 group; B: Scramble-siRNA group; C: P27RF-Rho-group. 图4 各组 BEL7402 细胞侵袭能力 Fig.4 Invasion abilities of BEL7402 cells in various groups |
HCC是一种早期就易发生扩散的肝脏恶性肿瘤,是最常见的肝癌类型,复发转移率超过60% [5]。侵袭行为是贯穿肿瘤侵袭转移全过程的重要步骤。因此找到与肝癌细胞侵袭、转移相关的因子具有重要的临床意义。研究 [6]表明:Rho GTPase酶是细胞内多条信号转导通路的关键蛋白,作为分子开关在细胞信号传导通路中起桥梁作用,与肝细胞癌的侵袭和迁移有密切关系,Rho GTPase家族包含3个亚家族:Rac、Cdc42和Rho。Rho家族成员RhoA、RhoC在肝细胞癌组织中呈高表达,尤其与肝癌细胞的侵袭和转移能力关系密切 [7, 8]。Rho蛋白及其下游的相关卷曲蛋白(ROCK)能够提升肌球蛋白(MLC)的磷酸化水平,增加肿瘤细胞的迁移能力,还可作用于下游另一重要效应分子——mDia蛋白,增强肿瘤细胞的迁移能力。P27RF-Rho是近年来新发现的调控肿瘤细胞内小分子鸟苷酸三磷酸酶(Rho GTPase)活性的分子,能够作用于RhoA、RhoC及其下游分子,同时是细胞周期蛋白P27kip1的相关蛋白,P27kip1能够参与细胞分化和凋亡的调控,是一种肿瘤抑制基因,P27RF-Rho作为膜蛋白的一种,主要分布在细胞表面可以调控编码细胞内蛋白激酶C [9, 10],可能参与调控肿瘤细胞的生长和凋亡,具体作用机制有待进一步研究。
RNAi干扰技术是利用碱基互补配对原理,通过内外源性双联RNA触发同源性mRNA的降解,抑制目的基因表达,具有高效性和高特异性的特点 [11]。慢病毒载体(lentiviral vectors,LV)是近年发展起来的新兴基因阻断技术,包含了包装、感染、稳定整合所需要的遗传信息,是新发展起来的基因载体,用于宿主细胞的感染。目的基因进入到宿主细胞后,LV可以将携带的目的基因整合到宿主的基因组中,进而高水平的持续表达效应分子,具有可感染分裂期和非分裂期细胞、转移基因片段容量大、目的基因表达时间长、不易诱发宿主免疫反应等优点 [12]。本实验采用慢病毒介导,将P27RF-Rho-siRNAi抑制基因整合到实验细胞基因组中,得到持续高水平表达抑制效应。本实验采用Western blotting法检测出P27RF-Rho-siRNA实验组细胞P27RF-Rho的表达在蛋白水平明显下调,说明所构建的LV发挥了明显的抑制作用。VEGF是一种强有力的血管生成细胞因子,在肿瘤血管生成中扮演至关重要的角色,与肿瘤的侵袭、血管密度、转移复发密切相关。本实验中Western blotting法结果显示:P27RF-Rho被抑制后,VEGF表达水平相应下调,说明P27RF-Rho参与调控肿瘤血管的生长及密度,其分子机制很可能是通过调节VEGF表达水平来实现的。Rho亚家族成员RhoA主要调节肌动蛋白的收缩,调节Stat3的转录活性,激活MAL/SRF转录因子复合物,促进肿瘤细胞的转移,RhoC是肝癌细胞侵袭和远端转移过程中必不可少的因子 [13],P27RF-Rho表达被抑制后,RhoA和RhoC表达水平均相应下调。众所周知,p53是一种肿瘤抑制基因,首次发现于1979年,是迄今发现与人类肿瘤相关性最高的基因,具有促进肿瘤细胞凋亡、抑制肿瘤血管生成等生物学作用,同时参与细胞内多种信号传导通路;PTEN是一种新发现的抑癌基因,于1997年首次被报道之后即成为研究热点,属于蛋白酪氨酸磷酸酶(protein tyrosine phosphatases,PTP)基因家族成员,是迄今发现的第1个具有双特异磷酸酶活性的抑癌基因,也是继p53基因后另一个较为广泛地与肿瘤发生关系密切的基因 [14]。目前认为PTEN的抑癌机制由以下几条途径共同完成:通过对FAK的去磷酸化抑制细胞转移及浸润,使PIP3去磷酸化,进而抑制细胞生长并促进细胞凋亡,抑制MAPK细胞信号传导通路进而抑制细胞生长分化。癌基因与抑癌基因之间作用失衡是肿瘤发生的重要机制之一 [15]。本实验中P27RF-Rho表达被抑制后,抑癌基因p53、PTEN表达水平均相应上调,说明P27RF-Rho可能是一种新发现的促癌因子,与抑癌基因具有一定的拮抗作用,具体作用机制有待进一步证实。侵袭相关MMPs是目前研究最广泛的金属转移酶,能降解细胞外基质及诱导基质细胞分解酶类来降解基质及基底膜,最终使肿瘤细胞得以向外侵袭和转移,MMPs的表达水平与肿瘤细胞的侵袭和转移倾向呈正相关关系 [16]。实验中明胶酶谱法表明实验组细胞产生的MMPs活性明显下降,说明P27RF-Rho的表达下调后,肝癌细胞的侵袭和转移能力受到了抑制[17]。Matrigel的成分类似于体内细胞的基底膜,为了评价P27RF-Rho是否与肝癌细胞的侵袭和转移能力有关,本实验采用Transwell体外侵袭实验及细胞划痕实验检测P27RF-Rho表达下降后,肝癌细胞侵袭及迁移行为的改变。本研究结果显示:与空白对照组和阴性对照组比较,P27RF-Rho-siRNA实验组细胞体外侵袭及迁移能力也明显受到抑制。
综上所述,肝癌细胞的侵袭和转移是促进肝癌致死的重要因素,Rho信号转导通路是肝癌侵袭和转移的重要路径。本实验通过慢病毒介导应用RNAi的方法基因沉默了P27RF-Rho的表达,检测到P27RF-Rho能够确切抑制肝癌细胞的侵袭和迁移能力,为其成为肝细胞癌转移和复发的预测指标以及治疗过程中新的潜在靶点提供了理论依据。
| [1] | Center MM,Jemal A.International trends in liver cancer incidence rates[J].Cancer Epidemiol Biomarkers Prev,2011,20(11):2362-2368. |
| [2] | Nault JC,Zucman-Rossi J.Genetics of hepatobiliary carcinogenesis[J].Semin Liver Dis,2011,31(2):173-187. |
| [3] | Pedersen E,Brakebusch C.Rho GTPase function in development:how in vivo models change our view[J].Exp Cell Res,2012,318(14):1779-1787. |
| [4] | Wilson KF,Erickson JW,Antonyak MA,et al.Rho GTPases and their roles in cancer metabolism[J].Trends Mol Med,2013,19(2):74-82. |
| [5] | Yang T,Zhang J,Lu JH,et al.A new staging system for resectable hepatocellular carcinoma:comparison with six existing staging systems in a large Chinese cohort[J].J Cancer Res Clin Oncol,2011,137(5):739-750. |
| [6] | Hanna S,El-Sibai M.Signaling networks of Rho GTPases in cell motility[J].Cell Signal,2013,25(10):1955-1961. |
| [7] | Thumkeo D,Watanabe S,Narumiya S.Physiological roles of Rho and Rho effectors in mammals[J].Eur J Cell Biol,2013,92(10/11):303-315. |
| [8] | Bravo-Cordero JJ,Sharma VP,Roh-Johnson M,et al.Spatial regulation of RhoC activity defines protrusion formation in migrating cells[J].J Cell Sci,2013,126(15):3356-3369. |
| [9] | Plaszazyca A,Nilsson J,Tayebwa J,et al.Fusions involving protein kinase C and membrane-associated proteins in benign fibrous histiocytoma[J].Int J Biochem Cell Biol,2014,8(53):475-481. |
| [10] | Nada S,Mori S,Takahashi Y.p18/LAMTOR1:a late endosome/lysosome-specific anchor protein for the mTORC1/MAPK signaling pathway[J].Methods Enzymol,2014,15(8):249-263. |
| [11] | Amberkar S,Kiani NA,Bartenschlager R,et al.High-throughput RNAinterference screens integrative analysis:Towards acomprehensive an-derstanding of the virus-host interplay[J].World J Viral,2013,2(2):18-31. |
| [12] | Segura MM,Mangion M,Gaillet B,et al.New developments in lentiviral vector design,production and purifieation[J].Expert Opin Biol Ther,2013,13(7):987-1011 |
| [13] | Malissein E,Meunier E,Lajoie-Mazenc I,et al.RhoA and RhoC differentially modulate estrogen receptor ɑ recruitment,transcriptional activities,and expression in breast cancer cells (MCF-7)[J].J Cancer Res Clin Oncol,2013,139(12):2079-2088. |
| [14] | 谢淑丽,吕国悦,郑鹏远,等.RhoC高表达诱导人正常肝细胞迁移和侵袭的研究[J].中华实验外科杂志,2014,5(31):991-994. |
| [15] | 金立鹏,王广义,谢淑丽,等.雷帕霉素联合阿霉素对肝癌细胞BEL-7402增殖及迁移的影响及其作用机制[J].吉林大学学报:医学版,2011,37(1):30-34. |
| [16] | Amalinei C,Caruntu ID,Giusca SE,et al,Matrix metalloprotei-nasesinvolvement in pathologic conditions[J].Romanian J Morphol Embryol,2010,51(2):215-228. |
| [17] | 邢光远,谢淑丽,吕国悦,等.P27RF-Rho基因沉默对肝癌Bel7402细胞增殖的影响[J].吉林大学学报:医学版,2015,41(3):542-547. |
 2016, Vol. 42
2016, Vol. 42


