扩展功能
文章信息
- 吕爽, 徐金影, 冯卫, 张泽川, 李美英, 毕波, 孙东杰, 李玉林, 池光范
- LYU Shuang, XU Jinying, FENG Wei, ZHANG Zechuan, LI Meiying, BI Bo, SUN Dongjie, LI Yulin, CHI Guangfan
- 源于人躯干皮肤真皮的成纤维样细胞的间充质干细胞分化潜能
- Potential to differentiation of human dermis-derived fibroblast-like cells into mesenchymal stem cells in vitro
- 吉林大学学报(医学版), 2016, 42(02): 245-249
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 245-249
- 10.13481/j.1671-587x.20160211
-
文章历史
- 收稿日期: 2015-09-10
2. 吉林大学第一医院骨科, 吉林长春 130021;
3. 吉林大学药学院生物组织工程系, 吉林长春 130021
2. Department of Orthopedics, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Biotissue Engineering, School of Pharmacy, Jilin University, Changchun 130021, China
真皮成纤维细胞来源于胚胎中胚层间质细胞,是人体内分布范围最广、参与组织修复最重要的一类细胞[1]。与其他中胚层来源的细胞不同,真皮成纤维细胞保留了中胚层细胞增殖能力强、体外培养不易老化及多次传代仍能保持强大增殖力的特性;同时,真皮成纤维细胞取材与培养十分简单,被视为人体内数量最大的"种子细胞库"[2]。并且,长期以来真皮中的成纤维细胞被认为是终末分化细胞,不具有干细胞的分化特点。近年来研究[3, 4]显示:皮肤真皮成纤维细胞也具有向骨、软骨和脂肪细胞分化的潜能。Chen等[5]研究发现:这些成纤维细胞中只有少部分细胞有向骨细胞、软骨细胞和脂肪细胞分化的潜能。因此,如何从这些真皮组织来源成纤维样细胞中有效纯化培养具有分化潜能的细胞,用于骨和软骨损伤再生修复,成为有待解决的问题。本研究应用含血清潜代物(N2和B27)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮细胞生长因子(epidermal growth factor,EGF)的无血清培养液,从人腹部真皮组织中分离培养的成纤维样细胞中筛选形成球状细胞聚集体的细胞,以骨髓间充质干细胞(bone marrow mesenchymalstem cells,BMSCs)为对照分析其向骨、软骨和脂肪分化的分化潜能。
1 材料与方法 1.1 组织来源经患者及家属知情同意,自吉林大学第一医院外科手术室获取45 ~ 50岁患者手术中切除的正常腹部皮肤块和骨髓(约10 mL)各3个样品。上述皮肤和骨髓均来源于不同患者。
1.2 细胞培养 1.2.1 皮肤成纤维细胞培养在超净台内,用眼科剪去除皮下脂肪组织,用含有5倍双抗生素(青霉素和链霉素,美国Genview公司)的PBS清洗2 ~ 3次,以去除残留的血液成分,然后将其剪成约3 mm × 3 mm大小的皮肤块,置于含0.48%分散酶(dispase)的DMEM/F12(美国Gibco公司)(1∶1)培养基中,4℃消化过夜。次日,用眼科镊把皮肤表皮层揭去,剩下的真皮组织用PBS漂洗2次,去除残留的表皮成分。将清洗后的真皮用手术剪刀剪成细小的组织碎块,移入50 mL离心管,加入30 mL含有1% FBS和0.1% I型胶原酶的DMEM/F12(1∶1)培养基,置于37℃孵箱内消化过夜(约10 h)。次日用含2% FBS (美国Gibco公司)的PBS终止消化。然后,依次过70和40 μm滤网,去除残余的组织块。以1500 r·min-1 转速离心5 min后,去除上清液,将细胞沉淀吹打悬浮于含有10% FBS的DMEM/F12(1∶1),以3.0 ×104 mL-1细胞密度接种于培养瓶进行培养。每隔2d更换培养液,细胞达到80% ~ 90%融合时,用0.25%胰蛋白酶/EDTA消化分离为单个细胞。分离的细胞悬浮于1% N2、2% B27、40 μg·L-1 bFGF和40 μg·L-1 EGF的DMEM/F12(1∶1)中,以0.5 × 104 mL-1细胞密度接种于75T培养瓶进行培养。培养4 ~ 5 d后更换全部培养液,此后每3d更换2/3培养液,持续培养。约10 d时收集形成的球状细胞聚集体,用含10μg·L-1 bFGF和 10% FBS的DMEM/F12(1∶1)进行单层培养。细胞达到80% ~ 90%融合时以1∶3的比例传代培养。
1.2.2 BMSCs培养以肝素为抗凝剂采集的骨髓用30 mL PBS悬浮混匀,以1500 r·min-1离心10 min。吸除上清液后,沉淀的细胞组分混匀于含10% FBS的DMEM/F12,接种在100 mm ×100 mm细胞培养平皿中培养。第3天时,换全液去除悬浮的血细胞等未贴壁细胞。其后每隔2d更换2/3培养液。细胞铺满培养皿约90%时用0.25% 胰蛋白酶-EDTA(美国Genview公司)消化细胞以1∶3传代培养。培养液为含10μg·L-1 bFGF和10% FBS的DMEM/F12(1∶1)。用P4代细胞进行分化诱导实验。
1.2.3 免疫细胞荧光分析第3代单层培养扩增的真皮源性细胞(P3)接种于24孔板,培养3 d后用4%多聚甲醛固定10 min。此后,滴加0.2% Triton X-100,室温孵育10 min,再用PBS冲洗。以10%羊血清封闭1 h后,滴加CD90(美国Abcam公司,1∶1000)、CD105 (美国Abcam公司,1∶1000)和波形蛋白(vimentin,美国Chemicon公司,1∶200),4℃过夜。次日,将载玻片用PBS冲洗,分别滴加羊抗小鼠IgG-FITC (美国Vector公司,1∶200)或IgG-Texas Red (Vector,1∶200),室温孵育1 h,再用PBS冲洗。以DAPI染细胞核,置于荧光显微镜下观察并照相。
1.3 分化诱导实验 1.3.1 诱导分化为骨细胞分别取第3代皮肤来源细胞(实验组)和第4代BMSCs(对照组)进行成骨诱导,用含10% FBS的DMEM/F12(1∶1)制备细胞悬液,以1 × 104个/孔的密度接种至6孔板中培养。待细胞生长到90%以上后,实验组换成成骨诱导液(含体积分数 10% FBS、10 mol·L-1地塞米松、10 mmol·L-1 β-甘油磷酸钠、50 mg·L-1左旋抗坏血酸和青-链霉素的α-MEM培养基),对照组仍采用10% FBS的α-MEM培养基,每孔加液量为2.5 mL,每3d换液1次,3周时4%多聚甲醛固定茜素红染色。
1.3.2 诱导分化软骨细胞分别取第3代皮肤来源细胞和第4代BMSCs进行软骨诱导,以含10% FBS的DMEM/F12(1∶1)制备细胞浓度为5 × 105mL-1的细胞悬液,取0.5 mL细胞悬液于15 mL离心管中,以1500 r·min-1离心5 min。弃上清,添加0.5% 含软骨诱导剂的H-DMEM培养液(含10μg·L-1 TGF-β3、1% ITS-3、1×10-7 mol·L-1 地塞米松、0.3 mmol·L-1 维生素C、0.35 mmol·L-1脯氨酸、1 mmol·L-1 丙酮酸钠),每隔2 d换液1次,3周时用4%多聚甲醛固定,石蜡包埋进行番红O染色。
1.3.3 诱导分化为脂肪细胞分别取第3代皮肤来源细胞(实验组)和第4代BMSCs(对照组)进行成脂诱导,以1 × 104个/孔的密度接种至6孔板中。待细胞生长到90%以上后,实验组换成成脂诱导液(含体积分数10% FBS、1 μmol·L-1地塞米松、10μmol·L-1胰岛素、200μmol·L-1吲哚美辛、0.5 mmol·L-1异丁基甲基黄嘌呤和青-链霉素的α-MEM培养基),对照组仍采用 10% FBS的α-MEM培养基,每3d换1次液,3周时用4%多聚甲醛固定,进行油红O染色。
2 结 果 2.1 分离培养真皮细胞和免疫细胞荧光分析由于分散酶(dispase)选择性分解基底膜纤维连接素和Ⅳ型胶原,因此经其4℃过夜处理后,皮肤表皮基底层与真皮层的连接变得极为松散,很容易将完整的皮肤表层从真皮表面剥离并去除(图 1A和B,见插页三)。经胶原酶消化胶原成分后,真皮层消化成较黏稠的胶状液体,追加10~20 mL含2% FBS的PBS,反复吹打后依次用70和40 μm细胞过滤器过滤,所获取的真皮组织细胞绝大部分为单个细胞,很少部分是由2 ~ 5个细胞构成的细胞团块。细胞在含10% FBS的DMEM/F12(1∶1)培养液中呈成纤维细胞样形态,增殖活跃,约7 d时细胞融合达90%。以低密度接种的、大部分单层扩增第1代细胞在含N2、B27、bFGF和EGF的无血清培养中贴壁生长,呈典型的长梭性成纤维细胞形态且分裂增殖,5 ~ 7 d后开始零星地出现由多个细胞聚集形成的皮肤真皮源性神经球样细胞聚集体(skin dermis derived spheroids,SDDSs)。 这些SDDSs浮在培养液中或沉落在培养瓶底部,约10 d后,形成的细胞聚集体大小达到最大值,直径约为 40 μm(图 1C,见插页三)。在培养过程中,通过拍打培养瓶的方式可使贴附在培养瓶底部的SDDSs重新悬浮起来,降低SDDSs贴壁生长。无血清培养约10 d后,离心沉淀的SDDSs在含10 μg·mL-1 bFGF和10% FBS的培养液中贴壁生长,呈短缩的成纤维样细胞形态,增殖活跃,传代培养9代后细胞形态基本无变化且保持增殖活性(图 1D,见插页三)。经免疫细胞荧光分析,近90%以上的P4和P9代细胞显著表达间充质干细胞的细胞表面标志物CD90、CD105和中胚层细胞标志物细胞质波形蛋白(vimentin)。见图 2(插页三)。
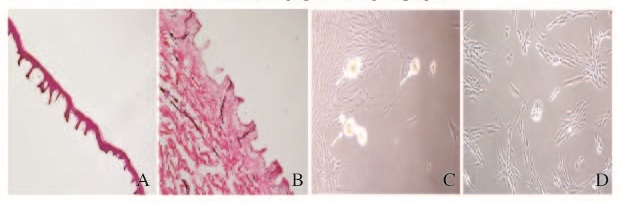
|
| A:Epidermis(×40) ; B: Dermis (×40) ; C: Spheroids suspended in medium ( white arrow)(×200); D:Monolayer culture of spheroids formed cells(×200). 图1 正常表皮与真皮形态结构及从真皮分离获得的细胞 Fig.1 Morphological structures of normal epidermis and dermis and cells isolated from dermis |
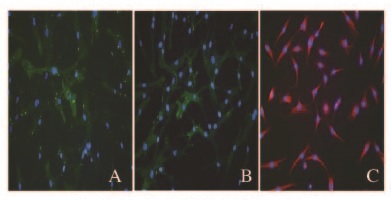
|
| A: CD90; B: CD105; C: Vimentin. 图2 免疫细胞荧光观察间充质干细胞中CD90、CD105和vimentin的表达(×200) Fig.2 Expressions of CD90, CD105 and vimentin in mesenchymal stem cells observed fluorescenceC (×200) |
在体外向骨、软骨和脂肪细胞诱导培养条件下,类似于BMSCs、皮肤真皮来源、表达CD90和CD105的细胞能够诱导分化为骨、软骨和脂肪组织。茜素红染色结果显示:分化后形成钙盐的沉积,真皮来源间充质干细胞(SMSCs)与BMSCs相似,容易向骨细胞分化。番红O染色结果显示:向软骨细胞诱导后SMSCs分化为软骨细胞并合成分泌蛋白聚糖,但细胞呈细条状且不形成软骨陷窝,明显区别于BMSCs分化形成的软骨细胞。油红O染色结果显示:2种细胞均能分化为形成脂滴的脂肪细胞,但是分化为脂肪细胞的细胞数中占少数,未观察到两者间差异。见图 3(插页四)。
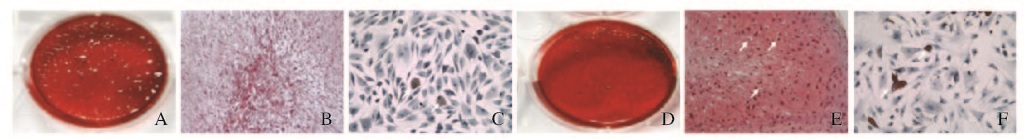
|
| A-C: SMSCs group?D -F: BMSCs; A.D: Alizarin red staining? B,E: Safranin O staining(×200) } C >F: Oil red O staining(X200). 图3 SMSCs和BMSCs诱导分化的成骨细胞(A,D)、软骨细胞(B,E)和脂肪细胞(C,F) Fig.3 OsteoblastsC A,D), chondrocytes(B,E), and adipocytes(C,F) induced and differentiated by SMSCs and BMSCs (seen on page 248 in paragraph) |
本研究结果显示:人皮肤真皮中分离的、在无血清培养液中形成的SDDSs经单层扩增后能够分化为骨细胞、软骨细胞和脂肪细胞;其分化为骨细胞和脂肪细胞的能力与BMSCs相似,但是其向软骨细胞分化有所不同。本研究结果提示:按上述方法分离培养的SMSCs可部分替代BMSCs用于骨和软骨的修复研究,但是其向软骨分化的特点有待进一步深入研究。
皮肤覆盖在人体表面,是全身最大的感觉器官。由于其分布广、取材容易,且由此分离的成纤维细胞增殖活性强、不易老化,因此早期皮肤真皮成纤维细胞广泛应用于皮肤再生修复、组织工程皮肤构建的基础和临床应用研究[6, 7, 8]。特别是Okita等[9]和Yu等[10]分别应用慢病毒向成纤维细胞导入4种不同转录因子的组合(OCT4、Sox2、KLF4、C-myc和OCT4、Sox2、nanog、Lin-28)的方法制备诱导多能干细胞(iPSCs)以来,人们对皮肤来源成纤维细胞治疗人体疾患和器官损伤再生修复的研究达到了新的热潮。最近的研究[11, 12]发现:采用 SP600125(JNK抑制剂)和SB431542(TGF-β通路抑制剂)等其他信号通路的抑制剂有机结合可以在体外将皮肤成纤维细胞诱导分化为有电生理反应的神经细胞。并且诸多学者[5, 13, 14]发现:成纤维细胞在体外诱导条件下能够分化为其他细胞。上述结果提示:按传统方法分离纯化培养的成纤维细胞可能原先是异质性的细胞群(heterogenic cell population),其中一些细胞在体内本来具有潜在的干细胞多分化能力,但是在长期体外培养过程中这些细胞的分化相关基因受表观遗传学修饰等诸多因素的影响,丧失或暂时抑制了这些分化性质;在上述外源基因或小分子的人为作用下重新激活了其原先固有的分化潜能,最终表现出了多能干细胞特点或向特定细胞跨界分化的特点。据此可以推测:如果用改进的新方法在培养早期从这些成纤维细胞中纯化培养具有干细胞特性的细胞,进行扩增用于修复和诱导分化研究,将大幅度提高再生修复效果、iPSCs制作以及直接诱导分化效率。
在真皮中分离并单层扩增的细胞中,中胚层源性细胞绝大部分显示典型成纤维细胞形态,极易贴附在无包被的培养皿底部,细胞增殖活跃,不宜用传统的方法从中纯化培养这些具有间充质干细胞特点的成纤维细胞。目前,如何从真皮成纤维样细胞中分离、培养和纯化具有多分化潜能干细胞,以及判定其特异细胞标志物方面存在争议。Chen等[5]认为:人皮肤真皮成纤维细胞中只有巢蛋白(nestin)阴性且vimentin阳性的细胞才具有多分化潜能。Toma等[15]证实:人包皮真皮组织中分离的、在无血清培养液中形成神经球样细胞聚体的皮肤前体细胞(skin-derived precursors,SKPs)具有向外胚层细胞和中胚层细胞分化的多分化潜能,这些SKPs表达nestin、纤维连接蛋白(fibronectin)和vimentin。本研究结果显示:以类似于SKPs 培养方法分离培养并单层扩增的人真皮成纤维细胞也具有向中胚层细胞分化的分化潜能,并且绝大部分细胞表达间充质干细胞标志物CD90、CD105和vimentin,非常符合间充质干细胞的细胞学特性。研究[16, 17]显示:在悬浮培养条件下,采用胰蛋白酶长时间处理(最长16 h)的方法可从人皮肤成纤维细胞中分离出具有多分化潜能的应激耐受多系分化持续应激(multilineage differentiating stress enduring,Muse)细胞,这种细胞表达SSEA-3、Sox2和OCT3/4等干细胞标志物。在本研究中虽未观察细胞是否表达Muse细胞一样的全能干细胞标志物,但结合已发表的研究结果可以肯定:在皮肤真皮成纤维中确实存在为数不多的干细胞,用特殊培养条件如无血清悬浮等培养方法,纯化和大量扩增这些细胞,将来有望应用于组织器官构建和再生医学研究。
由于皮肤是人体最大的脏器,真皮中富含具有间充质干细胞分化特性的成纤维细胞,因此以上述方法分离获取的SMSCs有望成为组织器官构建和再生医学的另一重要的种子细胞来源。
| [1] | Usategui A,del Rey MJ,Pablos JL. Fibroblast abnormalities in the pathogenesis of systemic sclerosis[J].Expert Rev Clin Immunol,2011,7(4):491-498. |
| [2] | 马晓飞,朱明,张艳,等.真皮成纤维细胞多向分化潜能的研究进展[J].组织工程与重建外科杂志,2011,7(6):347-349. |
| [3] | Lorenz K,Sicker M,Schmelzer E,et al.Multilineage differentiation potential of human dermal skin-derived fibroblasts[J].Exp Dermatol,2008,17(11):925-932. |
| [4] | Han X,Han J,Ding F,et al.Generation of induced pluripotent stem cells from bovine embryonic fibroblast cells[J].Cell Res,2011,21(10):1509-1512. |
| [5] | Chen FG,Zhang WJ,Bi D,et al.Clonal analysis of nestin(-) vimentin(+) multipotent fibroblasts isolated from human dermis[J].J Cell Sci,2007,120(Pt 16):2875-2883. |
| [6] | 晁洋,倪华,兰青艳,等.旋转发生器培养扩增人皮肤成纤维细胞[J].实用口腔医学杂志,2011,27(3):356-360. |
| [7] | 王悦,计阿丹,肖永红.17β-雌二醇对小鼠肺成纤维细胞周期的影响[J].郑州大学学报:医学版,2014,49(4):530-532. |
| [8] | Nayak S,Dey S,Kundu SC.Skin equivalent tissue-engineered construct:co-cultured fibroblasts/keratinocytes on 3D matrices of sericin hope cocoons[J].PLoS One,2013,8(9):e74779. |
| [9] | Okita K,Ichisaka T,Yamanaka S.Generation of germline-competent induced pluripotent stem cells[J].Nature,2007,448(7151):313-317. |
| [10] | Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(5858):1917-1920. |
| [11] | Li X,Zuo X,Jing J,et al.Small-molecule-driven direct reprogramming of mouse fibroblasts into functional neurons[J].Cell Stem Cell,2015,17(2):195-203. |
| [12] | Hu W,Qiu B,Guan W,et al.Direct conversion of normal and Alzheimer's disease human fibroblasts into neuronal cells by small molecules[J].Cell Stem Cell,2015,17(2):204-212. |
| [13] | Brendel C,Kuklick L,Hartmann O,et al.Distinct gene expression profile of human mesenchymal stem cells in comparison to skin fibroblasts employing cDNA microarray analysis of 9600 genes[J].Gene Expr,2005,12(4-6):245-257. |
| [14] | Yamanaka S.Induction of pluripotent stem cells from mouse fibroblasts by four transcription factors[J].Cell Prolif,2008,41(suppl 1):51-56. |
| [15] | Toma JG,McKenzie IA,Bagli D,et al.Isolation and characterization of multipotent skin-derived precursors from human skin[J].Stem Cells,2005,23(6):727-737. |
| [16] | Kuroda Y,Kitada M,Wakao S,et al.Unique multipotent cells in adult human mesenchymal cell populations[J].Proc Natl Acad Sci USA,2010,107(19):8639-8643. |
| [17] | Tsuchiyama K,Wakao S,Kuroda Y,et al.Functional melanocytes are readily reprogrammable from multilineage-differentiating stress-enduring (muse) cells,distinct stem cells in human fibroblasts[J].J Invest Dermatol,2013,133(10):2425-2435. |
 2016, Vol. 42
2016, Vol. 42


