扩展功能
文章信息
- 吕文轩, 李文耀, 范思佳, 赵殊, 郭五虎, 陈丽娟, 邓悦
- LYU Wenxuan, LI Wenyao, FAN Sijia, ZHAO Shu, GUO Wuhu, CHEN Lijuan, DENG Yue
- 瑞舒伐他汀对载脂蛋白E基因敲除小鼠动脉粥样硬化的治疗作用及其机制
- Therapeutic effect of rosuvastatin on atherosclerosis of apolipoprotein E(ApoE)-knockout mice and its mechanism
- 吉林大学学报(医学版), 2016, 42(02): 240-244
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 240-244
- 10.13481/j.1671-587x.20160210
-
文章历史
- 收稿日期: 2015-12-09
2. 吉林省白山市通化矿业集团总医院心内科, 吉林白山 134300;
3. 内蒙古自治区兴安盟科右中旗高力板镇义和道卜卫生院, 内蒙古兴安盟 029408;
4. 长春中医药大学附属医院心内科, 吉林长春 130021
2. Department of Cardiology, General Hospital, Tonghua Mining Group, Baishan City, Jilin Province, Baishan 134300, China;
3. Yihedaobu Health Center in Gaoliban Town, Keyouzhong Banner, Hinggan League, Inner Mongolia Autonomous Region, Hinggan League 029408, China;
4. Department of Cardiology, Affiliated Hospital, Changchun University of Traditional Chinese Medicine, Changchun 130021, China
近年研究[1, 2]表明:他汀类药物具有降低心血管系统危险因素、改善疾病预后的积极作用,已成为一级和二级预防心血管疾病的主要药物。瑞舒伐他汀作为一种亲水性羟甲基戊二酰辅酶A还原酶抑制剂(hydroxy methylglutaryl coenzyme A reductase inhibitor,HMG-CoA),是目前降低低密度脂蛋白(low density lipoprotein,LDL)效果最强的他汀类药物[3]。大量循证医学证据显示:瑞舒伐他汀除具有降脂作用外,还具有抑制炎症反应[1]、抗氧化[4]、改善血管内皮功能[5]、稳定斑块[6]和抗动脉硬化[7]等多效作用,进而减少心脑血管事件的发生和发展,因此目前临床已用于抗动脉粥样硬化治疗,但其抗动脉硬化的具体机制仍未阐明,目前国内对瑞舒伐他汀抗动脉硬化机制的研究尚不多,且研究结果不尽一致。本研究采用ApoE-/-小鼠制备动脉粥样硬化动物模型,通过检测小鼠血脂以及主动脉粥样硬化斑块内细胞凋亡等情况,探讨瑞舒伐他汀治疗动脉粥样硬化的作用及其机制。
1 材料与方法 1.1 药物、主要试剂和仪器瑞舒伐他汀钙片购自阿斯利康制药有限公司。总胆固醇(TC)测试盒、甘油三酯(TG)测试盒、低密度脂蛋白胆固醇(LDL-C)测试盒和高密度脂蛋白胆固醇(HDL-C)测试盒购自南京建成生物工程研究所,TUNEL细胞凋亡试剂盒购自上海碧云天公司,DAB显色试剂盒购自北京中杉公司,纯化鼠抗Bax抗体购自美国BD公司。水平离心机(中国上海菲恰尔分析仪器有限公司),石蜡切片机(美国Shandon公司),普通光学显微镜(日本Olympus公司),荧光显微镜(日本Olympus公司);-80℃超低温冰箱(日本Sanyo公司),高压湿热灭菌锅(日本Sanyo公司),酶标仪(美国Bio-Rad公司)。
1.2 实验动物及分组无特异病原(SPF)级6周龄雄性载脂蛋白E基因敲除(ApoE-/-)小鼠30只,体质量(20.0±0.5)g,购自北京华阜康生物科技股份有限公司。适应性喂养1周后,随机分为高脂饮食组、高脂+他汀组和普通饮食对照组,每组10只。高脂饮食组和高脂+他汀组小鼠喂饲高脂饲料[含1%胆固醇、8%牛油、7.5%蛋黄粉、83.5%普通饲料、熊去氧胆酸(2 mg·kg-1·d-1)、丙硫氧嘧啶(4 mg·kg-1·d-1)],普通饮食对照组小鼠喂饲普通饲料。小鼠自由摄食及饮水。3组小鼠喂养4周后,每组随机抽取1只小鼠,摘眼球取血,检测血脂;取主动脉弓,组织切片后进行HE染色。检测结果示高脂饮食组和高脂+他汀组小鼠血脂显著高于普通饮食对照组(P<0.05),且前者可见较大动脉粥样斑块,而后者管腔内未见斑块,证实造模成功。高脂饮食组、高脂+他汀组和普通饮食对照组小鼠分别给予0.9%生理盐水、瑞舒伐他汀(10 mg·kg-1·d-1)、0.9%生理盐水灌胃,继续喂养8周后,所有ApoE-/-小鼠禁食12 h,20%乌拉坦0.5 mL腹腔麻醉,摘眼球取血,3 000 r·min-1离心10 min,并将主动脉弓血管剥离、固定。
1.3 检测ApoE-/-小鼠血清血脂水平分离出小鼠血清后,根据说明书操作,用ELISA试剂盒分别检测TC、LDL-C、HDL-C和TG水平。
1.4 HE染色检测ApoE-/-小鼠主动脉粥样硬化斑块形态及面积取ApoE-/-小鼠主动脉弓血管,1%多聚甲醛固定24 h,常规石蜡包埋并切片,进行HE染色,于光镜下观察动脉粥样硬化斑块形态并拍照,计算斑块面积,比较各组动脉斑块面积大小。
1.5 TUNEL法检测ApoE-/-小鼠主动脉粥样斑块内细胞凋亡情况应用末端脱氧核糖核酸转移酶(TdT)介导的末端转移酶标记(TUNEL)技术,原位标记主动脉粥样斑块细胞核中的脱氧核糖核苷酸片段3'-OH末端,显示主动脉粥样斑块内细胞凋亡的存在。按试剂盒说明书操作,组织切片,经脱蜡、水化、固定、再固定等初处理,再经平衡、反应、终止反应等处理,后经DAPI核染,滴加抗荧光淬灭剂、封片等操作,最后在荧光显微镜下观察斑块内细胞凋亡情况。凋亡细胞核呈红色不规则颗粒状。每组分别随机选择6个视野,计数主动脉斑块内凋亡和正常细胞核数,计算主动脉斑块内细胞凋亡指数。斑块内细胞凋亡指数=凋亡细胞核数/(凋亡细胞核数+正常心肌细胞核数)×100%。
1.6 SP免疫组织化学法检测Bax蛋白表达采用SP免疫组织化学法检测相关蛋白表达,取ApoE-/-小鼠主动脉弓血管,经4%多聚甲醛固定,组织切片,经二甲苯常规脱蜡(10 min×2次)、梯度酒精(无水酒精5 min×2次,95%酒精5 min×2次,80%酒精5 min×2次)水化,蒸馏水洗涤2次。每张切片加50μL3% H2O2封闭内源性过氧化物酶,室温下孵育10 min。pH7.4 PBS冲洗(3 min×3次,下同)。每张切片经2%BSA-PBS室温下孵育30 min,PBS洗涤1次,滴加50 μL兔抗鼠多克隆抗体Bax(1∶200稀释),4℃过夜,PBS冲洗3 min×3次后分别用羊抗兔IgG孵育30 min。采用DAB试剂盒,按说明书操作进行显色。PBS冲洗3 min×3次。苏木精复染,自来水冲洗返蓝,梯度酒精脱水干燥,二甲苯透明,封片,光学显微镜观察。Bax蛋白在细胞胞浆中表达,呈棕黄色颗粒状,且颜色越深,表达越强。
1.7 统计学分析应用SPSS19.0统计软件进行统计学分析。各组小鼠血清血脂水平、主动脉粥样斑块面积及斑块内细胞凋亡指数以x±s表示,对于符合正态分布且总体方差齐的数据采用单因素方差分析,不符合正态分布且总体方差不齐的数据采用Kruskal-Wallis H检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 瑞舒伐他汀作用后各组小鼠血清血脂水平与普通饮食对照组比较,高脂饮食组小鼠各项血脂指标均明显升高(P<0.05)。与高脂饮食组比较,高脂+他汀组小鼠血清中LDL-C和TC水平明显降低(P<0.05),HDL-C明显升高(P<0.05)。见表 1。
| n=9,x±s,cB/(mmol·L-1)] | ||||
| Group | TG | TC | LDL-C | HDL-C |
| *P<0.05, ** P<0.01 compared with general diet control group; △P<0.05, △△P<0.01 compared with high fat diet group. | ||||
| General diet control | 1.96±0.05 | 13.16±1.47 | 5.85±0.39 | 0.46±0.05 |
| High fat diet | 5.87±0.15** | 14.93±1.35* | 19.38±0.18** | 2.16±0.54** |
| Rosuvastatin | 5.75±0.21 | 13.50±1.09△ | 11.19±0.99△△ | 3.20±0.89△△ |
普通饮食对照组小鼠血管内未见粥样斑块形成,未见泡沫细胞,内膜光滑完整,中膜平滑肌排列整齐。高脂饮食组小鼠血管内可见脂质斑块形成,并向管腔内突出,内含大量泡沫细胞、坏死灶、炎性细胞及胆固醇结晶,部分平滑肌向内膜迁移增殖,还可见大量脂质空泡,斑块面积较大。与高脂饮食组比较,高脂+他汀组小鼠动脉斑块明显变小[(12531.60±1591.02) μm2 vs(8217.46±936.10)μm2,P<0.01],泡沫细胞、坏死灶及炎性细胞均较少。见图 1(插页三)。
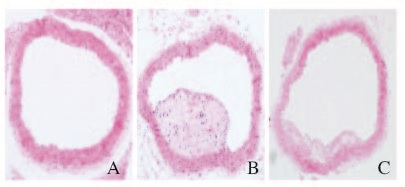
|
| A: General diet control group; B: Hight fat diet group;C: Rosuvastatin group. 图1 各组小鼠主动脉HE染色结果(×100) Fig.1 HE staining results of aorta of mice in various groups(×100) |
采用TUNEL染色检测主动脉粥样硬化斑块内凋亡细胞,并计算凋亡指数。在荧光显微镜下,正常细胞核显色为绿色,凋亡细胞核为红色不规则颗粒状。与高脂饮食组比较,高脂+他汀组斑块内细胞凋亡指数显著降低[(33.50±4.75)% vs (20.62±3.61)%](P<0.01)。
Bax是线粒体凋亡途径主要蛋白,其升高可以诱导细胞凋亡。高脂饮食组小鼠动脉斑块区域抗Bax抗体染色均为棕黄色;与高脂饮食组比较,高脂+他汀组小鼠主动脉斑块内染色明显变浅。见图 2(插页三)。
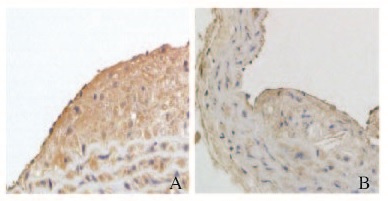
|
| A: High fat diet group;B: Rosuvastatin group. 图2 免疫组织化学染色检测各组小鼠主动脉 粥样斑块内Bax蛋白表达(×200) Fig.2 Expressions of Bax protein in aortia atherosclerotic plaque of mice in various groups detected by immunohistochcmical staining (×200) |
目前认为动脉粥样硬化是一种以血管壁脂质斑块为主要特征的慢性炎症性疾病[8, 9, 10],是各种急慢性心脑血管事件的重要发病基础,现已成为严重危害人类健康的主要病因之一。动脉粥样硬化是一种多因性疾病,在其形成过程中,高血脂、慢性炎性损伤、氧化应激等因素均可损伤血管内皮,诱导单核细胞迁移至损伤部位,吞噬沉积在内皮下的经氧化修饰的LDL,进而激活巨噬细胞,分泌大量炎性介质,后者可损伤血管壁,加剧局部炎症反应并促进动脉粥样硬化的不断进展[11]。动脉粥样硬化具有重要病理意义,包括血栓形成、血管重构、粥样斑块不稳定,甚至破裂[12]。因此,如何阻止动脉粥样硬化的发生发展是人类面临的重要课题。
载脂蛋白E(apolipoprotein E,ApoE)是血液中一种多功能载脂蛋白,在机体脂代谢平衡中发挥重要作用。ApoE可通过LDL受体和受体相关蛋白硫酸肝素糖蛋白途径介导肝脏对极低密度脂蛋白(very low density lipoprotein,VLDL)和LDL的清除,同时也参与血管壁巨噬细胞胆固醇的外流、抗炎、抗氧化等,被公认为抗动脉粥样硬化的功能蛋白[13]。ApoE具有多态性,而其多态性决定个体血脂水平与动脉粥样硬化发生发展密切相关[14]。ApoE-/-小鼠因缺乏向外运载血脂的能力,因而可以在短期内自发形成动脉粥样硬化的动物模型,模拟人类动脉粥样硬化病变。为本研究得出正确结论提供了重要保障。
以往认为他汀类药物只能延缓动脉粥样硬化进展,近年研究[15]发现:瑞舒伐他汀是现有唯一能够逆转动脉粥样硬化病变进展的他汀类药物,但目前其逆转斑块、抗动脉硬化的机制尚不明确。本研究利用成功制备的ApoE-/-小鼠动脉粥样硬化模型,通过血脂水平检测显示瑞舒伐他汀具有降低血清LDL-C水平作用,该作用与以往的报道一致。对主动脉粥样硬化斑块的形态学观察显示:应用瑞舒伐他汀的小鼠不仅斑块缩小,斑块内凋亡细胞数量也减少,与Nissen等[16]的研究结果一致。本研究结果还显示:瑞舒伐他汀能够显著下调主动脉粥样硬化斑块内线粒体凋亡途径的Bax蛋白表达。
综上所述,瑞舒伐他汀可能通过降低LDL-C水平抑制动脉粥样硬化斑块的发展,通过抑制斑块内细胞凋亡进而稳定动脉粥样斑块,其抑制细胞凋亡作用与线粒体凋亡途径有关。本实验结果为进一步应用瑞舒伐他汀治疗动脉粥样硬化提供了有力的数据支持。
| [1] | Blum A.HMG-CoA reductase inhibitors (statins),inflammation,and endothelial progenitor cells-New mechanistic insights of atherosclerosis[J].Biofactors,2014,40(3):295-302. |
| [2] | Ludman A,Venugopal V,Yellon DM,et al.Statins and cardioprotection——more than just lipid lowering[J].Pharmacol Ther,2009,122(1):30-43. |
| [3] | Tadasuke C,Seigo S,Kenji S,et al.Effect of a hydrophilic and a hydrophobic statin on cardiac salvage after ST-elevated acute myocardial infarction-a pilot study[J].Atherosclerosis,2014,237(1):251-258. |
| [4] | Moon GJ,Kim SJ,Cho YH,et al.Antioxidant effects of statins in patients with atherosclerotic cerebrovascular Disease[J].J Clin Neurol,2014,10(2):140-147. |
| [5] | Eirik I,Jonny H,Silvia R,et al.Rosuvastatin improves endothelial function in patients with inflammatory joint diseases,longitudinal associations with atherosclerosis and arteriosclerosis:results from the RORA-AS statin intervention study[J].Arthritis Res Ther,2015,17(1):279-282. |
| [6] | Jonathan EF,Jessica LF,Annapoorna SK.Statins,atherosclerosis regression and HDL:Insights from within the plaque[J].Int J Cardiol,2015,289(1):168-171. |
| [7] | Amemiya K,Yokoi H,Domei T,et al.Suppressive effects of standard-dose rosuvastatin therapy on the progression of coronary atherosclerosis in Japanese patients:the APOLLO study[J].J Atherosc Thromb,2014,21(12):1298-1307. |
| [8] | Tietge UJ.Hyperlipidemia and cardiovascular disease:inflammation,dyslipidemia,and atherosclerosis[J].Curr Opin Lipidol,2014,25(1):94-95. |
| [9] | 刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报:医学版,2015,36(2):141-152. |
| [10] | 王晓华,付超,张鑫,等.SDF-1/CXCR-4-R7轴与动脉粥样硬化关系研究进展[J].中国实验诊断学,2015,19(5):860-864. |
| [11] | Luigi GS,Elena B,Giuseppe S,et al.Role of inflammation in atherosclerosis[J].J Nucl Med,2007,48(1):800-815. |
| [12] | 常萍,郭瑞臣.心血管系统临床药理学[M].北京:化学工业出版社,2010:76-78. |
| [13] | Hatters DM,Peters-Libeu CA,Weisgraber KH.Apolipoprotein E structure:insights into function[J].Trends Biochem Sci,2006,31(8):445-454. |
| [14] | Dzimiri N,Meyer BF,Hussain SS,et al.Relevance of apolipoprotein E polymorphism for coronary artery disease in the Saudi population[J].Arch Pathol Lab Med,1999,123(12):1241-1245. |
| [15] | Sipahi I,Tuzcu EM,Schoenhagen P,et al.Paradoxical increase in lumen size during progression of coronary atherosclosis:observations from the REVERSAL trial[J].Atherosclerosis,2006,189(1):229-235. |
| [16] | Nissen SE,Nicholls SJ,Sipahi I,et al.Effect of very high-intensity statin therapy on regression of coronary atherosclerosis:the ASTEROID trial[J].JAMA,2006,295(13):1556-1565. |
 2016, Vol. 42
2016, Vol. 42


