扩展功能
文章信息
- 崔跃, 姜欢, 崔聪聪, 胡敏
- CUI Yue, JIANG Huan, CUI Congcong, HU Min
- 局部注射熊果酸对大鼠正畸牙移动和牙根吸收的减缓作用及其机制
- Ease effects of local injection of ursolic acid on orthodontic tooth movement and root resorption of rats and their mechanisms
- 吉林大学学报(医学版), 2016, 42(02): 231-235
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 231-235
- 10.13481/j.1671-587x.20160208
-
文章历史
- 收稿日期: 2015-12-17
牙根吸收是正畸治疗过程中常见且难以避免的并发症。在力的作用下,牙齿的移动由一系列复杂的生物学过程参与,这些过程使牙齿更容易发生牙根吸收[1]。牙根吸收的过程与骨吸收相似[2],由与破骨细胞形态相仿、细胞活性和功能特征相似的破牙骨质细胞承担主要的吸收功能,这一过程包括酸化与有机基质的降解。在受压力侧,牙根表面形成吸收陷窝[3, 4],最终导致牙根吸收。破骨细胞蛋白质酪氨酸磷酸酶(osteoclastic protein-tyrosine phosphatase,PTP-oc)主要在破骨细胞中表达[5],且对破骨细胞具有正调节作用[6]。利用基因敲除技术敲除破骨细胞中的PTP-oc,可以干扰核因子κB受体活化因子配体(receptor activator for nuclear factor kappa-B ligand,RANKL)介导的破骨细胞分化[7]。因此,以PTP-oc为靶点,抑制其活性,可能会为防治牙根吸收提供一定的帮助。熊果酸是一种中药单体,是存在于天然植物中的一种五环三萜类化合物,研究[8, 9, 10]显示:熊果酸是针对PTP-oc的有效抑制剂,能够影响破骨细胞的分化,在体内和体外均对骨吸收产生一定的抑制作用。目前,国内外有关正畸所致牙根吸收的治疗少有文献报道,虽有研究[11]证明淫羊藿苷对正畸所致牙根吸收具有一定抑制作用,但是并未阐述其作用机制,也未明确不同剂量淫羊藿苷对牙根吸收的影响。本实验建立大鼠正畸牙移动模型,探讨不同剂量熊果酸对大鼠正畸牙牙齿移动距离和牙根吸收的影响,阐明其作用机制,为牙根吸收防治的研究提供一定的理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器96只8周龄健康、清洁级雄性Wistar大鼠,由吉林大学白求恩医学院动物实验中心提供,体质量(225±25)g,动物合格证号:SYXK(吉)2013-0005。熊果酸单体(中国上海阿拉丁生化科技股份有限公司)。XS205电子天平(德国Mettler Toledo公司),G-560E涡轮机(美国Scientific Industries公司),体质量计(中国上海信衡电子有限公司),正畸镍钛拉簧 (0.012inch×6 mm,美国3M公司),结扎丝(0.25 mm,杭州新亚公司),正畸弹簧测力计(中国杭州奥杰公司),数显游标卡尺 (中国桂林广陆数字测控股份有限公司)。
1.2 建立Wistar大鼠正畸牙移动模型全麻条件下,将大鼠仰卧固定在手术台,用牙科高速涡轮车针在大鼠右侧上颌切牙和第一磨牙龈缘处做浅的固位沟,用0.25 mm正畸不锈钢结扎丝将镍钛拉簧结扎在上颌切牙与第1磨牙之间,用正畸测力计测量镍钛拉簧产生50 g的拉力,以大鼠前牙为支抗牵引右侧上颌第1磨牙向近中移动(图 1,见插页二)。自由进水进食,每日检查装置是否脱落或损坏,如有脱落,及时再次安放。将模型大鼠按熊果酸浓度(配制成生理盐水熊果酸混悬工作液)不同随机分成4组:0(对照组)、0.5、1.0和2.0 mmol·L-1熊果酸组,每组24只。将熊果酸工作液注射入各组大鼠右侧上颌第1磨牙近中颊侧的黏骨膜下,每 3d 1次,每次 50 μL。在加力1、3、5、7、10、14、21和28d后,每组分别麻醉处死3只大鼠。
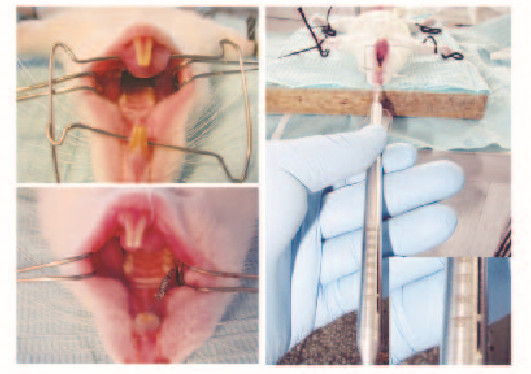
|
| 图1 大鼠正畸牙移动模型 Fig.1 Orthodontic tooth movement model of rats |
将大鼠处死后,取上颌骨组织,尽量修整去净周围软组织,利用个别托盘取大鼠上颌阴模并制作精准石膏模型。采用游标卡尺测量双侧上颌第1磨牙近中舌沟点至上颌第3磨牙远中点的距离。测量由同一操作者完成。每个标本反复测量5次,取平均值作为测量结果,计算牙齿移动距离。大鼠牙齿移动距离=右侧测量值—左侧测量值。
1.4 制备组织标本将取下的大鼠上颌骨组织固定于4%多聚甲醛液中,48h后用10%EDTA进行脱钙,定期更换脱钙液检查脱钙情况。脱钙后的标本经酒精逐级脱水,二甲苯透明处理后,用石蜡进行包埋。使用LEICA切片机沿磨牙长轴进行近远中向连续切片,每张厚约5 μm。
1.5 HE染色观察大鼠牙根组织形态组织切片经常规二甲苯、梯度酒精脱蜡,洗去酒精后移至蒸馏水中。苏木精染色约5 min,洗去浮色,置于1%盐酸酒精分化数秒,水洗,0.5%伊红复染约3 min,70%酒精、85%酒精、95%酒精、无水乙醇脱水。二甲苯透明,中性树胶封片,光镜下观察牙根组织形态表现。
1.6 统计学分析采用SPSS20.0统计软件进行统计学分析。大鼠正畸牙移动距离以x±s表示,组内不同时间点及组间大鼠牙移动距离比较采用单因素方差分析,两两组间比较采用SNK-q法检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组大鼠不同时间点牙齿移动距离对照组、0.5、1.0和2.0 mmol·L-1熊果酸组大鼠牙移动距离均随加力时间延长而增加(P<0.01)。与对照组比较,0.5 mmol·L-1熊果酸组在加力1、5和10 d后大鼠牙移动距离差异无统计学意义(P>0.05),加力3、7、14、21和28d后大鼠牙移动距离差异有统计学意义(P<0.05或P<0.01);1.0和2.0 mmol·L-1熊果酸组在加力1 d后大鼠牙移动距离与对照组比较差异无统计学意义(P>0.05),其他时间点大鼠牙移动距离与对照组比较差异均有统计学意义(P<0.01)。与0.5 mmol·L-1熊果酸组比较,1.0 mmol·L-1熊果酸组在加力5、7、10、14、21和28d后大鼠牙移动距离差异有统计学意义(P<0.05或P<0.01);2.0 mmol·L-1熊果酸组在加力3、5、7、10、14、21和28d后大鼠牙移动距离差异有统计学意义(P<0.05或P<0.01)。与1.0mmol·L-1 熊果酸组比较,2.0 mmol·L-1熊果酸组在加力5、7、10、14、21和28d后大鼠牙移动距离差异有统计学意义(P<0.05或P<0.01)。各组大鼠在不同时间点牙齿移动距离测量结果见表 1。
| (n=24,x±s,l/mm) | |||||
| Group | Tooth movement distance | ||||
| ( t/d) 1 | 3 | 5 | 7 | 10 | |
| *P<0.05, ** P<0.01 compared with control group; △P<0.05, △△P<0.01 compared with 0.5 mmol·L-1 ursolic acid group; # P<0.05, ##P<0.01 compared with 1.0 mmol·L-1 ursolic acid group. | |||||
| Control | 0.043±0.026 | 0.290±0.114 | 0.397±0.037 | 0.537±0.019 | 0.713±0.050 |
| Ursolic acid(mmol·L -1) | |||||
| 0.5 | 0.040±0.028 | 0.220±0.014 ** | 0.373±0.041 | 0.497±0.056 * | 0.680±0.050 |
| 1.0 | 0.037±0.009 | 0.200±0.062 ** | 0.343±0.037 *△△ | 0.430±0.122 **△△ | 0.597±0.102 **△△ |
| 2.0 | 0.035±0.004 | 0.177±0.012 **△ | 0.313±0.056 **△△# | 0.357±0.021 **△△## | 0.470±0.091 **△△## |
| Group | Tooth movement distance | F | P | ||
| 14 | 21 | 28 | |||
| Control | 0.893±0.039 | 1.220±0.085 | 1.550±0.188 | 773.503 | <0.001 |
| Ursolic acid(mmol·L -1) | |||||
| 0.5 | 0.800±0.008 ** | 1.083±0.071 ** | 1.260±0.067 ** | 1889.54 | <0.001 |
| 1.0 | 0.717±0.094 *△△ | 0.897±0.021 **△△ | 1.150±0.057 **△△ | 606.574 | <0.001 |
| 2.0 | 0.550±0.073 *△△## | 0.740±0.080 *△△## | 1.051±0.071 **△△## | 694.377 | <0.001 |
加力1 d后,各组大鼠牙根分叉压力侧组织均无明显变化。见图 2(插页二)。
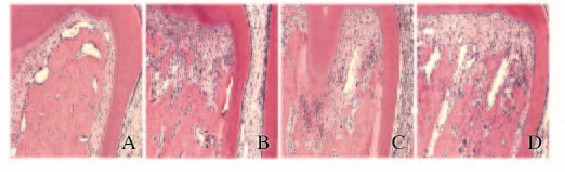
|
| A:Control group;B:0.5 mmol • L ursolic acid;C:1.0 mmol • L ursolic acid;D:2.0 mmol • L ursolic acid. 图2 加力1 d后各组大鼠牙根形态学(HE, ×100) Fig.2 Morphology of rat root 1 d after forcing (HE, ×100) |
加力7 d后,对照组大鼠根分叉压力侧表面牙骨质不连续,出现骨吸收陷窝;0.5和1.0 mmol·L-1熊果酸组则未见明显变化;2.0 mmol·L-1熊果酸组虽可见骨吸收陷窝,但吸收范围少于对照组。见图 3(插页三)。
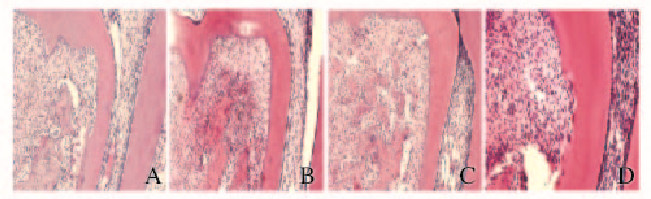
|
| A:Control group;B:0.5 mmol • L ursolic acid;C:1.0 mmol • L ursolic acid;D:2.0 mmol • L ursolic acid. 图3 加力7 d后各组大鼠牙根形态学(HE, ×100) Fig.3 Morphology of rat root 7 d after forcing ( HE,×100) |
加力14 d后,对照组大鼠根尖和根分叉处均发生不同程度的吸收;0.5和1.0mmol·L-1熊果酸组大鼠牙根吸收主要出现在受压力侧的根中1/3;而2.0mmol·L-1熊果酸组大鼠根分叉及根尖形态基本完整,未出现明显的吸收。见图 4(插页二)。
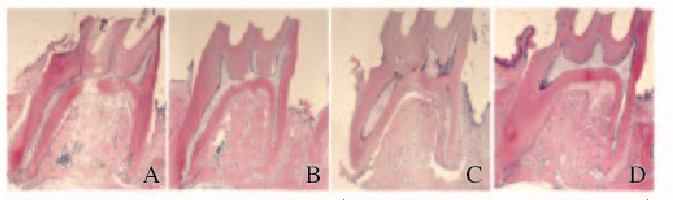
|
| A:Control group;B:0.5 mmol • L ursolic acid;C:1.0 mmol • L ursolic acid;D:2.0 mmol • L ursolic acid. 图4 加力14 d后各组大鼠牙根形态学(HE, ×20) Fig.4 Morphology of rat root 14 d after forcing (HE, ×20) |
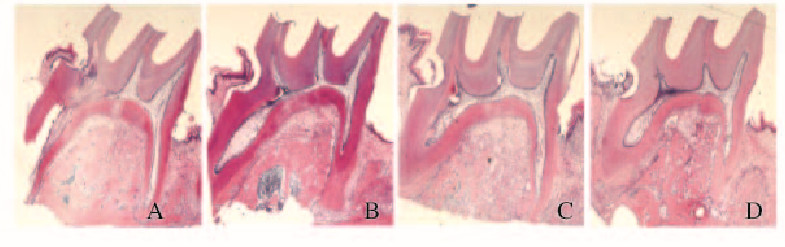
加力28d后,对照组大鼠根尖受压力侧有轻度吸收,0.5、1.0和2.0 mmol·L-1熊果酸组均未发生根尖形态的明显变化。见图 5(插页二)。
|
| A:Control group;B:0.5 mmol·L ursolic acid;C:1.0 mmol·L ursolic acid; D:2.0 mmol·L-1 ursolic acid. 图5 加力28 d后各组大鼠牙根形态学(HE,×20) Fig.5 Morphology of rat root 28 d after forcing (HE, ×20) |
正畸牙移动过程通过牙周膜的改建实现 [12],但在力值大小、加力时间[13]、加力方式[14]和患者自身情况[15, 16, 17]等多种因素的影响下,患者往往会发生不同程度的牙根吸收,且牙根吸收的监测存在滞后性,早期的牙根吸收难以精准判断[18],临床上发现的牙根吸收往往进展到了一定的程度,严重者甚至可以导致牙齿松动脱落,因此预防和治疗牙根吸收,成为亟待解决的一个问题。
正畸所致牙根吸收具有炎症反应的所有特征,又称其为正畸导致的炎性牙根吸收(orthodontically induced inflammatory root resorption,OIIRR)[19, 20, 21, 22]。PTP-oc在破骨细胞中特异性表达,因此研究者认为抑制PTP-oc的活性可以在一定程度上抑制牙根吸收。
熊果酸是一种中药单体,主要存在于枇杷叶和女贞叶中,具有镇静、抗炎和抗菌等多种生物学效应。此外,熊果酸还具有明显的抗氧化功能,因而被广泛地用作医药和化妆品原料。
本研究观察熊果酸对大鼠正畸牙移动和牙根吸收影响的结果表明:熊果酸在抑制正畸所致牙根吸收方面具有一定的作用,但作用效果不是十分明显,这可能与本文作者在移动牙齿时加力相对保守、建立的是大鼠正畸牙移动模型而不是正畸牙根吸收模型有关。
熊果酸抑制牙根吸收的同时会使牙齿移动速度减慢,这样的结果有悖于正畸医师所追求的高效矫治。由此可见,熊果酸治疗正畸所致牙根吸收有利有弊,在临床实践中需要权衡利弊,合理应用。
| [1] | Roscoe MG, Meira JB, Cattaneo PM. Association of orthodontic force system and root resorption:A systematic review[J].Am J Orthod Dentofac Orthop,2015,147(5):610-626. |
| [2] | Oshiro T, Shibasaki Y, Martin TJ, et al. Immunolocalization of vacuolar type H+-ATPase, cathepsin K, matrix metalloproteinase-9,and receptor activator of NF kappaB ligand in odontoclasts during physiological root resorption of human deciduous teeth[J]. Anat Rec,2001, 264(3):305-311. |
| [3] | Hendriks WJ, Elson A, Harroeh S, et al. Protein tyrosine phosphatases:functional inferences from mouse models and human diseases[J]. FEBS J, 2008, 275(5):816-830. |
| [4] | Sheng MH, Wergedal JE, Mohan S, et al. Osteoaetivin is a novel osteoclastic protein and plays a key role in osteoclast differentiation and activity[J]. FEBS Lett, 2008, 582(10):1451-1458. |
| [5] | Jiang H, Sui Y, Cui Y, et al. Expression, purification, and characterization of human osteoclastic protein-tyrosine phosphatase catalytic domain in Escherichia coli[J]. Protein Expr Purif, 2015, 107:7-12. |
| [6] | Amoui M, Suhr SM, Baylink DJ,et al. An osteoclastic proteintyrosine phosphatase may play a role in the differentiation and activity of human monocytic U-937 cell-derived, osteoclast like cells[J]. Am J Physiol Cell Physiol,2004,287(4):C874-C884. |
| [7] | Yang JH, Amoui M, Lau KH. Targeted deletion of the osteoclast protein-tyrosine phosphatase (PTP-oc) promoter prevents RANKL-mediated osteoclastic differentiation of RAW264.7 cells[J].FEBS Lett,2007, 581(13):2503-2508. |
| [8] | 姜欢.PTP-oc抑制剂——熊果酸对破骨细胞分化及正畸牙根吸收的影响[D].长春:吉林大学,2015. |
| [9] | Tan H, Ashour A, Katakura Y, et al. A structure-activity relationship study on anti osteoclastogenesis effect of triterpenoids from the leaves of loquat (Eriobotrya japonica)[J]. Phytomedicine, 2015,22(4):498-503. |
| [10] | Jiang C, Xiao F, Gu X, et al.Inhibitory effects of ursolic acid on osteoclastogenesis and titanium particle induced osteolysis are mediated primarily via suppression of NF-κB signaling[J]. Biochimie, 2015, 111:107-118. |
| [11] | 周艳妮,曹宝成,蒋小龙,等.淫羊藿苷可抑制正畸致牙根的吸收[J].中国组织工程研究,2013,17(28):5171-5176. |
| [12] | Diercke K, Kohl A, Lux CJ, et al. Compression of human primary cementoblasts leads to apoptosis:A possible cause of dental root resorption[J]. J Orofac Orthop, 2014, 75(6):430-445. |
| [13] | Nakano T, Hotokezaka H, Hashimoto M, et al. Effects of different types of tooth movement and force magnitudes on the amount of tooth movement and root resorption in rats[J]. Angle Orthod, 2014, 84(6):1079-1085. |
| [14] | Sawicka M, Bedini R, Wierzbicki PM, et al. Interruptedorthodonticforce results in lessroot resorptionthan continuous force in human premolars as measured by micro-computed tomography[J]. Folia Histochem Cytobiol, 2014, 52(4):289-296. |
| [15] | Jiang RP, McDonald JP, Fu MK. Root resorption before and after orthodontic treatment:a clinical study of contributory factors[J]. Eur J Orthod, 2010, 32(6):693-697. |
| [16] | Oenning AC, Neves FS, Alencar PN, et al. External root resorption of the second molar associated with third molar impaction:comparison of panoramic radiography and cone beam computed tomography[J]. J Oral Maxillofac Surg, 2014, 72(8):1444-1455. |
| [17] | Harris EF, Kineret SE, Tolley EA. A heritable component for external apical root resorption in patients treated orthodontically[J].Am J Orthod Dentofacial Orthop,1997, 111(3):301-309. |
| [18] | 余丽霞,何姝姝,陈嵩.全景及根尖片对正畸相关牙根吸收诊断准确性的研究[J].华西口腔医学杂志, 2012,30(2):169-172. |
| [19] | Brezniak N, Wasscrstein A. Orthodontically induced inflammatory root resorption[J]. Angle Orthod, 2002, 72:175-184. |
| [20] | Krishnan V, Davidovitch Z. Cellular, molecular, and tissue-level reactions to orthodontic force[J]. Am J Orthod Dentofac Orthop, 2006, 129(4):469.e1-469.e32. |
| [21] | Yamaguchi M. RANK/RANKL/OPGduring orthodontic tooth movement[J]. Orthod Craniofac Res, 2009, 12(2):113-119. |
| [22] | Knop LA, Shintcovsk RL, Retamoso LB, et al. Non-steroidal and steroidal anti-inflammatory use in the context of orthodontic movement[J]. Eur J Orthod, 2012, 34(5):531-535. |
 2016, Vol. 42
2016, Vol. 42


