扩展功能
文章信息
- 吴乃蓬, 王宇, 宋佳, 武振旭, 高田林, 冯祥汝, 付川, 王宗良, 王春艳
- WU Naipeng, WANG Yu, SONG Jia, WU Zhenxu, GAO Tianlin, FENG Xiangru, FU Chuan, WANG Zongliang, WANG Chunyan
- 重组人胶原绑定骨形态发生蛋白2在大肠杆菌中的表达、纯化与复性
- Expression,purification and renaturation of recombinant human collagen-binding bone morphogenetic protein-2 from Escherichia coli
- 吉林大学学报(医学版), 2016, 42(02): 226-230
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 226-230
- 10.13481/j.1671-587x.20160207
-
文章历史
- 收稿日期: 2015-11-11
2. 中国科学院长春应用化学研究所再生医学材料课题组, 吉林长春 130021
2. Regenerative Medicine Material Research Group, Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130021, China
骨形态发生蛋白2(bone morphogenetic protein-2,BMP2)是骨形态发生蛋白家族(bone morphogenetic proteins,BMPs)中研究较多也是临床广泛应用的一种生长因子。BMPs为人体内具有多种功能的转化生长因子(transforming growth factor,TGF)β超家族中的一系列生长因子,在人体细胞增殖、分化等多个阶段参与多项调节作用。BMP2作为BMPs家族中诱导活性最强的成员[1],在骨组织工程研究领域中具有显著作用,同时在临床上已得到广泛的应用。美国食品药品监督管理局(Food and Drug Administration,FDA)为促进某些类型的脊椎退行性椎间盘疾病的治疗,已经批准了首个含有重组人源性BMP2(rhBMP2)的产品[2]。其天然活性结构为2条成熟多肽链之间通过一个二硫键连接而形成的同源二聚体,每条成熟多肽单链中含有7个半胱氨酸残基,并可形成3个肽链内的二硫键[3]。已有多项研究[3, 4, 5]表明:BMP2在骨折愈合、骨缺损修复、肌腱和韧带与骨的再整合、软骨修复过程中有良好的作用效果,且与其他生长因子,如血小板衍生性生长因子等在骨形成中存在多种协同作用[6]。但BMP2在机体内存在半衰期短、易向周围组织扩散或随血液扩散流失等缺点,导致其无法长期稳定的作用于机体。为了增强BMP2在作用部位的靶向性、持续性和稳定性,目前常用的方法是利用基因重组技术制备具有绑定功能的BMP2,使其能够与细胞外基质材料、天然高分子材料、合成高分子材料和金属材料表面特异性的结合。胶原存在于大部分的组织中,同时也是细胞外基质的重要组成成分,所以胶原可以作为治疗应用中一种理想的靶标[7]。携带胶原结合结构域(collagen-binding domain,CBD)的重组蛋白能够特异性地与胶原结合,目前应用的CBD基因片段分别来自血管性血友病因子(von Willeband’ s factor,vWFs,10个氨基酸)、人源性胶原酶(8个氨基酸)、细菌源性胶原酶(相对分子质量约为24000)以及纤连蛋白(相对分子质量为27000~40000)。已有研究[8, 9]采用真核表达系统对BMP2、BMP4以及BMP9等进行表达,纯化后的蛋白可具有天然结构,并表现出良好的生物学活性,但真核系统表达均难以克服其表达量低、成本高的缺点。也有研究人员[10]采用植物表达体系对BMPs蛋白进行了表达,但过程周期长,技术要求复杂。原核表达系统制备重组蛋白具有产量大、成本低的优点,本研究旨在构建带有CBD的rhBMP2,采用原核表达系统对其进行诱导表达。并通过对优化的复性方法的摸索,建立rhBMP2的复性条件,为在大肠杆菌中大量获得CBD-BMP2蛋白建立可行的实验方法。
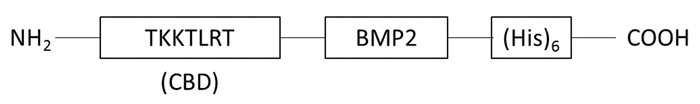
1 材料与方法 1.1 pet21b/CBD-BMP2载体的构建参照GenBank发布的BMP2单体基因序列对BMP2表达载体进行设计并对其命名为pet21b/BMP2。基因上游对应酶切位点为Nde1,下游对应酶切位点为Xho1。在上游酶切位点与BMP2基因序列之间插入CBD(来自于胶原酶,氨基酸序列为TKKTLRT)基因序列(图 1),并由上海生工公司合成,质粒命名为pet21b/CBD-BMP2。
|
| 图 1 rhCBD-BMP2蛋白结构示意图 Fig.1 Schematic diagram of constriction of rhCBD-BMP2 |
选取转化有重组质粒的BL21菌株100 μL接种至10 mL含100 mg·L-1氨苄青霉素的LB培养基中,37℃摇床培养过夜,转入1 L含100 mg·L-1氨苄青霉素的YTA培养基中,37℃摇床培养至600nm处吸光度(A)值为0.6~0.8时,加入IPTG至终浓度为1 mmol·L-1,37℃摇床继续培养3 h。对诱导前后全菌体进行18% SDS-PAGE分析。
1.3 裂菌、包涵体的溶解和纯化诱导后的大肠杆菌培养基在4℃经过4000 g离心20 min,每1g湿重大肠杆菌加入5 mL裂解缓冲液(8 mol·L-1 尿素,100 mmol·L-1 NaH2PO4,10 mmol·L-1 Tris-HCl,pH 8.0),室温下持续搅拌15~60 min对大肠杆菌进行破碎,注意防止泡沫的产生。室温下对裂解产物进行离心,10000 g离心20~30 min以便对细菌碎片进行沉淀,回收上清。本载体采用组氨酸标签,选用镍柱亲和层析对目的蛋白进行纯化。室温下,将50% NI-NTA悬浊液以1:4的比例加入裂解液中,在摇床上以200 r·min-1、15~20 min持续摇晃进行混匀。将混合液加入到层析柱中,收集流出液。选用洗涤缓冲液(8 mol·L-1 尿素,100 mmol·L-1 NaH2PO4,10 mmol·L-1 Tris-HCl,pH 6.3)洗涤2次。洗脱缓冲液A(8 mol·L-1 尿素,100 mmol·L-1 NaH2PO4,10 mmol·L-1 Tris-HCl,pH 5.9)洗脱4次。洗脱缓冲液B(8 mol·L-1 尿素,100 mmol·L-1 NaH2PO4,10 mmol·L-1 Tris-HCl,pH 4.5)洗脱4次。采用15% SDS-PAGE对全菌体蛋白以及纯化效果进行分析。对裂解后上清、菌沉及纯化结果采用18% SDS-PAGE进行分析。
1.4 蛋白复性纯化后的CBD-BMP2溶解于洗脱缓冲液B中,以0.5 mL·min-1的速度4℃条件下缓慢向其中滴加超纯水,稀释至溶液中尿素终浓度低于1 mol·L-1。采用超纯水作为透析外液,3500透析袋对稀释后的蛋白进行4℃透析2 d,每12 h更换1次透析液。采用18% SDS-PAGE对蛋白复性结果进行分析。
1.5 蛋白定量用洗脱缓冲液B配置梯度浓度的牛血清白蛋白溶液:0、200、400、600、800和1000 mg·L-1,重组蛋白样品稀释至适当浓度,25 μL样品或标准品中分别加入工作液200 μL(A液:B液=50:1),均匀混合后37℃孵育30 min,测定A(562)值,绘制标准曲线并计算重组蛋白浓度(mg·L-1)。
1.6 过滤除菌复性后的重组蛋白样品除菌采用0.22 μm微孔滤膜,BCA法测定除菌前后重组蛋白样品中目的蛋白的浓度(mg·L-1),计算回收率,回收率=除菌后目的蛋白浓度(mg·L-1)/除菌前目的蛋白浓度(mg·L-1)×100%。
2 结 果 2.1 重组蛋白的表达含有pet21b/CBD-BMP2载体的阳性克隆大肠杆菌进行小体系(10 mL)培养,以便对其重组蛋白表达能力进行鉴定。经IPTG诱导后出现了明显的重组蛋白表达,相对分子质量为14000,与理论值基本一致。见图 2。

|
| M: Protein marker; Lane 1-2: Total bacterial proteins before and after induction; Lane 3: Supernatant of lysis buffer with 8 mg·L-1 urea; Lane 4: Cell pellet; Lane 5: Flow-through; Lane 6: Purified CBD-BMP2 monomer in elution buffer 2. 图2 重组蛋白诱导表达、包涵体溶解与目的蛋白纯化的SDS-PAGE电泳图 Fig.2 SDS-PAGE electrophoregram of rhCBD-BMP2 expression,inclusion body dissolution and rhCBD-BMP3 purification |
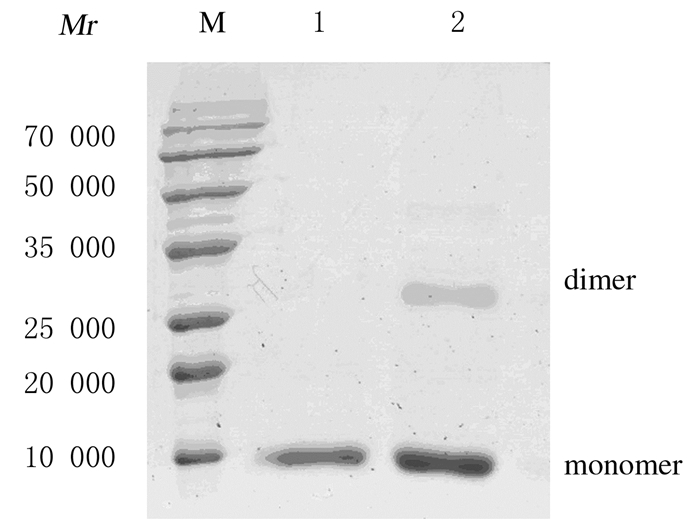
按材料与方法描述的步骤由包涵体中制备CBD-BMP2。细胞破碎后上清液与菌沉比较,重组CBD-BMP2单体溶解于含有 8mol·L-1尿素的裂解液上清中,菌沉中不存在目的蛋白。由于CBD-BMP2单体含有6个His标签,尿素溶解的CBD-BMP2单体使用镍离子亲和层析法进行纯化。通过18%的SDS-PAGE分析,流出液中含有除目的蛋白以外的多种菌体蛋白,纯化后的CBD-BMP2存在于洗脱液B中,并于相对分子质量14 000位置呈现清晰条带,纯化效果良好(图 2)。经复性后CBD-BMP2单体形成二聚体活性结构,通过SDS-PAGE分析可见2条清晰条带,二聚体重组蛋白在相对分子质量28 000处有清晰条带出现。见图 3。
|
| M: Protein marker; Lane 1: Purified CBD-BMP2 monomer; Lane 2: CBD-BMP2 after renaturation. 图3 rhCBD-BMP2复性的SDS-PAGE电泳图 Figure 3 SDS-PAGE electrophoregram of rhCBD-BMP2 renaturation |
经过稀释复性并透析去除变性剂尿素的CBD-BMP2样品经0.22 μm微孔滤膜,并采用BCA检测方法计算除菌前后蛋白浓度,除菌前蛋白浓度为110 mg·L-1,除菌后蛋白浓度为80 mg·L-1。复性后CBD-BMP2经过0.22 μm微孔滤膜后蛋白回收率约为73%。
3 讨 论运用大肠杆菌表达系统可以高效、大量、持续并且低廉地制备重组蛋白,目前使用过程中存在的主要问题是重组蛋白通常以包涵体的形式存在。但利用原核表达系统时,大肠杆菌胞质内呈现高还原性环境,且原核细胞的糖基化功能缺失,分别导致重组蛋白单体内二硫键的不稳定,形成大量的错配;且蛋白形成中间体的过程中由于糖基化功能的缺失而导致的溶解度下降致使包涵体形成且呈现不可溶的状态。重组蛋白以包涵体的形式进行表达也存在某些优点,例如重组蛋白可以高水平表达,并可避免蛋白水解酶对目的蛋白的降解作用,同时对目的蛋白的进一步纯化也相对简单[11]。
BMP2的天然活性结构为同源二聚体,与TGF-β超家族的其他成员类似。其形成二聚体的结构依靠单体中7个半胱氨酸残基中的1个单链间二硫键。同时单体也依靠其余6个半胱氨酸残基形成三对单链内的二硫键[12]。目前已经有许多关于负载有BMP2的胶原结合支架应用的研究[13],同时负载CBD-BMP2的相关研究也证明了含有CBD的BMP2可以在胶原支架上维持更长的时间。胶原支架载有相同剂量的带有CBD的rhBMP2或商品化BMP2,rhCBD-BMP2具有更好的成骨诱导作用[2],或者在更小的剂量即可以达到或者超过商品化蛋白的作用[14]。但其高效的表达以及相对简单的复性一直是rhBMP2研究的难点。高效表达rhBMP2的特点即为形成包涵体,包涵体形成的主要原因为二硫键的错配,运用大肠杆菌表达的CBD-BMP2同样在不加入变性剂尿素的情况下以包涵体形式存在,经过离心,存在于细胞碎片当中,呈现不可溶的状态,对进一步的CBD-BMP2单体纯化过程形成了障碍。且存在于包涵体中的重组蛋白是变性的,所以并不具备天然的生物学功能。需加入适量变性剂使其溶解,经过纯化后在适宜条件下进行复性使其重新折叠,从而使重组蛋白具备天然构象并恢复生物活性[15]。目前较常用的溶解包涵体的变性剂主要为盐酸胍与尿素,作用浓度分别为6与8 mol·L-1。其作用原理为利用分子间的相互作用打断包涵体蛋白分子之间的多种化学键,包括链内的非活性二硫键以及链间的二硫键,从而使多肽链去掉空间结构而伸展。本研究在裂解液中含有8 mol·L-1尿素,SDS-PAGE结果显示:rhCBD-BMP2出现在细胞裂解离心后的上清中,且呈现单体状态,相对分子质量约为14000。与菌沉相比,差异明显,菌沉中可见大量除目的蛋白以外的菌体蛋白,8 mol·L-1尿素对包涵体溶解效果良好。通过对比流出液与洗脱液,洗脱液B中纯化后的rhCBD-BMP2于相对分子质量14000处条带清晰单一,为下一步复性提供了有利条件。
复性的主要原理即去除变性剂,从而使伸展状态的蛋白单体进行重新折叠并通过二硫键的正确配对形成具有生物学活性的空间结构[16]。传统上常用的方法主要有3种,分别为超滤法、透析法与稀释法。其中超滤方法运用适宜相对分子质量的膜可将变性剂滤过,从而减少其在溶液中的浓度,同时保留蛋白成分,不断添加新的复性缓冲液,可以保持蛋白组分的浓度不变,并利用对超滤速度的控制有效实现变性剂浓度降低速率,达到复性的目的。但此方法更加适合工业化的大批量生产,不适合实验室的小体积实验。透析复性则是利用透析袋内外溶液浓度差,从而减少待复性体系中变性剂浓度的方法,但此方法周期较长,且不利于大规模生产制备。相对于其他2种传统方法,稀释复性方法简单,耗时较少,同样适合小体积实验室实施,此方法主要通过缓慢加入复性缓冲液而降低变性剂的浓度。本研究尝试采用稀释复性,选取三蒸水作为稀释缓冲液,在不加入过多促进复性的组分的情况下其环境条件等已较为适合CBD-BMP2的复性,并通过实验证明,低温4℃条件下复性效果良好,SDS-PAGE分析可见复性后溶液中于相对分子质量28000处出现清晰条带,于复性前溶液成分比较差异显著。复性后重组蛋白的二聚体结构约占总蛋白的30%。
类似BMP2结构的其他同源二聚体蛋白还有许多,例如在组织工程以及临床应用中同样被普遍采用的TGF-β超家族的其他成员。随着医学研究的进步以及临床应用的加深,对于功能改进的天然蛋白质的需求将更加具有前景。本研究中提供的方法易于操作,过程简单,为其他纯化后需要重叠复性的功能改进性蛋白的制备提供依据。
| [1] | 齐鹏鹏,吴梓萁,杨涛源,等.骨形态发生蛋白2在牙槽骨改建中作用的研究进展[J].吉林大学学报:医学版,2015,41(3):671-674. |
| [2] | Chen B,Lin A,Zhao Y,et al.Activation of demineralized bone matrix by genetically engineered human bone morphogenetic protein-2 with a collagen binding domain derived from von Willebrand factor propolypeptide[J].JBiomed Mater Res Part A,2007,80(2):428-434. |
| [3] | Kirker-Head C.Potential applications and delivery strategies for bone morphogenetic proteins[J].Adv Drug Delivery Rev,2000,43(1):65-92. |
| [4] | Lee FY,Storer S,Hazan EJ,et al.Repair of bone allograft fracture using bone morphogenetic protein-2[J].Clin Orthop Relat Res,2002,397:119-126. |
| [5] | Balasundaram G,Yao C,Webster TJ.TiO2 nanotubes functionalized with regions of bone morphogenetic protein-2 increases osteoblast adhesion[J].JBiomed Mater ResPart A,2008,84(2):447-453. |
| [6] | 罗云纲,曲露露,李美华.骨形态发生蛋白与血小板衍生性生长因子在骨形成中协同作用的研究进展[J].吉林大学学报:医学版,2013,39(5):1085-1088. |
| [7] | Tada S,Kitajima T,Ito Y.Design and synthesis of binding growth factors[J].Int J Mol Sci,2012,13(5):6053-6072. |
| [8] | Ding D,Wang Z,Xu H,et al.Expression of BMP4 mature peptide in eukaryotic cells and its differentiation-inhibiting effect in culturing induced pluripotent stem cells[J].J South Med Univ,2012,32(10):1383-1388. |
| [9] | 甘强,胡侦明,郝杰,等.真核表达重组骨形态发生蛋白9的纯化及生物骨诱导活性分析[J].生物医学工程学杂志,2013,30(4):822-827. |
| [10] | 张大鹏,郭蔼光.根癌农杆菌介导的人骨形成蛋白3成熟肽基因向油菜转化的研究[J].西北农林科技大学学报:自然科学版,2004,32(5):41-44. |
| [11] | Long S,Truong L,Bennett K,et al.Expression,purification,and renaturation of bone morphogenetic protein-2 from Escherichia coli[J].Protein Exp Purif,2006,46(2):374-378. |
| [12] | 王馥丽,陈苏民,陈南春,等.rhBMP-2m在高浓度条件下的复性[J].第四军医大学学报,2008,29(12):1071-1074. |
| [13] | 孙健,余优成,顾章愉.BMP-2对大鼠骨髓间充质干细胞成骨作用的影响[J].上海口腔医学,2011,20(4):352-357. |
| [14] | Han X,Zhang W,Gu J,et al.Accelerated postero-lateral spinal fusion by collagen scaffolds modified with engineered collagen-binding human bone morphogenetic protein-2 in rats[J].PLoS ONE,2014,9(5):1-8. |
| [15] | 包义风.包涵体蛋白复性技术研究进展[J].微生物学免疫学进展,2012,40(2):84-88. |
| [16] | 于文国,陶秀娥.包涵体蛋白复性及其影响因素[J].河北工业科技,2007,24(5):314-316. |
| [17] | 何苗,张国利,陈萍,等.HSP65-PEAI融合蛋白表达纯化及免疫效果研究[J].中国实验诊断学,2015,19(5):700-704. |
 2016, Vol. 42
2016, Vol. 42


