扩展功能
文章信息
- 尤丽丽, 曹东慧, 姜晶, 刘入铭, 马麟, 王世栋, 索岳尔, 侯振, 曹雪源
- YOU Lili, CAO Donghui, JIANG Jing, LIU Ruming, MA Lin, WANG Shidong, SUO Yueer, HOU Zhen, CAO Xueyuan
- 18β-甘草次酸对K19-C2mE转基因鼠胃肿瘤的抑制作用及其机制
- Inhibitory effect of 18β-glycyrrhetinic acid on gastric tumor in K19-C2mE transgenic mice and its mechanisms
- 吉林大学学报(医学版), 2016, 42(02): 221-225
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 221-225
- 10.13481/j.1671-587x.20160206
-
文章历史
- 收稿日期: 2015-08-06
- 网络出版时间: 2016-03-08 12:52:13
2. 吉林大学第一医院胃结直肠外科, 吉林长春 130021
2. Department of Gastric and Colorectal Surgery, First Hospital, Jilin University, Changchun 130021, China
胃癌(gastric cancer,GC)是严重影响人类生存的恶性肿瘤,全球范围内胃癌的发病率和死亡率在所有恶性肿瘤中分别排第5位和第3位[1]。中国恶性肿瘤调查数据显示:2011年约有胃癌新发病例数40万,发病率为31.2/10万,死亡人数约为30万,死亡率为22.08/10万,胃癌所致发病率和死亡率在所有恶性肿瘤中所占比例均为第3位[2]。胃部慢性炎症是导致部分胃癌发生发展的主要环节[3]。环氧化酶2(cyclooxygenase-2,COX-2)和微粒体前列腺素合成酶1(microsomal prostaglandin E2 synthase-1,mPGES-1)是胃癌发生的重要炎症因子[4]。Oshima等[5]构建的K19-C2mE转基因鼠胃黏膜内同时高水平表达COX-2和mPGES-1,是研究由炎症因子引发胃部肿瘤的理想动物模型。COX-2在多种肿瘤中过表达,参与细胞恶性转化、抑制细胞凋亡以及促进肿瘤细胞侵袭转移等[6],COX-2与大肠癌发生有密切关联[7]。白细胞介素1β(interleukin-1β,IL-1β)主要由活化的巨噬细胞和淋巴细胞合成并分泌,是促进炎症反应的细胞因子,在慢性炎症及肿瘤发展中有重要作用,在人类卵巢癌等肿瘤组织中均有表达,参与肿瘤的形成、侵袭以及转移等[8],IL-1β受体拮抗因子能够抑制结肠癌的发生发展[9]。
18β-甘草次酸(18β-glycyrrhetinic acid,18β-GA)是天然植物甘草的主要活性成分,通过抑制炎症因子从而起到抗炎及抗肿瘤作用使其成为研究的热点[10, 11, 12]。 目前关于18β-GA抗肿瘤作用的研究多以体外实验为主,对生物体内肿瘤的抑制作用少有报道。本实验利用K19-C2mE自发胃癌转基因小鼠模型,对实验小鼠进行18β-GA饮水投药,生长至52周龄时解剖观察18β-GA对转基因小鼠胃肿瘤发展、大小和形态的影响,检测肿瘤组织相关炎症因子表达水平,首次通过体内实验研究18β-GA抑制炎症反应及肿瘤形成的作用,探讨18β-GA对胃肿瘤发展的抑制作用及可能机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器K19-C2mE转基因种鼠(动物合格证号:862167687311,购自日本熊本大学实验动物中心,在吉林大学公共卫生学院动物实验室繁殖饲育),C57BL/6N小鼠(动物合格证号:11400700085559,购自维通利华实验动物技术有限公司)。实验药物18β-GA(SIGM-ALDRICH公司,西班牙),纯度为97%,化学分子式C30H46O4;Axygen DNA提取试剂盒(Axygen Scientific公司,美国);中性甲醛、二甲苯和无水乙醇(北京化工厂);中性树脂(中国上海标本模型厂);PBS和DAB显色试剂盒(3,3’ -diaminobenzidine Detection Kit)、COX-2和IL-1β单克隆抗体、快捷型酶标兔抗羊IgG聚合物(150107402A)均由上海迈新生物技术开发有限公司提供。电子显微镜(Olympus公司,日本),精密恒温培养箱(上海一恒科学仪器有限公司)。
1.2 实验动物分组及处理将K19-C2mE转基因鼠与野生型C57BL/6N小鼠交配,获得子代小鼠。3周龄时剪取鼠尾,提取组织DNA行基因鉴定。将80只K19-C2mE转基因鼠随机分为18β-GA实验组(n=34)与对照组(n=36),另外取5只未转基因小鼠作为野生对照。实验组小鼠6周龄时给予质量浓度0.1%18β-GA水溶液作为饮水,对照组小鼠正常饮水,所有小鼠饲养条件如温度、光照及饲料等均保持一致。实验组与对照组小鼠6周龄起称量体质量,并且在饲养全程每5周进行体质量秤量并记录,绘制体质量变化曲线。小鼠生长至52周时麻醉解剖,观察小鼠胃肿瘤大小、黏膜形态,获取胃部肿瘤组织、癌旁以及胃部正常组织。计算实验组和对照组小鼠肿瘤发生率。
1.3 HE染色与免疫组织化学染色胃组织石蜡包埋切片,进行常规苏木精-伊红(HE)染色,镜下观察组织形态。免疫组织化学染色:石蜡切片经二甲苯脱蜡,梯度酒精水化;PBS洗5min 3次,3%H2O2室温孵育10min;PBS水洗5min 3次,柠檬酸溶液加热煮沸2min修复;PBS洗5min 3次,切片组织滴加一抗,37℃孵育2h;PBS洗5min 3次,滴加二抗,37℃孵育30min;PBS洗5min 3次,滴加DAB混合溶液,1.5min 后PBS冲洗终止显色;流水冲洗,苏木精复染梯度酒精脱水,二甲苯透明,中性树脂封片。COX-2和IL-1β免疫组织化学染色,所用抗体滴度为1:100,H-score评分对二者的染色程度进行半定量分析。评分标准:0+,未染色;1+,轻度染色呈浅黄色;2+,染色偏深呈浅棕色;3+,深度染色呈棕色。计算H-score 评分:放大400倍视野计算各染色程度所占面积的百分比与其染色程度的乘积,相加后即为H-score评分。
1.4 统计学分析采用SPSS18.0软件对数据进行统计学分析。对照组与实验组小鼠肿瘤发生率比较采用2×2四格表χ2检验。COX-2及IL-1β免疫组织化学H-score评分以x±s表示,组间比较采用两独立样本t检验。
2 结 果 2.1 小鼠体质量变化及体质量曲线实验组小鼠6周平均体质量为(15.0±3.5)g,实验组小鼠45~52周平均体质量为(25.0±7.2)g,将实验组小鼠体质量变化与对照组小鼠体质量变化进行两独立样本t检验,差异无统计学意义(P=0.95)。实验组与对照组小鼠平均体质量随周龄变化趋势见图 1。

|
| 图1 K19-C2mE转基因鼠平均体质量变化 Fig.1 Changes of average weights of K19-C2mE transgenic mice |
小鼠解剖后肿瘤发生情况:对照组小鼠胃肿瘤发生率为77.8%(28/36),实验组小鼠胃肿瘤发生率为41.2%(14/34),18β-GA能够显著降低胃肿瘤的发生率(P=0.002)。
2.3 胃黏膜形态学改变及胃肿瘤实验小鼠处死后肉眼观察小鼠胃组织:野生小鼠胃黏膜表面光滑,无明显炎症反应及肿瘤组织;对照组小鼠胃黏膜可观察到大范围不均匀充血,黏膜表面有溃疡和糜烂并伴有较大肿块突出;而实验组小鼠胃组织表面可观察到炎症反应,同时伴有肿物突起,但较对照组的反应较轻。见图 2(插页二)。
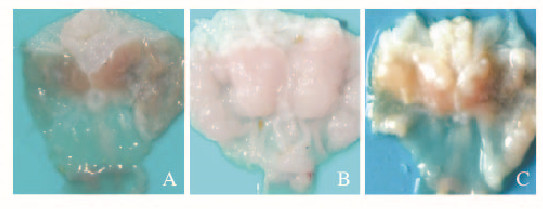
|
| A: Wild group; B: Control group; C: 18β-GA group. 图2 各组小鼠胃组织形态学变化 Fig.2 Morphological changes of stomach tissue of mice invarious groups |
HE染色观察,野生型小鼠正常胃组织细胞排列规整,可观察到清晰的正常细胞形态和组织结构,组织未见炎症浸润;对照组小鼠胃组织HE染色可见明显的炎症浸润,正常胃组织几乎不可见,异型性细胞大量存在;实验组K19-C2mE转基因小鼠胃组织可观察到部分细胞排列紊乱和组织结构异常,但炎症反应较轻、细胞及组织结构异型性相对于对照组小鼠反应减弱。见图 3(插页二)。

|
| A:Wild mouse group; B:Control group; C: 18β-GA treated group. 图3 各组小鼠胃组织HE染色结果(×20) Fig.3 HE staining results of stomach tissue of mice in various groups ( × 20) |
COX-2和IL-1β均以胞浆染色和部分细胞核染色为主。镜下观察COX-2和IL-1β免疫组织化学结果:对照组小鼠胃组织着色明显、染色强度高;实验组染色强度及阳性百分比与对照组比较明显减弱。 将K19-C2mE转基因鼠胃组织免疫组织化学染色结果进行H-score评分, 实验组与对照组COX-2和IL-1β表达水平比较差异有统计学意义(P<0.001)。见图 4(插页二)和表 1。
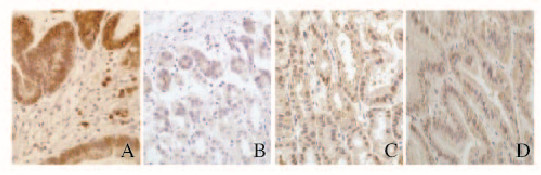
|
| A, C: Control group; B, D: Experimental group; A, B: COX-2; C, D: IL-lβ. 图4 实验组和对照组小鼠胃黏膜组织中COX-2及IL-ip表达(免疫组织化学,×40) Fig.4 Expressions of COX-2 and IL-ip in gastric mucosatissue of mice in experimental group and control group (Immunohistochemistry ,×40) |
| (×40) | |||
| Group | n | H-score grading | |
| COX-2 | IL-1β | ||
| *P<0.001 compared with control group. | |||
| Control | 36 | 180.56±27.35 | 178.33±23.10 |
| Experimental | 34 | 118.21±34.99* | 108.46±30.80* |
胃癌的发病率及死亡率居高不下,严重威胁人类健康,目前对胃癌的治疗尚无安全有效的药物。研究[12]表明:胃癌的发生发展与胃部的炎症反应有密切关联。幽门螺杆菌是胃黏膜病变引发胃炎的一种重要致病因子,近年来研究[13]显示:幽门螺杆菌的感染与胃癌的发生有密切关联,进一步说明胃炎的发生发展是胃癌发病的重要微环境。近年来天然活性物质抑制慢性活动性胃炎和胃癌发病的研究日益受到重视,甘草次酸及其衍生物的抗炎和抗肿瘤作用及其机制研究已成为研究热点之一[14]。
文献[15]报道:18β-GA抗炎作用具体的作用机制可能与18β-GA在体内的糖皮质激素样作用以及抑制花生四烯酸释放等有关。本研究结果显示:对照组小鼠胃黏膜可见溃疡和糜烂,18β-GA处理后小鼠胃黏膜反应较轻,黏膜溃疡及糜烂少见,表明18β-GA能够显著降低炎症因子COX-2及IL-1β的表达水平,提示18β-GA 能够通过抑制炎症因子表达水平,减轻胃黏膜炎症反应和慢性损伤。
Wang等[11]研究证实:18β-GA能够抑制乳腺癌的侵袭和转移;Shetty等[10]证实:18β-GA能够有效抑制前列腺癌细胞的增殖,王银环等[16]证明18β-GA对人胃癌细胞BGC-823的增殖有抑制作用;葛艳等[17]证实18β-GA能够抑制结肠癌细胞HT29的增殖。既往的研究[10, 11, 12, 18, 19, 20]证明:18β-GA抗肿瘤作用主要体现在诱导肿瘤细胞凋亡、阻遏细胞周期以及抑制肿瘤细胞增殖等,但上述研究均局限于体外实验。本研究采用K19-C2mE转基因小鼠模型,在体内实验中观察到18β-GA对胃肿瘤发生具有显著的抑制作用。关于18β-GA抑制胃肿瘤的作用机制,本文作者推测18β-GA 能够显著抑制COX-2和IL-1β等炎症因子表达水平,减轻胃黏膜慢性活动性炎症反应,减少溃疡和糜烂的反复发生,最终达到抑制胃肿瘤的目的。当然,除此以外,18β-GA可能存在直接的肿瘤杀伤作用或者其他的信号通路抑制胃肿瘤发生,其作用机制有待进一步研究。
现代药理及临床研究[20]已经证实:18β-GA有助于增强机体免疫力和提高生理机能,并且用药安全范围广。本研究中有关18β-GA的剂量选择本文作者考虑到小鼠经胃肠道给药时会有部分药效降解,在细胞给药剂量的基础上适当增加了给药量,并且在进行长期实验前,结合文献[16]应用质量浓度0.1%18β-GA进行了短期预实验,最终确定用药剂量。通过目前实验观察,效应剂量未引起严重不良反应。本研究结果显示:与对照组比较,实验组小鼠的体质量曲线无明显变化。关于18β-GA的毒理作用,文献[20, 21, 22, 23, 24, 25]报道:18β-GA在高浓度(100 mg·L-1)具有细胞毒性,抑制细胞蛋白合成;长期大剂量摄入18β-GA可引起类醛固酮增多症,表现为高血压、低钾血症以及钠潴留等。
综上所述,本研究初步证明18β-GA能够显著降低胃癌的发生率,减轻胃黏膜炎症反应,降低胃黏膜细胞内COX-2及IL-1β表达水平从而对胃肿瘤的发展产生抑制作用。目前为止,18β-GA的胃癌预防研究较少,其防癌机制有待深入探索。
| [1] | Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CACancerJ Clin,2015,65(2):87-108. |
| [2] | 陈万青,郑荣寿,曾红梅,等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,24(1):1-10. |
| [3] | Oshima H,Oshima M.The inflammatory network in the gastrointestinal tumor microenvironment:lessons from mouse models[J].J Gastroenterol,2012,47(2):97-106. |
| [4] | Oshima H,Oshima M.The role of PGE2-associated inflammatory responses in gastric cancer development[J].Semin Immunopathol,2013,35(2):139-150. |
| [5] | Oshima H,Matsunaga A,Fujimura T,et al.Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway[J].Gastroenterology,2006,131(4):1086-1095. |
| [6] | Takeda H,Sonoshita M,Oshima H,et al.Cooperation of cyclooxygenase 1 and cyclooxygenase 2 in intestinal polyposis[J].Cancer Res,2003,63(16):4872-4877. |
| [7] | 徐颖.15-PGDH、COX-2及β-catenin与大肠癌发生发展的关系[D].遵义:遵义医学院,2014. |
| [8] | Lee CH,Chang JS,Syu SH,et al.IL-1β promotes malignant transformation and tumor aggressiveness in oral cancer[J].J Cell Physiol,2015,230(4):875-884. |
| [9] | 马家驰,陈泉,詹渭鹏,等.白细胞介素1受体拮抗因子通过抑制肝细胞生长因子的分泌影响结肠癌的新生血管形成[J].中华普通外科杂志,2015,30(6):471-475. |
| [10] | Shetty AV,Thirugnanam S,Dakshinamoorthy G,et al.18α-glycyrrhetinic acid targets prostate cancer cells by down-regulating inflammation-related genes[J].Int J Oncol,2011,39(3):635-640. |
| [11] | Wang XF,Zhou QM,Lu YY,et al.Glycyrrhetinic acid potently suppresses breast cancer invasion and metastasis by impairing the p38 MAPK-AP1 signaling axis[J].Expert Opin Ther Targets,2015,19(5):577-587. |
| [12] | Oshima M,Oshima H,Matsunaga A,et al.Hyperplastic gastric tumors with spasmolytic polypeptide-expressing metaplasia caused by tumor necrosis factor-alpha-dependent inflammation in cyclooxygenase-2/microsomal prostaglandin E synthase-1 transgenic mice[J].Cancer Res,2005,65(20):9147-9151. |
| [13] | Sticlaru L,Bastian A,Micu G,et al.Functional and morphological alterations induced by Helicobacter pylori infection in gastric nerve supply[J].Romanian JInter Med,2014,52(3):192-197. |
| [14] | 金敏,吴红金.甘草次酸药理作用的研究进展[J].医学综述,2009,15(11):1712-1715. |
| [15] | 谢松梅.甘草次酸衍生物的制备及作为选择素配体拮抗剂的抗炎活性研究[D].济南:山东大学,2007. |
| [16] | 王银环,范钰,张尤历,等.18β-甘草次酸对人胃癌细胞BGC823增殖的抑制[J].江苏大学学报:医学版,2007,17(3):251-253. |
| [17] | 葛艳,范钰,李仪奎.18β-甘草次酸抑制人结肠癌HT29细胞增殖的研究[J].时珍国医国药,2008,19(1):143-144. |
| [18] | Lee CS,Kim YJ,Lee MS,et al.18beta-Glycyrrhetinic acid induces apoptotic cell death in SiHa cells and exhibits a synergistic effect against antibiotic anti-cancer drug toxicity[J].Life Sci,2008,83(13/14):481-489. |
| [19] | Jayasooriya RG,Dilshara MG,Park SR,et al.18β-Glycyrrhetinic acid suppresses TNF-α induced matrix metalloproteinase-9 and vascular endothelial growth factor by suppressing the Akt-dependent NF-κβ pathway[J].Toxicol In Vitro:An Inter J Published Assoc BIBRA,2014,28(5):751-758. |
| [20] | 雍建平,张毓洪,赵巍,等.甘草次酸及甘草次酸衍生物药理活性研究进展[J].时珍国医国药,2010,21(12):3335-3337. |
| [21] | Cao D,Jiang J,Tsukamoto T,et al.Canolol inhibits gastric tumors initiation and progression through COX-2/PGE2 pathway in K19-C2mE transgenic mice[J].PLoS One,2015,10(3):e0120938. |
| [22] | 刘然.甘草及甘草酸制剂引起的假性醛固酮增多症及防治[J].药物不良反应杂志,2009,11(6):416-419. |
| [23] | 王海波,刘海春,王振清.复方甘草酸苷联合西药治疗慢性布氏杆菌病[J].吉林中医药,2015,35(2):164-166. |
| [24] | 阚俊明,雷岱虹,宗颖,等.多指标综合评分法优选甘草抗氧化活性成分闪式提取工艺[J].长春中医药大学学报,2015,31(3):475-477. |
| [25] | 姬会春,刘庆德,王洪旗,等.葛根素联合复方甘草酸单铵S治疗酒精性肝炎的疗效探讨[J].临床肝胆病杂志,2014,30(10):1067-1070. |
 2016, Vol. 42
2016, Vol. 42


