扩展功能
文章信息
- 孟峻, 侯艳军, 张永梅, 呼格吉乐, 韩艳秋
- MENG Jun, HOU Yanjun, ZHANG Yongmei, HU Gejile, HAN Yanqiu
- 14-3-3ε和Cdc25B在小鼠卵母细胞生发泡期阻滞中的作用
- Role of 14-3-3εand Cdc25B in GV-stage arrest of mouse oocytes
- 吉林大学学报(医学版), 2016, 42(02): 215-220
- Journal of Jilin University (Medicine Edition), 2016, 42(02): 215-220
- 10.13481/j.1671-587x.20160205
-
文章历史
- 收稿日期: 2015-07-10
细胞分裂周期25B(Cdc25B)在小鼠卵母细胞由前期Ⅰ向中期Ⅰ过度中起着启动者的作用[1]。14-3-3蛋白是一个非常保守的酸性调节蛋白家族[2],从酵母到哺乳动物的所有真核细胞中均表达14-3-3蛋白。 14-3-3蛋白对细胞周期的调控作用是目前的研究热点,例如,14-3-3蛋白在体细胞中控制Cdc25B的细胞定位[3]。 近年来,有关14-3-3蛋白通过Cdc25B磷酸酶调控细胞周期进程的报道[4, 5]日益增多。但是在小鼠卵母细胞中14-3-3蛋白是否通过Cdc25B磷酸酶调控小鼠卵母细胞停滞于生发泡(germinal vesicle,GV)期目前国内外未见报道。本研究将构建的14-3-3ε和Cdc25B(包括突变体)的质粒在体外转录成mRNA,显微共注射到GV期小鼠卵母细胞中,探讨14-3-3ε和Cdc25B对小鼠GV期卵母细胞减数分裂的影响,为揭示小鼠卵母细胞发育的分子机制提供实验依据。
1 材料与方法 1.1 表达载体、主要试剂和仪器表达载体pcDNA3.1-ZEO-HA-14-3-3ε、pcDNA3.1-MYC-Cdc25B-WT、pcDNA3.1-MYC-Cdc25B-S321A和pcDNA3.1-MYC-Cdc25B- S321D由本实验室构建并保存。mMESSAGE mMACHINE T7 Ultra kit 体外转录试剂盒(Ambion 公司,美国),CDC2-pTyr15 抗体、CDC25B 一抗(E-19)、β-actin抗体 (Santa Cruz 公司,美国),HRP 标记的兔抗山羊IgG 、HRP 标记的山羊抗兔IgG (北京中杉金桥生物技术有限公司),ECL化学发光试剂盒(Piece Biotechnology 公司,美国),预染蛋白Marker(MBI 公司,美国),M2培养液(Sigma公司,美国),二丁酰环一磷酸腺苷(dbcAMP)(Sigma公司,美国),Waymouth MB752/1培养液(Invitrogen)和[γ-32P]三磷酸腺苷(北京福瑞公司),其余试剂(Sigma 公司,美国)。低温超速离心机(Sigma公司,美国),台式高速离心机(TGL-16B,上海安亭科学仪器厂),凝胶自动成像仪GDS8000(BIO-RAD公司,美国),紫外分光光度仪(Phannacia公司,美国),细菌培养箱、空气浴振荡器(哈尔滨东明医疗仪器厂),实体显微镜SZ12型(Olympus公司,日本),相差显微镜OPTIPHOT/DIC型(Nikon公司,日本),显微操作系统(Eppendorf Tramferman,英国),日本Ⅸ-70倒置显微镜,CO2培养箱CBll5(WTB-binder,德国),BECKMAN液闪计数仪(德国)。
1.2 小鼠卵母细胞的采集和培养3~4周龄昆明种雌性白鼠,腹腔注射10IU孕马血清(PMSG),自由采食与饮水,48h后颈椎脱臼法处死,剖开腹腔取出卵巢,放于含有125μmol·L-1 二丁酰环一磷酸腺苷(bucladesine,dbcAMP)的M2培养液中,在体视显微镜下用1mL注射器针头剔除卵巢周围脂肪及结缔组织,刺破大的有腔卵泡,轻压后释放出卵丘卵母细胞复合物(cumulus-oocyte complex,CEOs)及天然裸卵母细胞,用口径略大于卵母细胞直径的捡卵管反复吹打去除附着的颗粒细胞,获得含完整GV的裸卵母细胞,在M2培养液中洗3次,分为非dbcAMP处理组和dbcAMP处理组,前者卵母细胞在接受不同注射后,在MB培养液(在Waymouth MB752/1培养液的基础上添加100 mg·L-1丙酮酸钠、0.05 U·L-1青霉素和50 mg·L-1链霉素,3 g·L-1BSA,此培养液简称为MB培养液)中洗3次后转入12孔培养板,每孔加入200μL预先在培养箱中平衡2h的MB培养液,上覆矿物油,放入接受相同注射的卵母细胞,在37℃、5%CO2、饱和湿度的CO2培养箱内培养。dbcAMP处理组卵母细胞接受注射后,转移到添加200μmol·L-1 dbcAMP的MB培养液中,培养条件同上。
1.3 mRNA制备①模板制备: 分别取1μg pcDNA3.1-ZEO-HA-14-3-3ε、pcDNA3.1-Myc- Cdc25B-WT、 pcDNA3.1-Myc-Cdc25B-S321A和 pcDNA3.1-Myc- Cdc25B-S321D,经XbaⅠ酶切线性化后用于体外转录。酶切反应体系为20μL (质粒1μg,10×Y+/Tanqo(with BSA) 2μL,XbaⅠ 10U,补水至20μL。37℃酶切3 h,65℃灭活20 min。然后去RNA酶和转录抑制剂,加入SDS及蛋白酶K,50℃反应30 min,酚:氯仿抽提,12000 r·min-1离心2 min,转移上层水相至1个新试管中,以3mol·L-1醋酸钠(pH5.2)及无水乙醇沉淀,12000 r·min-1离心10min,弃上清,加入不含RNA酶的去离子水溶解,作为体外转录的模板。②体外转录:应用体外转录试剂盒(mMESSAGE mMACHINE T7 Ultra kit)将制备好的线性模板体外转录成带帽mRNA。37℃反应1h,然后用2U TURBO DNase于37℃反应15min消化DNA模板。37℃反应40min后,置于冰上加Poly(A)尾。③RNA纯化:用酚、氯仿抽提纯化mRNA,最后加入氯化锂沉淀mRNA,12000 r·min-1在4℃离心15 min,弃上清,70%乙醇洗涤后溶解于无核酸酶污染的5 mmol· L-1Tris和0.5 mmol·L-1乙二胺四乙酸(EDTA,pH7.4)中,用于显微注射。通过测定mRNA在260nm的吸光度(A)来定量mRNA。
1.4 mRNA显微注射显微注射应用倒置显微镜显微操作系统。将GV期卵母细胞移入到含有125 μmol·L-1 dbcAMP的 M2液滴中,用持卵针将卵母细胞固定,将注射针吸好一定量的 mRNA刺入细胞将样品注入胞浆,为尽量减少显微注射对卵母细胞的影响,一般注入到卵母细胞内的样品体积为10 pL (相当于其总体积的5%)。对照组为注射TE缓冲液组。注射后放入含有200 μmol·L-1 dbcAMP 的MB培养基,在37℃、5%CO2、饱和湿度的CO2培养箱内培养。实验组分为未注射组、TE缓冲液注射组、14-3-3εmRNA单独注射组、14-3-3εmRNA+Cdc25B(野生型)mRNA共注射组、14-3-3εmRNA+Cdc25B-S321D(模拟磷酸化型) mRNA共注射组。
1.5 显微镜下观察生发泡破裂(germinal vesicle breakdown,GVBD)率并照相 mRNA注射组和对照组细胞在MB培养液中培养,注射后在指定的时间点使用解剖显微镜来观察GVBD率,并使用相差显微镜观察卵的形态学。实验重复3~4次。
1.6 Western blotting法检测蛋白表达收集小鼠各注射组卵母细胞各200个,转移到1.5 mL Eppendof管中,4℃、3000 r·min-1离心10 min,尽量去除培养液,加入适量RIPA裂解缓冲液,充分振荡混匀,然后经3~4次冻融循环,迫使卵母细胞裂解,置于-20℃备用。电泳前,加入SDS样品缓冲液,100℃煮沸5 min,离心后上样,12%SDS-PAGE电泳分离,然后将蛋白转至硝酸纤维素膜上,用含5%脱脂奶粉的TBST(pH7.4)将硝酸纤维素膜于室温摇动温育1h进行封闭,封闭后的硝酸纤维素膜再与HA抗体(稀释比为1:800)或MYC抗体(稀释比为1:1000)4℃温育过夜。经TBST洗涤后,辣根过氧化物酶偶联的IgG作为二抗(稀释比为1:5000)室温温育2h,洗膜后,使用ECL发光法显色。
1.7 成熟促进因子(matuation-promoting factor,MPF)活性的测定根据实验需要收集不同时期MB培养液中的小鼠卵母细胞各5个,转移到含有5 μL收集液的Eppendorf管中,随后立即置-70℃速冻保存直至检测活性前。收集液成分为含有1 mg·L-1聚乙烯醇、5 mmol·L-1 EDTA、10 mmol·L-1Na3VO4和10 mmol·L-1 NaF的磷酸盐缓冲液(pH7.4)。将收集的卵母细胞反复冻融3 次,使细胞裂解,加入MPF 反应液25μL,置30℃水浴反应7 min。取25μL点在Whatman P81 强阳离子交换滤纸(1cm×2cm)上,以75 mmol·L-1 磷酸溶液反复洗3次终止反应,最后将滤纸置于含10 mL 蒸馏水的液闪瓶内,用Beckman 液闪计数仪测定cpm 值。实验重复3~4次。
1.8 统计学分析采用SPSS 13.0软件进行统计分析。小鼠卵母细胞GVBD率、MPF活性、第2次减数分裂中期(MII)和卵母细胞死亡率以 x±s 表示,2组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 各注射组小鼠卵母细胞GVBD率注射后,卵母细胞转移到含有200 μmol·L-1 dbcAMP MB培养基培养。1h后观察。未注射组、TE缓冲液注射组、14-3-3ε mRNA单独注射组、14-3-3ε mRNA+Cdc25B-WTmRNA共注射组和14-3-3ε mRNA +Cdc25B-S321D mRNA共注射组在20h后均未发生GVBD,注射组与对照组比较差异无统计学意义(P>0.05)。14-3-3ε mRNA+Cdc25B-S321A mRNA共注射组在注射后1、2和3h的GVBD 率分别为(5.00±0.68)%、(62.00± 3.56)%和(100.00±0.00)%,在注射20h后有(79.00±2.80)%的卵母细胞到达MII,与未注射组比较差异有统计学意义 (P<0.01)。 见表 1。
| (n=3,x±s,η/%) | |||||
| Group | GVBD rate | MII | Death rate | ||
| ( t/h) 1 | 2 | 3 | 20 | 20 | |
| *P<0.01 vs no injection group. | |||||
| No injection | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 |
| TE buffer microinjection | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 |
| 14-3-3εmRNA | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 |
| 14-3-3ε mRNA+ Cdc25B(WT)mRNA injection | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 |
| 14-3-3ε mRNA+ Cdc25B-S321D mRNA injection | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 |
| 14-3-3ε mRNA+ Cdc25B-S321AmRNA injection | 5.00±0.68 * | 62.00±3.56 * | 100.00±0.00 * | 79.00±2.80 * | 0.05 * |
各注射组在注射后,每间隔1 h取一定数量卵母细胞检测MPF活性。未注射组、TE缓冲液注射组、14-3-3ε mRNA单独注射组、14-3-3ε mRNA+Cdc25B-WT mRNA共注射组和14-3-3ε mRNA +Cdc25B-S321D mRNA共注射组MPF活性在20 h内一直处于较低水平;而HA-14-3-3ε mRNA+Cdc25B-S321A mRNA共注射组MPF活性在20 h内呈现周期性变化,在GV期很低,然后逐渐升高,在第1次减数分裂中期(MI)达到第1次峰值,随后迅速降入低谷,到MII又达到第2个峰值,并在此维持数小时,MPF活性与其他注射组比较差异有统计学意义(P<0.01)。见图 1。
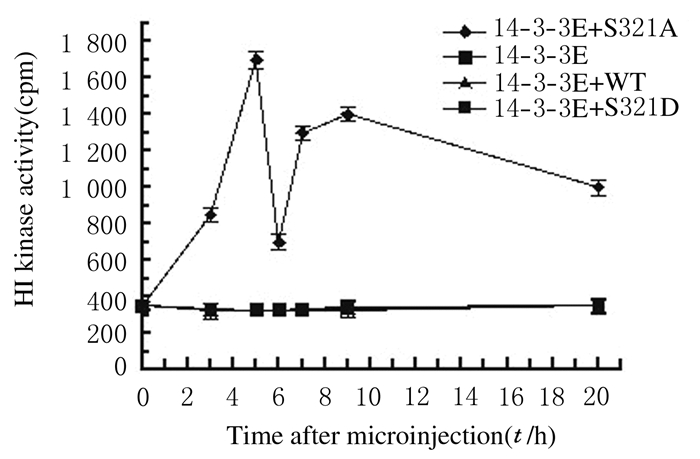
|
| 图1 显微注射后不同时间各组H1激酶活性 Fig.1 H1 kinase activities in various groupsat different time after microinjection |
TE缓冲液注射组、14-3-3ε mRNA单独注射组、14-3-3ε mRNA+Cdc25B-WT mRNA共注射组和14-3-3ε mRNA+Cdc25B-S321D mRNA共注射组Cdc2-Tyr15处于磷酸化状态,而14-3-3ε mRNA+Cdc25B-S321A mRNA共注射组注射后3 h只检测到微弱的磷酸化的Cdc2-Tyr15。见图 2。
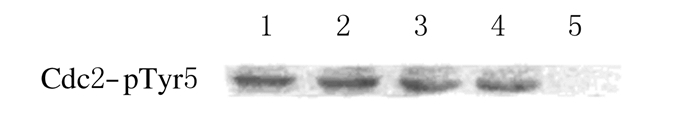
|
| 图2 各注射组在注射3 h后卵母细胞Cdc2-Tyr15磷酸化状态电泳图 Fig.2 Electrophoregram of phosphorylation status of Cdc2-Tyr15 in mouse oocytes in various groups 3 h after injectoin in various groups |
在MB培养液含200 μmol·L-1 dbcAMP持续激活蛋白激酶A(protein kinase A,PKA)的条件下,卵母细胞显微注射Cdc25B各种mRNA 3 h后,与TE注射组比较,各Cdc25B mRNA注射组Cdc25B蛋白呈现高水平表达(图 3),表明显微注射的各种Cdc25B mRNA均能在小鼠卵母细胞内被有效翻译成Cdc25B蛋白。
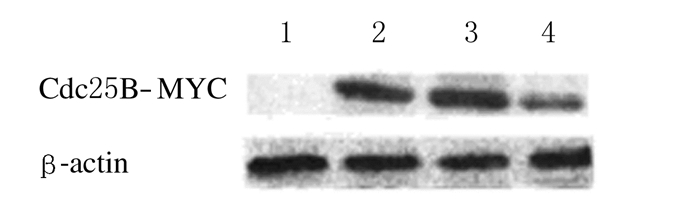
|
| 图3 显微注射mRNA 3 h后各组Cdc25B蛋白表达电泳图 Fig.3 Electrophoregram of expressions of Cdc25B protein 3 h after microinjection of Cdc25B mRNAs in various groups |
在MB培养液含200 μmol·L-1 dbcAMP持续激活PKA的条件下,卵母细胞显微注射14-3-3ε mRNA 3 h后,与TE注射组比较,14-3-3ε蛋白呈现高水平表达(图 4),表明各组显微注射的14-3-3ε mRNA均能在小鼠卵母细胞内被有效翻译成HA-14-3-3ε蛋白。
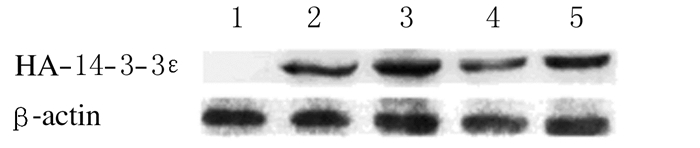
|
| 图4 显微注射HA-14-3-3ε mRNA 3h后各组HA-14-3-3ε蛋白表达电泳图 Fig.4 Electrophoregram of expressions of HA-14-3-3ε protein 3h after microinjection of HA-14-3-3ε mRNAs in various groups |
对爪蟾卵母细胞的研究[6, 7, 8]表明:在GV期阻滞的卵母细胞中,减数分裂的启动子MPF的催化亚基Cdc2-Thr14/Tyr15被磷酸化,MPF活性受到抑制,PKA可直接磷酸化Cdc25C的287位丝氨酸,此位点磷酸化后导致14-3-3蛋白的结合,Cdc25C被隔离于细胞质活性受抑,不能进入核内使Cdc2的Thr14/Tyr15脱磷酸,因而不能激活MPF,卵母细胞发生GV期阻滞。小鼠卵母细胞的研究[9, 10, 11, 12, 13]证实:PKA 通过Cdc25B 的321 位丝氨酸磷酸化修饰引起GV 期阻滞,PKA/Cdc25B 通路在小鼠卵母细胞减数分裂中发挥重要作用,Cdc25B 能促进减数分裂的重新启动,其突变体(S321A)能完全解除PKA 引起的GV 期阻滞,而突变体(S149A)却不能解除GV 期阻滞。但是在小鼠卵母细胞发育过程中14-3-3是否参与了Cdc25B对小鼠卵母细胞GV期阻滞未见报道。 Uchida等[14]的实验结果显示:在HEK293细胞中14-3-3ε能与Cdc25B的309位丝氨酸结合并且控制Cdc25B的细胞质定位。本研究构建了pcDNA3.1-ZEO-HA-14-3-3ε真核表达载体,在体外转录成mRNA,通过显微注射于GV期小鼠卵母细胞,以期观测14-3-3ε和Cdc25B(野生型、突变性)的过表达对GV期卵母细胞及Cdc2-Tyr15磷酸化状态的影响。本研究结果表明:单独过表达14-3-3ε对GVBD率无影响,同时共表达14-3-3ε和Cdc25B(野生型)、14-3-3ε和Cdc25B-S321D(模拟磷酸化)同样不能提高GVBD率,而共注射14-3-3ε和Cdc25B-S321A却能提高小鼠卵母细胞的GVBD率,MPF活性呈现周期性变化,表明Cdc25B-S321A能更有力地诱导卵母细胞减数分裂的恢复。同时又检测了各注射组Cdc2-Tyr15磷酸化状态,其他注射组Cdc2-Tyr15是磷酸化的,只有14-3-3ε mRNA+Cdc25B-S321A mRNA共注射组检测到微弱的磷酸化信号,说明MPF被激活。结合以前的研究发现:在小鼠GV期卵母细胞中,Cdc25B-S321是磷酸化的,在GVBD后是脱磷酸化的,通过本研究进一步证明本文作者的假设: 在小鼠卵母细胞中,PKA使Cdc25B-S321磷酸化,磷酸化的321位丝氨酸与14-3-3ε结合,卵母细胞停滞于GV期,在某种磷酸酶的作用下,Cdc25B-S321脱磷酸而不能与14-3-3ε结合,Cdc25B入核激活MPF,小鼠卵母细胞恢复减数分裂。
综上所述,本研究初步证明了小鼠卵母细胞中14-3-3ε是通过Cdc25B的321位丝氨酸实现对卵母细胞发育的调控作用。最近本课题组[15]通过质谱分析证实PKA在体外能磷酸化小鼠Cdc25B的321位丝氨酸,即Cdc25B是PKA的直接作用底物。张阳等[11]也证实:野生型Cdc25B定位于GV期小鼠卵母细胞的细胞质,而Cdc25B-S321A定位于细胞核。那么14-3-3ε和Cdc25B-S321是否能结合呢? 为了证明GV期卵母细胞中14-3-3ε和Cdc25B-S321的结合,下一步将进行免疫共沉淀实验,这也是本课题组要进一步深入研究的课题。
| [1] | Lincoln AJ,Wickramasinghe D,Stein P,et al. Cdc25b phosphatase is required for resumption of meiosis during oocyte maturation[J].Nat Genet,2002,30(4):446-449. |
| [2] | Aitken A.14-3-3 proteins:a historic overview[J].Semin Cancer Biol,2006,16(3):162-172. |
| [3] | Uchida S,Kubo A,Kizu R,et al. Amino acids C-terminal to the 14-3-3 binding motif in CDC25B affect the efficiency of 14-3-3 binding[J].J Biochem, 2006,139(4):761-769. |
| [4] | Pirino G,Wescott MP,Donovan PJ.Protein kinase A regulates resumption of meiosis by phosphorylation of Cdc25B in mammalian oocytes[J].Cell Cycle,2009,8(4):665-670. |
| [5] | Astuti P,Gabrielli B.Phosphorylation of Cdc25B3 Ser169 regulates 14-3-3 binding to Ser151 and Cdc25B activity[J].Cell Cycle,2011,10(12):1960-1967. |
| [6] | Yang J,Winkler K,Yoshida M,et al. Maintenance of G2 arrest in the Xenopus oocyte:a role for 14-3-3-mediated inhibition of Cdc25 nuclear import[J].EMBO J,1999,18(8):2174-2183. |
| [7] | Duckworth BC,Weaver JS,Ruderman JV. G2 arrest in Xenopus oocytes depends on phosphorylation of cdc25 by protein kinase A[J].Proc Natl Acad Sci USA,2002,99(26):16794-16799. |
| [8] | Schmitt A,Nebreda AR.Inhibition of Xenopus oocyte meiotic maturation by catalytically inactive protein kinase A[J].Proc Natl Acad Sci USA,2002,99(7):4361-4366. |
| [9] | Zhang Y,Zhang Z,Xu XY,et al.Protein kinase a modulates Cdc25B activity during meiotic resumption of mouse oocytes[J].Dev Dyn,2008,237(12):3777-3786. |
| [10] | 赵鸿梅,张阳,徐晓燕,等.149位丝氨酸在CDC25B诱导小鼠卵母细胞减数分裂中的功能[J].细胞与分子免疫学杂志,2008,24(3):298-299. |
| [11] | 张阳,张杰,于爱鸣,等.蛋白激酶A/Cdc25B通路在小鼠卵母细胞G2期阻滞中作用的研究[J].生殖与避孕,2005,25(4):195-200. |
| [12] | Zhao X,Feng C,Yu D,et al.Successive recruitment of p-CDC25B-Ser351 and p-cyclin B1-Ser123 to centrosomes contributes to the release of mouse oocytes from prophase Ⅰ arrest[J].Dev Dyn,2015,244(2):110-121. |
| [13] | Jeong SO,Seung JH,Marco C.Wee1B,Myt1,and Cdc25 function in distinct compartments of the mouse oocyte to control meiotic resumption[J].J Cell Biol,2010,188(2):199-207. |
| [14] | Uchida S,Kuma A,Ohtsubo M,et al.Binding of 14-3-3beta but not 14-3-3sigma controls the cytoplasmic localization of CDC25B:binding site preferences of 14-3-3 subtypes and the subcellular localization of CDC25B[J].J Cell Sci,2004,117(pt14):3011-3020. |
| [15] | Xiao J,Liu C,Hou J,et al.Ser149 is another potential PKA phosphorylation target of Cdc25B in G2/M transition of fertilized mouse eggs[J].J Biol Chem,2011,286(12):10356-10366. |
 2016, Vol. 42
2016, Vol. 42


